重症肺炎又称中毒性肺炎或暴发性肺炎,是由各种病原体所致的肺实质性炎症,可造成严重菌血症或毒血症,进而引起血压下降、休克、神志模糊、烦躁不安、谵妄和昏迷。
重症肺炎最常见的致病菌为肺炎双球菌,其次为化脓性链球菌、金黄色葡萄球菌、铜绿假单胞菌、流感嗜血杆菌、厌氧菌等,还有少见的病毒,如流感病毒、鼻病毒等,这些病原体所分泌的内毒素造成血管舒缩功能障碍,并引起神经反射调节异常,引起中毒性血液循环障碍,导致周围循环衰竭,引起血压下降,并发休克,造成细胞损伤和重要脏器功能损害。
1.社区获得性肺炎(CAP)肺炎链球菌、肺炎支原体、肺炎衣原体、流感嗜血杆菌、嗜肺军团杆菌、肺炎克雷伯杆菌等。
2.医院获得性肺炎(HAP)多重耐药的铜绿假单胞菌、不动杆菌和耐甲氧西林金黄色葡萄球菌(MR SA)或其他严重耐药的肠杆菌属细菌。
3.常见耐药菌
耐青霉素肺炎链球菌(PRSP);青霉素中介耐药的肺炎链球菌(PISP);耐甲氧西林金黄色葡萄球菌(MRSA);耐甲氧西林表皮葡萄球菌(MRSE);产ESBL的肺炎克雷伯杆菌和大肠埃希杆菌(对青霉素及第1、2、3代头孢菌素类抗生素耐药);产AmpC酶的肠杆菌属(如阴沟肠杆菌)、弗劳地枸橼酸杆菌、铜绿假单胞菌属(对头霉素、第2、3代头孢菌素、单环类的氨曲南及酶抑制剂耐药);易形成生物被膜的铜绿假单胞菌;耐万古霉素肠球菌(VRE);对亚胺培南/西司他丁(泰能)耐药的嗜麦芽窄食单胞菌。
4.导致呼吸衰竭或ARDS的常见病原体包括肺炎链球菌、军团菌、肠道革兰阴性杆菌、金葡菌、卡氏肺孢子虫、结核分枝杆菌、流感病毒、呼吸道合胞病毒、疱疹病毒和伴随于吸入性肺炎的细菌。
某些特定状态下CAP患者易感染的病原体见表1,增加特定细菌感染风险的危险因素见表2。
表1 某些特定状态下CAP患者易感染的病原体

表2 增加特定细菌感染风险的危险因素

目前世界人口死因中感染性疾病仍占1/3,肺炎居首位,其中尤以重症肺炎严重威胁人类的健康。根据获得的途径不同可将重症肺炎分为社区获得性及医院内获得性重症肺炎。社区获得性肺炎(communi ty‐acquiredpneumonia,CAP)是指在医院外罹患的感染性肺实质(含肺泡壁,即广义上的肺间质)炎症,包括具有明确潜伏期的病原体感染而在入院后潜伏期内发病的肺炎,亦包括敬老院、疗养院等一些特殊场所发生的肺炎。社区获得性肺炎有报道我国患病数为250万人/年,死亡数为12.5万人/年。医院获得性肺炎(hospital acquired pneumonia,HAP)指患者在入院时不存在,入院48小时后发生的,由各种病原体引起的肺实质炎症。西方发达国家HAP占医院内感染的第2~4位,达15%,流行病学调查显示HAP发病率在0.5%~5.0%,在重症监护室则高达12.5%~25.7%,其所使用的抗菌药物占50%以上,病死率为20%~50%。我国据抽样调查HAP发病率1.30%~3.45%,据医院内感染第一位。HAP中最常见和最危重的是呼吸机相关性肺炎(VAP),其患病率9%~27%,病死率33%~71%,在ICU死亡病例中有近30%直接归因于VAP。
一、重症社区获得性肺炎
SCAP的发病机制目前仍不清楚。局部肺组织持续的炎症可产生炎症介质,如白细胞介素1β、肿瘤坏死因子α、IL-6等,当炎症介质进入血液循环后,可引起机体免疫系统的一系列反应:使单核-巨噬细胞和血小板聚集、活化,从而导致炎症介质的持续释放,诱发全身炎症反应综合征(SIRS)、脓毒症(sepsis);诱发内源性抗炎介质的释放,如PGE2、IL-4、IL-10等,抗炎症性内分泌激素释放也随之增加,如糖皮质激素和儿茶酚胺等,导致代偿性抗炎反应综合征(CARS)。如果SIRS和CARS处于平衡状态,则能保持炎症反应局限,机体内环境相对稳定。一旦炎性细胞高度活化,进一步引起炎症介质的瀑布样释放,而机体的抗炎机制不足与之对抗时,出现SIRS/CARS失衡,引起严重的脓毒症和脓毒症性休克(septic shock),并可引起多器官功能障碍综合征。
二、重症医院获得性肺炎
足够数量的致病菌到达下呼吸道战胜宿主的防御系统而导致HAP的发生。HAP的易感因素有:病人个体因素、感染控制相关因素、治疗干预引起的宿主防御能力变化等。病原菌主要来自医疗设备或周围环境,主要传播途径为病人与医务人员之间或病人间的接触。胃和鼻窦也是医院感染病原菌的潜在贮存库,病原菌可吸入或直接进入下呼吸道,其他感染途径如感染静脉导管所致的血源性感染、肠道细菌易位定植等。
(一)血常规
血白细胞高达(10~20)×109/L,中性粒细胞占80%以上,有核左移,并且出现中毒颗粒及核变性,甚至可有类白血病反应。
(二)X线表现
重症肺炎患者X线早期表现为肺纹理增多,或局限性一个肺段的淡薄、较均匀阴影,以后迅速发展为肺段、肺叶炎症。不同类型的肺炎有不同的X线表现,应注意区别。
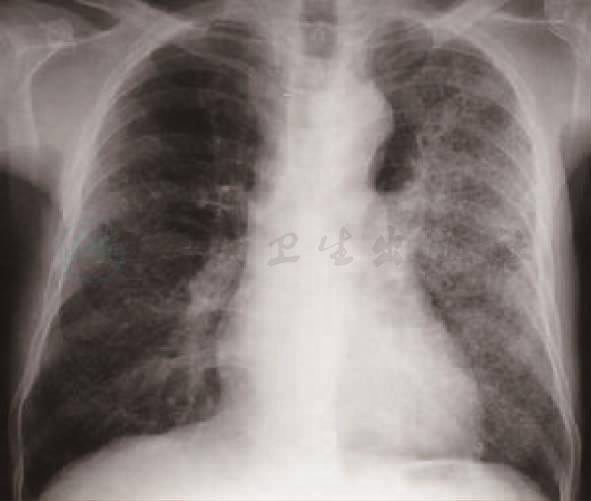
图1 支气管肺炎X线表现
支气管肺炎X线表现为病变多发生在两肺中下野的内中带(图1)。支气管及周围间质的炎症表现为肺纹理增多、增粗和模糊。小叶性渗出与实变则表现为沿肺纹理分布的斑片状模糊致密影,密度不均。密集的病变可融合成较大的片状。病变广泛,可累及多个肺叶。小儿患者常见肺门影增大、模糊并常伴有局限性肺气肿。
大叶性肺炎的早期,即充血期,X线检查可无阳性发现,或只表现为病变区肺纹理增多,透明度略低或呈密度稍高的模糊影。病变进展至实变期(包括红肝样变期及灰肝样变期),X线表现为密度均匀的致密影,如病变仅累及肺叶的一部分则边缘模糊。由于实变的肺组织与含气的支气管相衬托,有时在实变区中可见透明的支气管影,即支气管气象。炎症累及肺段表现为片状或三角形致密影,如累及肺叶,轮廓一致。不同肺叶的大叶性实变形状各不相同。消散期表现为实变区的密度逐渐减低,先从边缘开始。由于病变的消散是不均匀的,病变多表现为散在、大小不等和分布不规则的斑片状致密影。此时易被误认为肺结核,应予注意。炎症进一步吸收可只遗留少量条索状影或完全消散。临床上,症状减轻常较肺内病变吸收为早,病变多在2周内吸收。少数患者可延迟吸收达1~2个月,偶可机化而演变为机化性肺炎。
间质性肺炎的X线表现与以肺泡渗出为主的肺炎不同。病变较广泛,常同时累及两肺,以肺门区及中下肺野显著,但也可局限于一侧。表现为肺纹理增粗、模糊,可交织成网状,并伴有小点状影。由于肺门周围间质内炎性浸润,而使肺门轮廓模糊、密度增高、结构不清并有轻度增大。发生于婴幼儿的急性间质性肺炎,由于细支气管炎引起部分阻塞,则以弥漫性肺气肿为主要表现。可见肺野透亮度增加,膈下降且动度减小,呼气与吸气相肺野透亮度差别不大。
(三)痰液检查
使用抗生素前应当争取做痰培养,一般连续送3次。留痰时应注意晨起漱口、刷牙、用力咳嗽,使深部支气管的分泌物能够咳出,以保证痰的质量。咳出的痰应立即送检,不应超过2小时。
(四)动脉血气分析
由于肺部广泛炎症引起通气与血流比例失调,血气分析主要表现为动脉低氧血症和代谢性酸中毒,过度通气的患者可出现呼吸性碱中毒,肺部病变进展迅速,造成通气量下降也可出现呼吸性酸中毒。
临床上凡出现以下表现,提示病情危重。
1.全身中毒症状重,表现为持续高热,呈稽留热,体温39~40℃,起病急,寒战、高热、胸痛、呼吸困难、发绀。
2.在发病24小时内出现休克表现。
3.合并心肌损害的表现,心率增快、心律失常、奔马律。
4.查血白细胞增高,有类白血病反应。
5.血气分析提示有呼吸性酸中毒和代谢性酸中毒。
1.一般支持疗法
卧床休息,注意保暖,发热者用冰袋敷前额,或物理降温,有气急、发绀等缺氧者给予吸氧,咳嗽剧烈者可用镇咳祛痰药。
2.抗感染治疗
尽早控制感染可预防休克发生,在未查清病原体前,要根据临床表现判断最可能的病原,选择2~3种抗生素联合应用,然后根据痰培养和药敏结果选用敏感抗生素,有针对性治疗。控制感染的原则是早期、足量和联合应用抗生素。尽可能用静脉用药途径,使血液迅速达到药物的有效浓度。若为肺炎链球菌感染,要选用大剂量青霉素,每日1200万~2400万U静脉点滴。应用1周左右病变可有明显吸收,病情严重者可适当延长用药时间或换用氨基苷类、喹诺酮类抗生素。金黄色葡萄球菌对普通青霉素高度耐药,可选用苯唑西林2~3g,每6小时1次静脉滴注,或用头孢唑林4~6g/d静脉滴注。也可加用红霉素、利福平等。如果为革兰阴性杆菌或混合感染可选用下列抗生素:①第三代头孢菌素,如头孢噻肟、头孢曲松、头孢哌酮等;②新型青霉素类,如氨苄西林-舒巴坦、特美汀等;③氟喹诺酮类,如环丙沙星、氧氟沙星等;④也可以选用广谱抗生素亚胺培南-西司他汀钠,目前该药抗菌谱最广;⑤耐甲氧西林金黄色葡萄球菌(MRSA)感染,首选万古霉素,2.0g/d,分2次静脉滴注,使用时注意其肾毒性。
3.补充血容量
休克的最主要病理生理变化是有效循环容量不足,因此补充有效血容量是治疗的关键。一般选用低分子右旋糖酐、林格液、葡萄糖生理盐水以及胶体液,最初的1~2小时可输液800~1000ml,以晶体液为主,一般12小时内输液2000ml,24小时总输液量2500~3500ml,中心静脉压的测定可指导输液量,一般以0.58~0.98kPa(6~10cmH2O)为界限。年老体弱及肾功能减退者避免输液过快。
4.纠正酸碱平衡紊乱
酸中毒的患者首选5%碳酸氢钠静脉滴注,一般轻度酸中毒者静脉滴注250ml,中度至重度酸中毒者500~900ml。使用中应根据血气情况灵活应用。
5.应用血管活性药物
经过补充血容量、吸氧、纠正酸中毒等综合治疗后,如果血压仍未回升,而且症状未见好转者可以应用血管活性药物。一般认为,若患者有皮肤湿冷、四肢温暖、冷汗少、尿量少等症状时以血管舒张为主,可选用收缩血管药物。可以使用间羟胺10~40mg加入5%GS 250ml静脉滴注,也可加入多巴胺40~80mg以改善血液量的重新分布,如果患者全身发冷,面色苍白、少尿或无尿等以血管痉挛占优势时,可首选α受体阻滞剂酚妥拉明5~10mg加入5%GS 250ml中静脉滴注。
近年来,国内外用钠络酮治疗休克取得一定效果,该药为吗啡拮抗剂,可以阻滞β-内啡肽等物质产生降压作用,还有稳定溶酶体,保护心肌等作用,在休克状态下一般使用0.4~0.8mg静脉注射,也可置于500ml液体中静脉滴注。
6.抗胆碱能药物
常用的有山莨菪碱,其作用主要有抑制交感神经活动,解除血管痉挛,改善微循环灌流,稳定溶酶体膜,减少溶酶体酶的释放,解除支气管痉挛,减少支气管分泌物,保持呼吸道通畅,一般用量为10~20mg静脉注射,每半小时至1小时静推1次,病情好转后逐渐延长给药时间。
7.糖皮质激素的应用
糖皮质激素应用越早越好,在有效抗感染的基础上可以大量、短期应用,可用氢化可的松3mg/kg,每6小时静推1次,或地塞米松5~10mg/d,一般用量1~3天,情况好转后迅速撤停。
8.并发症的治疗
及时发现并发症,如脓胸、中毒性心肌炎、肺水肿、呼吸衰竭、肾衰竭,应积极进行相应的治疗。
一、社区获得性肺炎
社区获得性肺炎可以通过一些简单的措施来避免,这些措施大多在院外就能实施。肺炎链球菌疫苗和流感疫苗都是有效的,对有肺炎危险因素的患者都应使用。流感疫苗每年注射1次,而肺炎链球菌疫苗一生至少1次,对于因免疫系统受损而导致初始反应不佳的患者5年后要重复使用1次。只要患者有并存病,55岁前就应进行肺炎链球菌疫苗免疫。在某个研究中,55岁前接受免疫的人群其保护的有效性比85岁后接受免疫者高2倍。此外,在55岁前接受免疫的人群即使过了5年都很少有保护失败。而老年时才接受免疫者在3~5年内很快就出现保护失败。
二、医院获得性肺炎
(一)营养支持
营养支持应该包括在所有危重患者的常规治疗中。从预防肺炎的角度看,肠内营养较完全肠外营养更好。在一个59例创伤患者的研究中,使用空肠造瘘喂养与完全肠外营养相比,肺炎的患病率降低。肠内喂养可以预防感染,因为可以减少消化道黏膜细菌移位,并且防止肝脏由合成结构蛋白转变为急性期反应蛋白。使用肠内营养时要注意几个问题。①喂养时应减少误吸的风险,包括尽可能使患者半卧位、使用内径小的导管、持续喂养。②胃内持续喂养时,应监测胃酸pH 值,因为喂养可引起胃内酸性降低,革兰阴性细菌会过度生长。如果胃内pH值高于3.5,晚上关闭喂养管可以恢复酸性的pH。其他避免胃内碱化的方法包括使用酸性的肠内喂养,这种方法在早期的试验中没有明显效果;或把肠内营养管放置到空肠内。③喂养管避免经鼻置入,因为鼻内放置任何管道都会导致医院获得性鼻窦炎,后者本身就是医院获得性肺炎的危险因素。
(二)气管支气管分泌物引流
只要气管支气管清除机制正常,呼吸道分泌物可以与细菌结合并从呼吸道清除。危重患者黏液纤毛清除较慢,呼吸道黏液会捕获这些细菌但不能有效清除,这些细菌会增殖并引起定植和感染。传统上改善黏液纤毛清除的方法有黏液动力剂如支气管舒张剂和胸部理疗,但后者仅在患者痰量多,咳嗽无力时有效。一种新的改善黏液清除的方法是使用翻转床代替静态床。几项关于脑卒中、头部损伤和胸部钝伤患者的前瞻性研究表明侧翻床疗法与常规床相比能降低下呼吸道感染(肺炎或气管支气管炎)的发生。在内科患者中,这些益处没有那么明显,这可能与翻转床疗法不能弥补这些患者中常见的下呼吸道防御功能的受损。
另外一种方法是在气管支气管树前清除污染的呼吸道分泌物。在插管患者防止污染的口咽部分泌物经气管插管套囊旁吸入。虽然这种方法不能防止细菌直接吸入到肺内,但可以阻断病原体从口咽部到气管的转移。此种气管插管套囊上有一个抽吸通道,在声门下区,它可以直接清除误吸的分泌物。以持续抽吸声门下分泌物能降低早期肺炎的发病率。当然,避免套囊内压力过低才能抽吸声门下分泌物。
(三)预防性抗生素使用
在ICU 患者下呼吸道中吸入抗生素如多黏菌素B 或氨基糖苷类时,肺炎的发病率有明显下降,但总的病死率并无降低,因而目前仍不推荐使用。因为吸入抗生素的患者当出现肺炎时,通常是耐药病原体感染,这种肺炎通常是致命的。
目前预防性使用抗生素的方法是消化道去污术(SDD)。SDD 包括在全身抗生素使用后局部使用多种抗生素(如妥布霉素、多黏菌素B 和两性霉素B),口咽部用糊剂,胃内用浆剂。目的是在胃肠道和口咽部的细菌到达肺内之前被清除。选用特殊的抗生素清除EGNB 而不诱导耐药,但保存正常菌群以防止真菌过度生长并避免全身吸收大量的抗生素。初始全身使用抗生素以清除在SDD 开始之前处于潜伏期的任何感染。总的来说,目前还没有观察到使用SDD 的患者病死率降低。在法国的一个大型研究中,445例患者以随机双盲分组为SDD 或安慰剂组,结果没有观察到病死率的下降。













