英文名称 :acute biliary pancreatitis
中文别名 :胆石性胰腺炎
尽管不同致病危险因素引起的急性胰腺炎(acute pancreatitis,AP)的疾病过程大体类似,但急性胆源性胰腺炎(acute biliary pancreatitis,ABP)主要为胆道结石作为疾病发生原因的急性胰腺炎,有许多不同于其他病因类型的病理特征,并且治疗上也有一些其独有的特殊性。由于解剖上的密切关系,人们很早就推测胆道系统疾病与AP之间存在某种关联。但直到1901年Opie在急性胰腺炎尸检中发现乏特壶腹存在嵌顿的胆结石,才真正从临床意义上确立胆道疾病和AP的相关关系,临床上把这一病因类型确立为AP的一种独立病因类型,称为ABP。绝大多数ABP是由于胆囊结石引起,因此习惯称之为胆石性胰腺炎(gallstone pancreatitis,GP),除此之外,ABP的致病因素还包括原发性胆总管结石、胆道蛔虫症以及胆道肿瘤等。在我国,ABP占AP总数的一半以上,2006年中华医学会急性胰腺炎协作组调查了1995年至2005年全国12家医院共计6223例AP患者,发现54.4%患者为ABP。四川大学华西医院2003年至2009年收治的9421例AP患者中,ABP占47.3%,也将近一半。并且,随着超声内镜等检查手段和其他诊断技术的进步,证明一些病因不清楚而划归于特发性胰腺炎的部分病例实为胆源性胰腺炎,如胆道细小胆石或胆泥样结石的患者。因此,了解ABP的发病机制、疾病过程和临床治疗特点,对预防疾病的发生、降低疾病的病死率有非常重要的意义。
任何胆道疾病或异常都有可能导致急性胆源性胰腺炎的发生,但临床最常见和最主要的危险因素是胆结石,其他胆道疾病或异常导致的急性胰腺炎相对少见或罕见。
1.胆石症
胆囊结石导致的ABP最常见,因此临床上常习惯将ABP称为急性胆石性胰腺炎(acute gallstones pancreatitis,AGP)。约8%有症状的胆囊结石患者一生中可能发生AP,而一些从无症状的胆囊结石首次发作就可能引发AP。胆囊结石引起胰腺炎通常是胆囊收缩导致结石排出的结果,结石通过胆囊管进入胆总管下段,并持续或短暂嵌顿在壶腹部,造成Oddi括约肌损伤或失去功能,胆道过高的分泌压促成胆汁和胰液向胰腺导管反流,而引发AP。因此,这一原因常与患者进食高油脂性食物有关,临床发现很多患者在发病前12小时内有过量饮食史。此外,胆囊结石的大小和胆囊管的直径也与发病有关,直径大于1cm的结石很少引起胰腺炎,而直径小于5mm的结石和较粗的胆囊管直径更容易引发胰腺炎,因此结石大小和胆囊管直径也是决定是否会引发AP的关键因素。另外,未及时处理的胆囊结石与AP的复发有关,这已是临床医师的共识。
2.胆道微石症
胆道微石(biliary microlithiasis)指胆囊或胆道树内存在的直径≤3mm、常规超声检查或胆道造影不能检测到的结石。胆道微石也包括胆汁中胆固醇单晶体(cholesterol monohydrate crystals,CMC)和胆红素钙盐微粒(calcium bilirubinate granules,CBG)数量过高。通常,正常人的胆汁中不含CMC和CBG或数量很少。
3.胆囊固醇沉着症
胆囊黏膜下沉积的胆固醇晶体常形成“息肉”样的改变,脱落后可能形成胆囊结石,也可以随胆汁排入胆总管而诱发AP。
4.胆道蛔虫症
胆道蛔虫病在西方发达国家非常少见,而因胆道蛔虫导致的AP在这些国家或地区极为罕见。亚洲、非洲等发展中国家的胆道蛔虫症则较多见。在我国,胆道蛔虫症曾是仅次于胆石症诱发胰腺炎的另一个危险因素,尤其是南方农村地区和儿童AP的重要病因之一,在四川等地区曾经占全部ABP的1%~7%,但近年来这一致病因素导致的AP明显下降。
5.胆道手术
国外报告的大宗病例资料表明,胆囊切除术后AP的发生率为0.35%,胆道探查术后为4.5%,经十二指肠行乳头切开术后AP的发生率甚至高达20%。发生AP的原因可能与胆囊切除术时操作引起胆囊排石、损伤Oddi括约肌、引起十二指肠乳头水肿等有关。
6.壶腹周围肿瘤
约6%的胰头肿瘤和壶腹肿瘤患者发生AP。近年四川大学华西医院报告收治的AP患者病因中有58例与胰头和壶腹部肿瘤有关。但是引起AP的原因尚不清楚,可能与肿瘤压迫或堵塞胆胰管有关。
7.内镜胰胆管造影术(ERCP)/内镜下括约肌切开术(EST)
AP是ERCP的主要并发症之一,根据美国和欧洲的报道,诊断性ERCP后AP发生率是0.4%~1.5%,治疗性ERCP和EST后AP的发生率是1.6%~5.4%。
8.其他因素
如先天性胆胰管汇合异常、胆总管囊肿、壶腹周围憩室、硬化性胆管炎等也有报道。
近年来,有关AP发生、发展机制的研究取得了显著进展,这些研究从不同方面阐释了疾病发生和不同阶段的发展过程。但是,导致和参与AP发生的因素众多,有些是疾病发生的始动因素,有些是参与或加重因素,迄今,发病机制中的某些环节尚不完全清楚,但最终腺泡细胞或胰管内胰酶被激活而发生胰腺自身破坏是疾病发生中的关键一环。由于致病因素不同,疾病触发的始动环节也可能不同,胆源性胰腺炎发生的始动环节与存在的胆道疾病或畸形造成Vater壶腹部梗阻和功能失调、同时伴胰腺高分泌状态有关。
1.胆结石与共同通道
1901年,德国病理学家Opie在2例AP尸检中发现Vater壶腹部有胆结石嵌顿,从而确立了胆道结石与AP的相关关系,并据此提出了 ABP发病的“共同通道学说”(commonchannel theory)。该学说的基本点是胆结石在壶腹部发生嵌顿,致壶腹部发生梗阻并使胆胰管内压力增高,引起胆汁和胰液沿胰腺导管反流,激活胰酶并引起胰腺组织破坏。随后“共同通道学说”也获得了临床上其他证据的支持,如在胰腺炎患者胰管内发现细小胆石、在胰腺坏死组织中发现胆色素、在ABP术后T形管引流液中查到高浓度的胰酶等。在我们的临床实践中,发现AP患者存在壶腹部结石嵌顿并不少见,提示壶腹部嵌顿的结石的确可以导致疾病的发生。但也存在不少异议,重要的原因就是多数患者在就诊时并没有发现Vater壶腹部有胆结石的嵌顿。临床上也注意到AP患者胆石嵌顿于壶腹部的情况相对少见。最可能的原因是大多数病例的结石只是短暂的嵌顿,在触发胰腺炎后,结石随胆道压力增高后排入肠道,或随胆道压力增高、壶腹部扩张后,嵌顿的结石漂浮到壶腹部上方的胆管内。
对于“共同通道学说”,人们也注意到许多无法用该学说解释的其他方面的临床发现,随后胰管和胆总管汇合后的共同通道的大量解剖研究证实具有足够长度的胆胰共同通道仅在少数AP尸检中发现。因此,可能存在其他发病机制。1974年,Acosta做了一项有意义的研究,对36例ABP患者的粪便进行淘洗,结果在34例患者的粪便中找到了胆石,并提出“结石移动学说”(migratory theory),即胆系结石通过Oddi括约肌时造成的损伤可引起Oddi括约肌痉挛,壶腹部炎症、水肿,致胆胰液排泌不畅,胆胰液反流而引起胰酶激活。临床资料也表明,ABP的发生率与结石的数量和大小、胆囊管直径等因素有关。2005年,荷兰学者Venneman比较了115例ABP患者,103例梗阻性黄疸患者,79例急性胆囊炎患者以及231例单纯胆囊结石患者,研究发现ABP患者有更多数目和更小直径的胆囊结石,ABP患者的胆管结石比梗阻性黄疸患者更小,并且多因素分析指出小结石是ABP的风险因素,小的胆囊结石可能比大的结石更容易进入胆总管,小结石可能更容易造成胆总管在Oddi括约肌平面的梗阻,而大结石可能未到达Oddi括约肌平面就形成了崁顿而仅引起阻塞性黄疸。日本学者Sugiyama也进行了一项关于ABP的危险因素的研究,研究者针对临床怀疑、或先前研究报道的15种危险因素进行了前瞻性多因素分析,研究设计了严格的纳入和排除标准,共分析了143例研究对象,包括43例ABP患者的病例组和100例胆结石患者的对照组,历时11年完成,结果发现比值比(odds ratio,OR)≥2的危险因素只有3项,即最小胆结石直径≤5mm、胆结石数目≥20和胆囊管直径≥5mm,这3个因素与ABP的发生关系密切,是潜在的病因或致病的危险因素(表1,表2)。
表1 急性胆石性胰腺炎危险因素的单因素分析
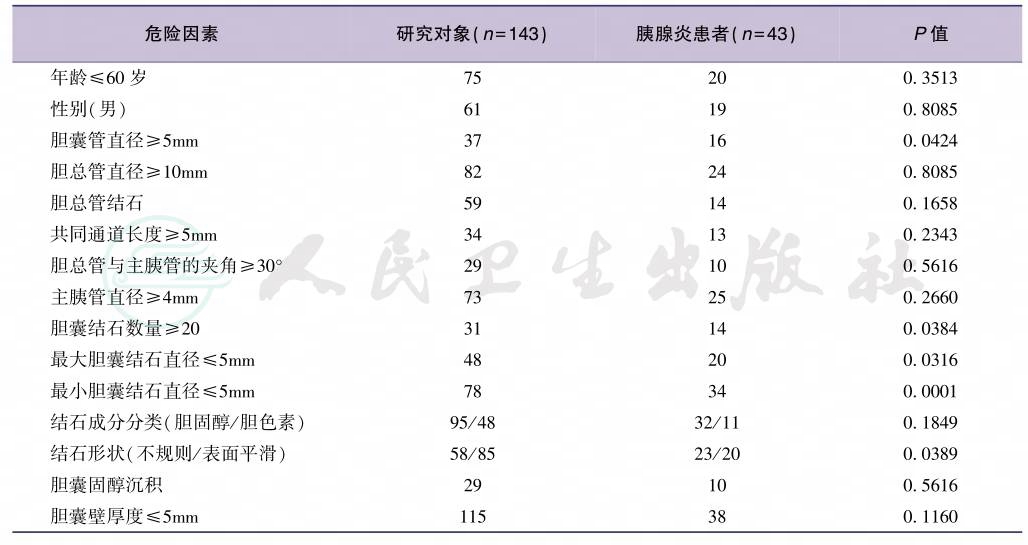
表2 急性胆石性胰腺炎危险因素的多因素分析
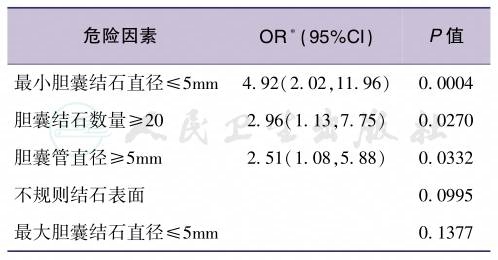
∗注:OR:odds ratio,比值比
2.胆胰管汇合的解剖学因素
多数人胆总管与胰管汇合后形成一段长短不一的共同通道。存在共同通道的人群中约三分之二的共同通道长度不足5mm。日本学者Kozumi等在1916年第一次报道了先天性胰胆管合流异常(abnomalous junction of pancreaticobiliary duct,AJPB)。一般认为成人共同通道大于15mm的长度属于AJPB。通常将AJPB分为两型:①胆总管汇入主胰管者为B-P型;②主胰管汇入胆总管者为P-B型。日本学者Yamauchi分析了1586例ERCP患者的影像学资料,发现这种异常者24例,占总例数的1.5%。这种过长的共同通道显然为胆结石嵌顿后留有足够的保持胆胰管相通的空间而成为一个重要的致病危险因素。田伏洲等统计分析1066例ERCP的资料,按Yamauchi的标准,48例可诊断为 AJPB,其共同通道的长度为 17.9± 5.06mm(15~35mm),其中 P-B型16例,B-P型32例。一些研究发现,AJPB者胰腺炎的发生率显著高于正常组,AP患者的共同通道明显长于非胰腺炎患者,并且胰管与胆管汇合处角度也较大。这种解剖变异造成胰管开口处的壶腹隔膜形成结构上的缺陷,从而抗反流功能降低,容易导致AP的发生。同时由于AJPB患者Oddi括约肌位于胰胆管汇合处以下,Oddi括约肌无法控制胰胆管合流部,胆液、胰液之间的交互反流可能导致胰腺炎的发生。
实际上,AP是一种有自身发展轨迹的自限性疾病。疾病发生后,其发展和终止主要有两种情况,临床定义的轻型者疾病过程较短、相对平和,胰腺局部病理改变主要以水肿为主,发病数天后水肿停止发展,并在一至两周内吸收消散。临床定义重症者疾病过程较长、凶险,胰腺局部病理改变从开始水肿、并出现胰周和胰腺坏死,通常局部病变持续发展到10天至两周左右,发生严重胰腺坏死改变者通常累及胰周和腹膜后广泛的区域,并导致循环不稳定和严重的全身炎症反应综合征,可能造成重要器官的一过性或持续性功能障碍,甚至死亡。如果患者在治疗帮助下度过这个过程,并且胰腺和胰周坏死组织没有继发感染,则坏死组织和渗出液渐渐被包裹,并缓慢被机化和吸收,逐渐恢复。或存在胰腺及胰周不能自行吸收巨大假性囊肿或包裹性坏死及产生的邻近器官压迫、脾静脉炎性狭窄导致的区域性门脉高压等并发症,在病情稳定后还需要相关的处理。但实际上,由于腹膜后和全身严重的炎症反应、肠麻痹、全身和肠道免疫功能的变化等原因,胰周和全身继发感染的比例非常高,因此由继发感染给机体带来更为严重的二次炎症打击。这个胰腺本身炎症后的感染性炎症更具破坏力,并且是非自限性的,疾病转归完全取决于感染的控制与否。
然而,轻型胰腺炎和中重症,甚至重型胰腺炎之间并无严格的病理界限,并且轻型显然存在向重型转化的潜质和可能。促使疾病重症化的因素很多,如释放的血管活性物质和炎性介质导致血液流变学的异常、胰腺微循环紊乱、器官损伤等。相关致病因素在疾病重症化中的作用虽不十分清楚,但从临床观察和近期的临床研究均提示某些致病因素持续存在与疾病加重有关,如持续性高脂血症等;而乏特壶腹部位的胆结石持续嵌顿导致胆胰管长时间梗阻则是ABP重症化的最常见的加重和促进因素。
目前尚缺乏打断和改变急性坏死性胰腺炎本身炎症发展过程的特异性的治疗方法和手段。现在所有采用的治疗,包括各种手术和非手术治疗,均是针对疾病过程中出现或可能出现的并发症。显然,去除致病因素的持续致病状态也是需要采取的治疗措施之一,目的就是避免疾病重症化、减少疾病过程中发生的重要器官或系统的损害、或减轻这些损害的程度。
(一)急性胰腺炎的手术治疗
在强调规范化治疗的今天,由于早期AP的有创性手术并不能带来获益,因此近20年来越来越受到限制,即同其他原因的急性胰腺炎一样,一般不主张早期对急性胰腺炎实施手术治疗,参考急性胰腺炎相关章节。
但重要的例外之一就是ABP病例,目的是尽可能早期去除胆管炎导致的并发症和急性胰腺炎重型化的因素,也就是说早期胆道疾病的处理。然而,并不是所有的ABP的胆道疾病均需要早期实施有创性的治疗干预。这个问题将在下面详细讨论。
疾病后期,部分患者因感染、并发症等需要外科手术干预,指征和方式参考相关章节。
(二)胆道疾病的指征、时机和手术方式
胆道结石和胆管炎是否行干预治疗?是否行早期急诊干预?采用何种方式?针对这些问题,了解ABP的治疗历史则有助于理解这些问题和寻找合理的答案。
20世纪80年代初发表的一个非随机的前瞻性临床对照研究,Stone发现72小时内接受外科手术治疗的36例ABP患者的死亡率与29例接受延迟手术的患者的死亡率并无差异。而1988年的一个前瞻性临床随机对照研究,Kelly和Wagner等随机将165例ABP患者分为入院48小时内实施手术的早期手术组和入院48小时后手术的延迟手术组,结果发现Ranson 11项预后指标≥4项阳性的重症患者的早期手术组死亡率为47.8%,远远高于延迟手术组11.8%的死亡率。
为何两组的结果有如此大的差异,是手术时机的原因?还是其他的原因?仔细分析两个研究发现,两项研究所采用的手术术式不同。Stone等采用了十二指肠乳突括约肌切开成形术,强调取出胆总管下端结石、畅通胰胆管引流达到胰胆管减压的目的。Kelly和Wagner则采用了在十二指肠上方切开胆总管和放置T形管的手术方式,虽达到胆总管中上段减压的目的,但难以保证胆总管下端结石的取出和胆胰管及共同通道的畅通。因此,对于共同通道或胆总管下端结石嵌顿或壶腹括约肌受损的胆源性胰腺炎患者,手术方式与患者术后的死亡率有直接的关系。
针对ABP,十二指肠乳突括约肌切开成形术在以后发表的临床研究中逐渐得到认可。但开腹手术的弊端也是明显的,尤其是与开腹手术相关并发症发生率较高。早在1978年,Classen报道通过ERCP和内镜下十二指肠乳突括约肌切开术(endoscopic sphincterotomy,ES)及网篮取出胆总管结石来治疗ABP。1980年Safrany报道内镜下十二指肠乳突括约肌切开、解除嵌顿结石,这种治疗方法对梗阻性ABP非常有效,并建议作为急性梗阻性胆源性胰腺炎的常规治疗。但鉴于当时人们对内镜手术治疗并发症的恐惧,在病程急性期实施ERCP和ES通常被认为有可能加剧病情。同时,无论Classen、还是Safrany的临床研究均不是严格设计的前瞻性对照研究,缺乏说服力,因而并未受到足够的重视。
20世纪末发表了大量的前瞻性临床随机对照研究的结果,使人们改变了以往的认识,使人们开始接受将ERCP和ES作为梗阻性ABP或重症ABP的金标准治疗。这些临床研究颠覆了临床医师多年来形成的治疗观念,使ABP的治疗步入了新的阶段。
1988年柳叶刀杂志发表了英国利物浦Neoptolemos等所做的一项关于急诊ERCP和ES治疗急性胆源性胰腺炎的临床研究,这是最早的相关问题的临床随机对照试验,研究人群共223例,符合诊断标准和纳入、排除标准而进入研究队列的ABP患者有121例,被随机分为急诊ERCP和ES组和常规非手术治疗组,并根据改良的Glasgow预测严重性评分指标将患者分为轻、重型。急诊ERCP和ES组的患者在入院72小时内接受ERCP,如果确定胆总管内有结石,立即行ES来取出结石。接受ERCP或加行ES的59例患者的并发症发生率远低于62例常规治疗的患者。分层处理后,两组轻型患者的结果类似,但急诊ERCP和ES组的重症并发症发生率为24%(6/25),明显低于常规非手术治疗组的61%(17/28),有统计学差异。ERCP和ES组的病死率也呈下降趋势,只有1例死亡,而常规非手术治疗组死亡5例。并且急诊ERCP和ES组的重症患者住院时间明显较常规非手术治疗组短(9.5天vs 17天)。这个前瞻性的临床研究证明,对重症ABP患者,发病早期实施ERCP和ES是有利的,可以降低并发症发生率、病死率,并能缩短住院时间。1993年中国香港大学的Fan等在新英格兰医学杂志发表了一篇临床随机对照研究,195例病因疑似胆源性的急性胰腺炎(有明显其他病因的病例被排除)患者被随机分为两组,一组入院24小时内即行急诊ERCP,证实壶腹或胆总管结石即行ES取石。另一组入院后接受保守治疗,如果情况恶化,再行ERCP加(或不加)ES。结果发现127例患者有胆道结石,急诊ERCP组的97例患者无一例发生胆源性败血症,而保守治疗组的98例患者中,胆源性败血症发生率为12.24%(12/98),两组有统计学差异。同时根据Ranson预后指标、入院时的血糖水平或血浆尿素氮水平将患者分为轻、重型,Ranson预后指标﹥3项阳性、或血浆尿素氮浓度﹥45mg/dl(7.4mmol/L),或血糖浓度﹥198mg/dl(11.0mmol/L)为重型,否则属于轻型。分层处理后,保守治疗组轻型患者的胆源性败血症发生率为6.90%(4/58),与急诊ERCP组的轻型患者(0/56)的差异无显著性(P=0.14)。保守治疗组重症患者的胆源性败血症发生率为20%(8/40),与急诊ERCP组的重型患者(0/41)相比,差异有统计学意义(P=0.008)。同时还发现所有发生胆源性败血症的病例均被证实在壶腹或胆总管存在嵌顿结石。其他的局部或全身的严重并发症的发生率和病死率在两组间无统计学差异,但急诊ERCP组的住院时间明显缩短。随后国内也发表了一些类似的研究,Zhou等进行的一个小样本随机对照研究,将45例ABP患者随机分为ERCP组(20例)和非ERCP组(25例),同时根据APACHEⅡ评分将患者的病情严重程度分组,所有ECRP均在24小时内进行。研究发现在重症患者中,ERCP组的并发症发生率、住院天数、花费等明显低于保守治疗组,但是在轻症患者中没有明显差异。进一步说明了重症ABP患者早期(24小时内)进行ERCP明显获益,但是对于轻症患者尚没有明显优势。但是该研究样本量太小。四川大学华西医院针对重症ABP患者进行的一项随机对照研究将53例ICU的重症ABP患者随机分为保守治疗组和ERCP/ES/ENBD干预组(48小时内),研究发现干预组明显减少了第10天的 APCHEⅡ评分(3.86±2.08 vs 6.57±1.54,P<0.05),此外没有死亡患者出现,而对照组有2例患者死亡。并由此提出对重症ABP患者进行ERCP干预是有效的,值得提倡。
但是上述这些研究并未按是否存在胆总管下端或壶腹部存在结石嵌顿及是否合并胆管炎进行分层处理,这显然导致了对主张早期进行ERCP/EST有利的结果。
1997年德国Folsch等发表在新英格兰医学杂志的多中心临床随机对照研究。将研究期间收治的可疑ABP患者339例作为研究对象,纳入研究238例,平均每个中心10.8例(6~29例),有三个中心的病例达到20例以上。病例随机分为早期ERCP组和保守治疗组。早期ERCP组126例,在疾病症状出现72小时内实施ERCP,证实胆总管或壶腹结石后行ES。保守治疗组112例,如果3周内出现胆道梗阻或败血症则行ERCP或加ES。该研究与Neoptolemos和Fan的研究策略不同的是排除了明显胆道梗阻(血清胆红素浓度﹥90μmol/L)、胆源性感染(体温﹥39℃)和持续性胆绞痛的病例。早期ERCP组中121例成功实施ERCP,其中58例因胆管结石而实施ES,57例成功取出结石。保守治疗组22例行了ERCP,其中13例行了ES。两组并发症发生率相当,但早期ERCP组全身性并发症更为严重,呼吸衰竭更为多见,而保守治疗组发生梗阻性黄疸更为多见。早期ERCP组直接死于ABP的10例,三个月内共死亡14例。而保守治疗组则分别为4例和7例。尽管统计学无差异,但早期ERCP组偏高。研究者结论是针对ABP病例,如果没有胆道梗阻和胆管炎,早期ERCP和ES并不是有益的。这个研究显然对无胆道梗阻和胆管炎的ABP实施早期ERCP和ES提出质疑。
进展与争议
对ABP患者、特别是重症患者是否早期实施ERCP/ES,近期的一些研究的结果和结论不尽一致。如最近的一项来自荷兰急性胰腺炎协作组的多中心前瞻性随机对照研究排除了合并胆管炎的急性胆源性胰腺炎患者,按照是否存在胆汁淤积分为两组,比较了早期ERCP(发病72小时内)与保守治疗预后指标的差异。胆汁淤积判定标准为胆红素﹥40mmol/L和(或)伴胆总管扩张。结果提示早期内镜介入治疗可降低伴胆汁淤积的ABP的并发症发生率。但阿根廷Oría等的研究则给出不同的答案,作者将ABP患者进行了随机分组,48小时内入组的103例 ABP患者,胆总管≥8mm和总胆红素≥1.20mg/dl(20.52mmol/L),随机分为 ERCP/ES 组(51例)和早期保守治疗组(52例),排除合并明显胆管炎患者。虽然保守治疗组胆道结石率高于ERCP/ES组,但是两组在器官衰竭评分(P=0.87),CT严重指数(P=0.88),局部并发症发生率(6%vs 6%,P=0.99),总并发症率(21%vs 18%,P=0.80)和死亡率(6%vs 2%,P=1.00)方面没有差异。该研究指出要是患者没有合并急性胆管炎,进行ERCP并不是合适的,不能作为金标准。随着临床医师对循证医学的重视,许多相关的Meta分析研究也得以发表,但得出的结论不尽一致。有些研究认为早期ERCP/EST对降低ABP的病死率无影响,不论是轻型还是重型ABP,但可以明显降低重型ABP的并发症发生率。有些研究认为不论轻型还是重型ABP患者,只要不伴有急性胆管炎,早期ERCP/EST对患者均无益处,但对伴有胆管炎或胆道梗阻的患者行ERCP能够获益。
作为临床医师,面对众多研究文献,应该客观看待这些研究的结果和结论,仔细研读和客观分析这些研究的背景和条件,才能看到研究背后的真实世界。对于胆道梗阻合并胆管炎的ABP患者,早期实施ERCP和EST可以降低并发症的发生率,这一观点基本可以在绝大多数的研究中得到反映。而对无胆管炎的ABP患者,不管胆管内有无结石或是否存在胆汁瘀滞,早期实施ERCP和EST的结果和结论则比较矛盾,尚不能给出较为一致的意见。
因此,我们不应就胰腺炎本身的轻重来讨论早期ERCP在ABP中的应用价值,而应根据胆道是否有梗阻及梗阻的程度如何来决定。因为胆道持续梗阻时间越长,AP的并发症也越多。有学者认为ABP的严重程度与胆道梗阻的持续时间有关。胆道持续梗阻本身可导致脓毒血症、多器官衰竭等并发症,我们并不能将这些并发症全部归结于AP所致。因此,我们应该把针对ABP的治疗按病情轻重、有无胆总管下端梗阻这两种情况分别进行讨论。
轻型ABP患者同其他原因的轻型患者一样,有着良好的预后。如果不存在梗阻因素,一般的非手术治疗可以达到治愈的效果,如同前述的临床随机对照研究的结果证明的一样。但如果存在梗阻性因素和(或)胆管炎,如胆总管下端结石嵌顿、急性胆管炎,临床出现胆红素升高甚至黄疸、影像学发现胆总管扩张、体温﹥39℃和持续性胆绞痛则需要及时干预,延迟或继续非手术治疗有引发胆源性败血症、继发胰腺、胰周坏死感染的风险,有研究证明胆总管下端结石嵌顿是胆源性败血症高发生率的主要原因。同时,胆总管下端嵌顿结石的存在,也是疾病重症化的重要因素。干预的方式,以ERCP和ES为首选。在缺乏ERCP和ES技术和设备的情况下,腔镜或开腹手术是必要的,手术的目的是取出嵌顿结石、引流胆道和胰管,以达到去除疾病重症化和胆源性败血症的原因。Kelly和Wagner的经验说明,单纯的胆总管切开、T形管引流效果较差,并且并发症较高。因此,取出胆管内的、尤其嵌顿的结石是非常重要的。结石嵌顿在十二指肠乳突或壶腹的患者,胰腺病变轻微,可以考虑行十二指肠乳突切开取石。胰腺不需要特别的手术处理,胰腺表面腹膜切开并非必要,但胰床放置引流管,对防止网膜囊急性液体积聚有一定作用。
重症ABP的处理,除一般重症治疗措施外,因胆源性胰腺炎的疾病特点,治疗上与其他病因的胰腺炎有所不同。2005年英国消化学会颁布的AP治疗指导大纲针对ABP建议,对怀疑或证实的ABP,同时为重症者或满足重症预测标准者,都应行治疗性ERCP,并宜在发生疼痛后72小时内实施。无论胆管内有无结石,重症患者都应行ES。但是推荐级别较低,仅为B、C级。而2015年日本肝胆胰外科学会的指南指出,对于ABP患者,若怀疑存在胆管炎或者持续胆管梗阻,合并黄疸或者进行性加重时可早期采取ERCP或ES治疗,但是并没有指出具体时间(证据级别1a,推荐等级A)。而同年发布的意大利重症急性胰腺炎诊治指南指出,对于合并急性胆管炎者,应在24小时内行急诊ERCP(证据级别1a,推荐等级A);对于胆管结石引起梗阻者,应在入院72小时内施行ERCP(证据级别2a,推荐等级 B)。国内,2013年发布的中国胰腺炎诊治指南推荐对于怀疑或已经证实的ABP患者,如果符合重症指标,和(或)有胆管炎、黄疸、胆总管扩张,或最初判断是轻型胆源性胰腺炎、但在治疗中病情恶化者,应行鼻胆管引流或EST。重症胆源性胰腺炎患者发病48~ 72小时是行内镜治疗的最佳时机,而对于轻型胆源性胰腺炎患者,于住院期间均可行ERCP治疗。虽然目前我们进入了指南时代,但是大部分指南是根据临床原始研究得出的证据,不同地域的研究得出的结论也不同。2013年Van Geenen等对有关ABP患者行ERCP治疗的8篇Meta分析及12个临床指南进行了系统评价,得出早期行ERCP治疗重症急性胆源性胰腺炎尚未得到提倡,并且对于内镜早期介入治疗ABP患者的临床疗效及手术时机尚未形成统一共识。因此,从目前得到的证据来讲,只有ABP患者伴有胆道梗阻和胆管炎,才是应该早期实施内镜治疗的公认原则。
综合上面对重症ABP处理的讨论,建议:①对无梗阻性重症病例的治疗,原则上同其他原因的重症胰腺炎,首先行非手术治疗;②入院时无明显胆道梗阻征象,在疾病治疗过程中出现胆红素升高或黄疸、影像学发现胆总管扩张、持续性胆绞痛等,应及时行ERCP,如发现结石等,同时行ES并取出结石。在无实施ERCP和ES条件的情况下,也可以利用腔镜联合胆道镜实施胆道手术;③入院时检查发现存在胆道梗阻征象,无论轻型或重型患者均即应急诊ERCP和ES;④合并胆管炎、或ERCP和ES治疗时发现胆汁混浊、脓性胆汁时,在ES的同时,应行鼻胆管引流。
(三)预防复发的胆道手术时机和方式
胆囊结石和胆道结石(继发结石为主)的存在是ABP复发的主要原因,如果不及时清除,会导致很高的胰腺炎复发率,文献报道复发率高达30%~ 50%,且一半患者的复发发生在出院后的2~3个月内。另外,相当的患者也会在短时间内再次出现胆道疾病的急性发作,如胆绞痛、胆管炎等。西班牙的一项纳入233例患者的前瞻性队列研究提示,首次发病后没有实施胆道手术的患者,复发几率增加了31倍(OR=31.5%,95%CI=7.22~137.84,P< 0.001)。胆源性胰腺炎未复发患者中,在出院30天内实施了胆囊切除或ES比率明显高于复发的患者(31.2%vs 7.3%)。
因此,预防复发是ABP治疗的重要环节,预防复发的主要手段是胆囊切除术和预防性内镜Oddi括约肌切开。胆囊切除术可以预防绝大多数的复发,这一点早已在临床上达成共识。近年来,采用预防性内镜Oddi括约肌切开术预防AP复发的尝试也见到的许多报道,临床上也逐渐广泛使用。
但胆囊切除术的时机则存在较大的争议,其实质是何时实施手术的风险最低,即并发症最低。国内外目前报道的胆囊切除的手术时间存在较大差异,部分研究认为越早越好,发病72小时之内就应该进行急诊胆囊切除术,部分学者认为发病7天内的进行手术较好,也有专家认为出院后4~8周进行胆囊切除。此外,目前大部分指南认为应该在ABP患者住院期间病情缓解后手术,2013年美国胃肠病协会颁布的AP治疗指南指出对于已知胆囊内存在胆囊结石的轻型胆源性胰腺炎患者,应在患者出院前行胆囊切除术治疗以防止AP的反复发作。此外,为防止急性坏死性胆源性胰腺炎(重型)患者发生感染,胆囊切除术应延期至患者急性炎性反应消退、胰周积液吸收或稳定时施行。如国际胰腺病协会/美国胰腺病协会(IAP/APA)的指南指出,胆囊切除术应该延迟至腹腔积液消失,此外,英国胃肠病学会强调,在重症AP患者中,胆囊切除术应推迟到所有系统性紊乱得到改善。所以胆囊切除的时间,应该根据急性胆源性胰腺炎病情轻重来决定。因为轻型和重型胰腺炎的病理改变有着质的差别和明显不同的病理过程和预后,因此,下面分别予以讨论。
1.轻型胰腺炎的胆囊切除术的手术时机
先前传统的手术时机是在患者疾病治愈出院后的2~4月内实施胆囊切除术,主要的原因是患者发病后长时间禁食、并缺乏胃肠内或胃肠外营养导致的营养状况不良。许多临床研究证实这种过迟手术的严重问题是胆囊切除术实施前的急性胰腺炎和胆道疾病的高复发率,并带来严重并发症和死亡的风险。2017年意大利的一项研究,根据修正的亚特兰大标准,比较了轻型胆源性胰腺炎患者进行延迟胆囊切除(至少4周)和住院期间胆囊切除,研究发现高达33.3%的再次住院率发生在延迟组,都是由于胆胰疾病复发。近期的一项大宗病例(17 010例轻至中度ABP患者)研究,发现符合指南的1个月内进行胆囊切除术患者的AP复发率明显低于不符合指南时间的切除患者(3%vs 13%,P<0.001)。另一项涵盖9项研究(纳入998名患者)的系统综述指出轻型ABP患者出院后有18%会因再发胆道疾病入院,中位时间为6周。
20世纪70年代末和80年代初,Ranson和Kelly根据他们自己的经验,提出疾病症状和体征缓解后实施胆囊切除术,通常是在入院治疗7天后。到80年代末,Kelly在一组前瞻性临床随机对照研究的报告中支持对轻型患者在入院48小时内实施手术,理由是缩短了患者的住院时间,而并发症发生率与48小时后实施的手术并无差异。其他陆续的研究发表了类似的观点。Kim等依据其104例ABP治疗的经验指出,胆囊切除术并不是影响治疗结果的关键因素,只要胆囊结石和胆源性胰腺炎诊断明确、并且症状缓解,轻型AP在任何时候均可以安全的实施胆囊切除术。至此,关于轻型患者的胆囊切除术的结论,基本上被大家接受,但上述的研究和结论基本上都是基于开腹手术。
进入20世纪90年代,腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)成为治疗胆囊结石的主要选择。许多报告证明了面对胆石性胰腺炎,LC技术同样安全和容易实施,并且LC成为最常见的选择。同时,也再次带来了AP时胆囊切除最佳时机的讨论。1995年,Tang等报告了一组122例轻型ABP实施LC手术的临床对照研究,一组病例在临床症状和生化指标恢复正常前实施LC,即入院一周内,另一组则在临床症状和生化指标恢复正常后实施LC,即入院一周后。结果显示两组并发症率并无差异,但早期手术组的住院时间明显缩短。同时提出在入院48小时后手术的目的是有足够的时间等待胆总管结石进入十二指肠的观点,在大多数病例可以避免术中处理胆总管结石难题。而在1999年Uhl等的研究认为对轻型ABP患者宜在入院7天后实施,并且术前应该行ERCP。2010年Aboulian等报道了一项小样本随机对照研究的结果,50例轻型ABP患者被随机分成早期LC组(入院48小时内)和晚期LC组(腹部症状缓解以及酶学指标正常),研究发现早期LC组住院时间明显短于对照组,但是术后并发症发生率没有差异,因此作者认为,对于轻型ABP患者而言,不需要等待其腹痛症状消失或实验室检查值恢复正常,入院后48小时内行LC可明显缩短住院时间,且并不会增加手术难度及术后并发症。因此,针对轻型ABP而言,LC手术的时机的主要争论并不是技术或并发症的问题,而是LC术中难度较大的胆总管结石的处理。2004年Taylor等比较了症状和生化指标开始缓解和完全恢复后实施LC的两组病例,也认为并发症和中转手术率并无差异,但早期手术的患者住院时间明显缩短。同时也提到胆总管结石的问题,他们赞成Kelly的观点,诱发胰腺炎的结石大多数通常很快进入肠道,一般不超过48小时。因此,48小时后实施LC,发生胆总管结石残留的可能性很小。因此,轻型胰腺炎通常发病1周左右症状可获缓解,此时应当是较为理想的手术时机。在行胆囊切除术同时行胆总管探查可进一步减少ABP的复发风险。Sinha提出对于轻型ABP,发病48~72小时行LC与6~8周后行LC相比,后者手术切除困难比例更高,且在6~8周内有ABP再发可能。2014年来自加拿大的一项回顾性研究,共纳入80例轻型ABP患者,所有患者术前均经历了ES手术,平均胆囊切除时间在早期组为3.3天(0.5~10天),而延迟组为 141.6天(18~757天)。延迟组60%患者经历了胆道并发症,而早期组发生率仅仅为2%(P<0.001),14例患者在延迟组要求再次住院。因此,在早期轻型胆源性胰腺患者中,当术前已经进行ES,宜及早进行胆囊切除。考虑到该研究为回顾性小样本研究,尚需更高证据级别研究证实。
近期的随机对照研究进一步证实了上述观点,来自韩国和荷兰等多个国家和地区随机对照研究,同样支持轻中型ABP早期进行胆囊切除(住院期间)比晚期切除(6周后)能够减少胆道疾病和胰腺炎的复发,缩短住院时间,也不会增加并发症和手术困难度。而延迟胆囊切除术胆结石相关的并发症诸如胰腺炎、胆管炎、胆囊炎、胆管结石等和需要内镜干预等并发症明显高于住院期间接受手术者。因此看来急性轻症ABP早期进行胆囊切除术具有明显的优势。最近的一项系统评价和meta分析也指出延迟的胆囊切除术会引起再次住院率升高,尤其是胆源性胰腺炎复发,住院期间进行胆囊切除术是合理的。
当前IAP/APA已经达成共识,针对轻型ABP患者,在同次住院期间行胆囊切除术是安全和值得推荐的。出院后择期行胆囊切除有潜在风险,患者可能因胆道疾病再发,尤其是胆源性胰腺炎而再次入院。但是早期进行胆囊切除术也有一些弊端,如在一项包括523例胆源性胰腺炎患者的多中心研究中,在出院后4~7周的胆囊切除术中观察到较少的手术并发症,出院后第2周的并发症发生率更高,虽然符合指南的胆囊切除时间(首次住院期间或出院后2周内)减少了胆源性胰腺炎的复发,但是增加了外科并发症。
结合我们自己的经验,针对轻型胆源性胰腺炎,预防性的胆囊切除术在症状缓解后实施,可以使我们有充分的时间来观察生化指标和体征的变化,在术前可以发现一些胆总管结石,这样可以使我们无论行开腹胆囊切除术或LC,尤其是后者,可以避免术后发现存在的胆总管结石的尴尬局面。在术前怀疑胆总管结石,LC宜在ERCP和ES术后实施。LC术中怀疑胆总管结石存在,可以术中经胆囊管行胆道造影,并用胆道镜取石。对于术中不能处理或怀疑的胆总管结石可以通过术后实施ERCP和ES来解决。术后发现胆总管结石者,宜采用ERCP和ES来证实和取出结石。
2.重型胰腺炎的胆囊切除术的手术时机
有研究表明重症ABP早期行胆囊切除有增加胰腺继发感染的风险,因此胆囊切除术的时机较轻症ABP应适当延后,可在患者进行针对胰腺的手术(感染灶清创引流、假性囊肿引流等)同时进行或在患者病情稳定,估计不需要针对胰腺炎行手术治疗后择期进行。这样可在一定程度上避免患者经历二次手术打击。但是患者因胰腺继发感染行手术治疗时,胆囊区的粘连包裹有可能导致胆囊无法完全分离切除,此时可据具体情况行胆囊切开取石、胆囊造瘘及胆囊大部切除。
在重症疾病症状和体征缓解后胆囊切除术的时间点则存在不同的表述,如Schachter等根据自己患者的临床经验提出手术应该在入院3周后,Uhl和Tang提出重症患者应该更晚些时实施手术,通常在4~8周,所提出的理由主要是过早的手术所导致感染的风险较大。Cameron等则提出了不同的观点,认为晚期手术导致各种原因的再入院率过高,尽管他们不能解释发生的原因,但强调胆囊切除术应更早些实施。虽然,这些观点有其道理,但这些有分歧的看法的基础都是病例回顾性研究,没有恰当的对照,因此缺乏说服力而难以认同。
2004年,美国学者Nealon等根据大样本的回顾性临床对照研究探讨了重症AP患者的胆囊切除术的手术时机,提出应根据存在的胰周并发症的病理过程来决定,引起广泛的讨论。重症患者在度过疾病急性期后主要的胰周并发症是急性液体积聚或假性囊肿,研究者的观点是实施胆囊切除术的时机,除了考虑症状和体征及生化指标恢复正常外,胰周的并发症因素必须考虑在内,这是降低手术后胰周感染率和再手术率的根本。该研究确定重症AP的标准为Ranson指标阳性﹥5项,采用CT诊断液体积聚。纳入研究的患者不包括急诊手术和坏死组织清除术的同时行胆囊切除术的病例,共纳入度过急性期的患者187例,患者的平均Ranson指标为7.9±2.1,早期手术组和后期手术组相当。研究者将其使用的重症病例胆囊切除术的时机和策略作为后期手术的定义,该策略为胆囊切除术推迟到假性囊肿自然消失或形成持久性假性囊肿。持久性假性囊肿则定义为从发病到囊肿持续存在超过6周,而假性囊肿经皮置管引流的病例则为富含胰酶的引流液﹥150ml/d并超过6周。而液体积聚定义为胰周积液超过1周,因此,该策略的观察期至少7周,胆囊切除术一般在7周后实施,并在胆囊切除术的同时行囊肿引流。而早期手术的定义为胆囊切除术在假性囊肿消失或形成持久性假性囊肿前实施,因此,胆囊切除术一般在7周内实施。78例患者行早期胆囊切除术,其中62例有液体积聚,13例(21%)胆囊切除术后液体积聚自然消失,31例(50%)实施了经皮置管引流。109例患者行后期胆囊切除术,手术前做了3~4次CT检查来监测液体积聚或假性囊肿的变化,其中89例有液体积聚,36例(40%)在没做任何干预情况下液体积聚自然消失(胆囊切除术前),16例(18%)实施了经皮置管引流。早期手术组和后期手术组伴有液体积聚或假性囊肿病例的感染率分别为47%(29/ 62)和7%(6/89),而早期和后期手术组的手术并发症发生率分别为 44%(34/78)和 5.5%(6/ 109)。早期手术组中49例患者需要再次手术行囊肿内引流,而后期手术组有53例患者需要行囊肿内引流术,但均在行胆囊切除的同时实施囊肿内引流。并且早期手术组的平均住院日明显较后期手术组长。主要结果见表13。
表13 两组再手术率、再入院率和术后并发症发生率的比较

∗与早期胆囊切除术组比较P<0.05
当前,美国胃肠病学会指南、日本急性胰腺炎治疗指南、IAP/APA协会指南均指出,重症者应延期处理胆道或在行坏死组织清除术时一并处理,也就是对伴有胰周积液的患者,胆囊切除术应当延迟到积液吸收或持续积液超过6周后,此时行胆囊切除术是安全的。
我们根据四川大学华西医院重症AP治疗的经验,除特殊情况下的早期手术和因感染因素而行的手术外,重症ABP患者经非手术治疗缓解后,如果存在需要外科处理的胰周并发症,胆囊切除术的手术时机应与并发症的手术时机同步,即在手术治疗并发症的同时行胆囊切除术。如AP后胰周假性囊肿的内引流手术通常在病后6周,因此,大多数合并胰周假性囊肿患者的胆囊切除术均在6周以后实施。如果无胰周并发症,胆囊切除术多在症状和体征消失后2~3周实施。这组患者的胆囊切除术后的并发症少见。
进展与争议
关于重症ABP后的胆囊切除术的手术时机,现在多数专家的意见渐趋一致,即胆囊切除术的时机应与胰周并发症如假性囊肿的手术时机同步,在处理假性囊肿的同时行胆囊切除术,一方面可以达到降低手术后并发症的目的,另一方面可以降低因其他原因导致的再手术率。因此,手术宜在发病后6~ 7周以后实施。如果无胰周并发症的存在,胆囊切除术可以在症状和体征完全消失2~3周后实施。但也有不同意见,即此时手术难度较大,特别是腔镜手术中转率高。
3.内镜Oddi括约肌切开术
主要针对高龄、患有严重基础疾病而手术或麻醉风险极大的人群或患者拒绝做胆囊切除术的人群,采用内镜Oddi括约肌切开术达到预防ABP复发的目的。由于内镜Oddi括约肌切开术相对简单、手术时间短、患者痛苦小,可以用于特殊人群,但指征应严格掌握。因为胆囊切除术预防ABP复发的效果更为确切,并且,未切除的胆囊的病变仍然存在,胆囊炎急性发作和胆绞痛等情况的发生难以避免和预防。
2004年Vazquez-Lglesias等报告了88例患者的前瞻性观察的结果,平均随访时间51个月(5~86个月),有2例(2.2%)AP复发,但有10例患者因急性胆囊炎复发和胆绞痛而实施了胆囊切除术,66例(78%)随访期间无症状。由此可见,预防急性胆源性胰腺炎复发,胆囊切除术应是主要应该采用的方法,内镜Oddi括约肌切开术只能作为一种备选方法而用于有限的特殊人群。近期的一项meta分析显示,轻型ABP患者行ERCP后10%患者因胆绞痛和急性胆囊炎而再次入院。因此,IPA/APA指南指出对于ABP患者已行括约肌切开且无手术禁忌证的患者,建议行胆囊切除术。因为ERCP和括约肌切开仅是防止了ABP再发,却并未解决结石引起的胆囊疾病。
(四)非手术治疗
非梗阻性ABP无论病情轻重,原则上宜采用非手术治疗,非手术治疗的原则同其他原因的急性胰腺炎类似。梗阻性ABP无论行ES或腔镜(或开腹)手术,手术干预前后仍然需要重症监护和内科性治疗。非手术治疗的原则和方法详见相关章节,本节主要针对ABP的特点进行讨论。
非手术治疗包括重症监护治疗、内科性常规治疗和中医中药治疗,无论采用非手术治疗还是手术治疗,均应在内科性常规治疗基础上实施。按目前对AP发病机制及病理生理演变规律的认识,非手术治疗的一般治疗原则包括如下。
1.监护治疗
主要针对重症而言,目的在于及早发现病情变化,及时调整治疗对策。在急性反应期重点监测内环境的稳定情况和器官损害的证据,同时对ABP需要监测胆道的变化;在感染期重点监测胰腺和胰外器官感染的证据和全身营养状况。
(1)使用多功能监护仪:
观察 T、P、R、BP、CVP、SaO2。 其中根据 BP、CVP、尿量综合分析可较准确判断血容量情况,故重症患者宜尽早实施中心静脉置管。
(2)记录24小时液体出入量:
准确记录出入量情况,可以帮助判断机体血容量状况和电解质水平。监测入量包括输液量、中药量,出量包括尿量、大便、呕吐物、出汗量等。
(3)监测血生化指标变化:
重症患者应每日或间日查电解质、血糖、肾功、血常规、淀粉酶。酌情复查血气、血脂、血细胞比容等指标。就ABP患者而言,肝功胆红素和酶学指标对判断胆道梗阻有重要价值,发病72小时内是监测的重点之一,至少每24小时复查一次。
(4)观察体征变化:
除密切观察腹部压痛、反跳痛、肌紧张等腹膜炎体征外,治疗初期肠鸣情况的观察,可以判断病情轻重和对治疗的反应。另外,对是否出现或持续存在胆绞痛和皮肤巩膜黄疸予以特别的关注。常规床旁超声检查,必要时及时行内镜超声或ERCP,以便及时发现胆道梗阻或急性胆管炎的存在。
(5)监测器官损害的临床表现和体征:
上述监测可较及时、准确地判断有无器官损害及程度,但仍需密切观察有无多器官损害的临床表现和体征。
2.使胰腺充分“休息”
措施包括下面几个方面。
(1)禁食:
目的在于减少胆胰分泌,减轻炎症反应。轻症AP禁食时间多为3~5天,重症AP根据病情轻重多为10~20天不等。恢复进食的原则为腹痛消失、腹膜炎体征不明显、肠功能恢复,后者表现为每日均有自主排便,肠鸣活跃。若胰腺坏死广泛或胰周形成液体积聚,为预防胰腺假性囊肿形成或加速胰周液体的吸收,禁食时间宜长,最好经过安全的肠内营养过渡期。
(2)保留胃管:
目的在于胃肠减压以降低腹内压,缓解腹胀、腹痛,减少胆胰分泌;并观察胃内容物性质,尤其注意有无胆汁和血性物存在,以判断是否存在胆道梗阻和及早发现消化道出血。
(3)药物:
包括雷尼替丁、法莫替丁等H2受体拮抗剂和奥美拉唑等质子泵抑制剂。这些药物可以抑制胰腺分泌外,并对应激性消化道出血有预防作用。生长抑素类药物适用于早期患者,可缓解症状,减少并发症的发生。使用疗程为5~7天。抗胆碱药物阿托品、山莨菪碱等,由于抑制肠蠕动,对肠功能的恢复不利,一般不用。
3.保持内环境稳定和代谢平衡
(1)体液和电解质平衡:
由于炎症反应和毛细血管渗漏,早期有效血容量不足和电解质紊乱可能十分突出。上述监护措施,可协助判断血容量情况和电解质水平,指导液体复苏治疗及电解质补充,具体治疗详见相关章节。
(2)控制血糖:
由于应激反应使胰高血糖素升高、肾上腺素分泌增加、胰岛素分泌减少或胰岛素受体及受体后缺陷等因素,在重症胰腺炎初期血糖升高可以十分突出,应密切监测血糖水平,使血糖控制在可接受范围内。通常采用葡萄糖液体内加入比例胰岛素的方法控制血糖。胰∶糖的比例范围为1∶6至1∶2。当血糖升高超过20mmol/L时,应采用小剂量胰岛素(0.1U/kg·h)静脉微泵泵入使血糖水平降至13.9mmol/L以下,然后停用小剂量胰岛素静脉滴注,改为单独使用比例胰岛素。由于血糖波动大,难以达到满意控制的水平,使血糖控制在11.1mmol/L以下即可。须预防低血糖发生。在治疗中监测血糖十分重要,初期血糖升高较突出,应每两小时检测血糖,血糖逐步控制后每日检测1~ 3次。
4.营养支持
营养支持包括全胃肠外营养(TPN)和肠内营养两部分(EN)。全胃肠外营养可使患者维持完整营养,预防营养并发症,度过凶险的病理过程,并能减少胰腺分泌。肠内营养可以维护肠黏膜屏障、抑制肠道细菌移位;通过空肠给予要素饮食,仍能使胰腺保持静息状态;并能促进肠道消化功能恢复,改善门静脉血流。重症胰腺炎在血流动力学和心肺稳定性允许的情况下应实施营养支持治疗,早期使用TPN,待肠道功能恢复后尽早给予肠内营养,多数轻症胰腺炎不需要特殊营养支持,手术患者在术中应同时行营养性空肠造口。
5.对症处理
剧烈疼痛可使Oddi括约肌痉挛、胰腺分泌增加甚至休克发生。疼痛剧烈患者可给予镇痛药物治疗,如布桂嗪等。不宜选用吗啡和阿托品等解痉药物,前者可能增加Oddi括约肌的张力、加重壶腹阻力,后者可抑制肠蠕动而加重腹胀,不利于肠功能的恢复。
6.抗生素的使用
非胆源性轻型AP发生胰周感染的情况罕见,通常不需要预防性使用抗生素。而胆源性胰腺炎、特别是梗阻性胰腺炎或胆管炎存在的情况下,即使轻型患者,也应使用抗生素。常规抗生素治疗并不适用于所有AP治疗,抗生素应该给予胰外感染(如胆管炎)或感染性胰腺坏死的患者。选择抗生素的一般原则为抗生素能有效穿透血-胰屏障,并在胰腺组织中的浓度超过细菌MIC水平,和抗生素的抗菌谱广,覆盖胰腺感染的常见细菌。除这个基本原则外,对胆源性AP而言,抗生素的筛选还需要考虑药物能分泌入胆道,胆汁中高浓度,并对胆道常见细菌有效。符合要求的抗生素包括依米培能、喹诺酮类、三代头孢、美洛西林、克林霉素、林可霉素等。













