英文名称 :carcinoma of endometrium
中文别名 :子宫体癌
子宫内膜癌(carcinoma of endometrium)是一种较为常见的妇科恶性肿瘤,原发于子宫体内膜层,所以又称为子宫体癌(carcinoma of corpus uteri)。在我国其发病率仅次于子宫颈癌,约占女性生殖系统肿瘤的20%~30%。在欧洲和美国子宫内膜癌好发年龄为50~69岁,较子宫颈癌为晚,多见于围绝经期或绝经后老年妇女。近年来,子宫内膜癌发病有年轻化趋势,在发达国家,40岁以上患者由2/10万增长为40/10万~50/10万。
子宫内膜癌的确切病因仍不十分清楚。但长期的无孕激素拮抗的雌激素刺激可能是重要发病因素。雌激素可以引起子宫内膜的过度增生,甚至不典型增生,进而发生内膜癌,不典型增生的癌变机会约为10%~25%。人们发现内膜癌很少发生在有排卵的绝经期前妇女,长期不排卵却有引起内膜癌的危险,这可能由于孕激素可以减少雌激素对子宫内膜的作用。值得注意的是,仍有一小部分老年妇女消瘦、雌激素水平不高,在癌灶周围可以是萎缩的子宫内膜,但所患内膜癌恶性程度高,分化差,预后不良。
常有以下高危因素:
1.雌激素对子宫内膜的长期持续刺激
(1)无排卵:无排卵型或黄体功能不良的功能性子宫出血,使子宫内膜持续受雌激素刺激,无孕酮对抗或孕酮不足,使子宫内膜过度增生。
(2)多囊卵巢综合征:多囊卵巢患者表现为不排卵,而使子宫内膜受到高水平的、持续的雌激素作用,缺乏孕激素的调节和周期性的内膜剥脱,发生增生性改变。据报道在40岁以下的内膜癌的患者中,大约19%~25%患有多囊卵巢综合征。患多囊卵巢综合征的女孩,以后发生内膜癌的可能性是正常月经同龄女孩的4倍。
(3)功能性卵巢肿瘤:能够产生雌激素的卵巢肿瘤主要有颗粒细胞瘤和卵泡膜细胞瘤。卵泡膜细胞瘤比颗粒细胞瘤有更强的雌激素刺激作用。故凡考虑为卵巢颗粒细胞瘤或卵泡膜细胞瘤的患者均应行子宫内膜活检。
(4)外源性雌激素:特别是服用外源性雌激素而未服用孕激素的绝经后妇女,发生内膜癌的危险将明显增加。当然,其发生与用药剂量、时间长短、是否中间停药以及患者特点有关。
2.与子宫内膜增生过长有关
国际妇科病理协会(ISGP,1987)将子宫内膜增生过长分为单纯型、复杂型与不典型增生过长。约有1%单纯型增生发展为癌,3%复杂型增生发展为癌,而有30%非典型增生过长发展为癌。
3.体质因素
(1)肥胖、高血压、糖尿病、体重超过正常的15%,其危险增加3倍。一些研究发现向心性肥胖发生子宫内膜癌的危险也高于外周性肥胖,甚至一些研究还发现,晚胖比早胖与子宫内膜癌关系更密切。其机制可能因为肾上腺分泌的雄烯二酮可在脂肪组织内经芳香化酶作用转化为雌酮,脂肪组织越多,转化能力越强,血浆中雌酮水平也越高。同时有学者指出机体的脂肪过多将增加雌激素的储存。人们常将肥胖‐高血压‐糖尿病,称为子宫内膜癌三联征。近年来研究认为,肥胖、高血压和糖尿病可能都是下丘脑垂体肾上腺功能失调或代谢异常所造成的后果。
(2)不育、少产或未孕者至少比生过一个孩子的妇女增加一倍的危险性。妊娠期间胎盘产生雌、孕激素,使子宫内膜发生相应的妊娠期改变。哺乳期由于下丘脑和垂体的作用,使卵巢功能暂时处于抑制状态,使子宫内膜免受雌激素刺激。尤其要指出的是,卵巢不排卵引起的不育,患内膜癌的危险性会进一步升高。因持续雌激素作用,缺乏孕激素的对抗与调解,引起子宫内膜的增生和癌变。
4.绝经后延
绝经后延妇女发生内膜癌的危险增加4倍。内膜癌患者的绝经年龄比一般妇女平均晚6年。绝经晚妇女的后几年多半并无排卵,而只是延长了雌激素的作用时间。初潮晚(初潮延迟),对子宫内膜癌是个保护作用。
5.遗传因素
约20%的内膜癌患者有家族史。有卵巢癌、肠癌或乳腺癌家族史者,患内膜癌的可能性较无家族史者高。
2018年新版NCCN指南仍采用FIGO2010年国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)子宫内膜癌分期标准以及美国肿瘤联合会AJCC(The American Joint Committee on Cancer)TNM(Tumor-Node-Metastases)分期(表1)。
表1 子宫内膜癌分期
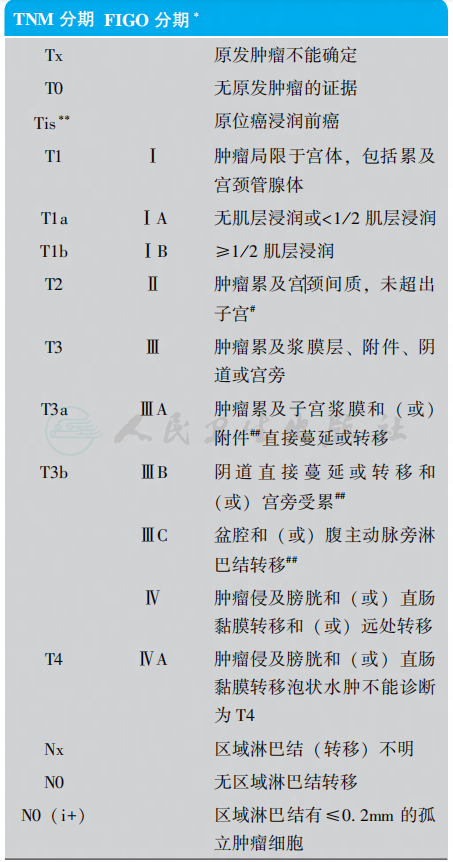
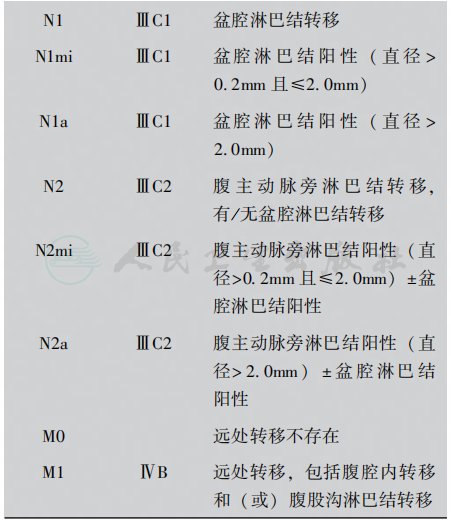
∗. G1,G2或G3;∗∗.FIGO没有0期(Tis);#. 宫颈内膜受累为Ⅰ期而不是原来的Ⅱ期;##. 细胞学检查阳性应单独报告,但不影响分期
子宫内膜癌是发生在子宫内膜的上皮性恶性肿瘤,由mul erian管上皮发生而来。肿瘤组织多数形成类似子宫内膜腺上皮的腺癌结构,但亦可形成mul erian管上皮多向分化的其他组织类型的结构。病理组织学上表现出女性生殖道各种不同部位的组织类型的形态特征,并依此而分型命名,见表2。
表2 子宫内膜癌的组织学分类

1.大体分型
病变多见于宫底部内膜以及子宫角部附近。以病变形态和范围分为弥漫型和局限型。
(1)弥漫型:较多见。肿瘤累及大部分或全部子宫内膜,癌灶常呈菜花状、多发息肉状或绒毛状,充填宫腔。瘤组织糟脆,灰白色,缺少光泽,早期虽广泛累及内膜,但较少浸润肌层。晚期常伴有出血、坏死或溃疡形成。肿瘤可浸润肌层或向下蔓延累及宫颈,甚至突出于宫颈口处。一旦癌灶阻塞宫颈管则可导致宫腔积脓。
(2)局限型:病变限于一个区域,多位于子宫底部和宫角附近,后壁比前壁多见。肿瘤形成小菜花、息肉或结节状,有时呈多发性。极早期病变可因刮宫使病灶消失,切除的子宫标本应注意在宫角处取材,寻找病变。局限型癌灶易侵犯肌层,病变虽小,但却可以浸润深肌层,晚期病变常是结节状,伴有肌层浸润。
2.组织学分型及特点
由于子宫内膜癌保留有mul erian管多向分化潜能,因此癌的发生常出现多种分化的组织成分。
(1)子宫内膜样腺癌
1)典型内膜样腺癌:癌组织由不规则的子宫内膜样腺体构成,腺体之间的间质很少或消失,有腺体“背靠背”和无间质成分的腺腔内“搭桥”或“筛状”结构。细胞核卵圆或圆形,核膜清楚,染色质增粗。有时,这种具有异型性的细胞堆积成细胞团块,核分裂增多。间质内常伴有出血、坏死及成簇的泡沫细胞。中分化的肿瘤呈部分实性结构,有时虽然以腺管状结构为主,但腺上皮细胞的异型性明显,核分裂易见,并有不正常核分裂。
子宫内膜样腺癌的组织学分级:依上述癌的分化程度分为3级,在各级子宫内膜样腺癌中,以高分化型最常见,Ⅰ、Ⅱ、Ⅲ级癌的发生率分别为50%、35%和15%。
2)子宫内膜样腺癌伴鳞状上皮分化:较常见,发生率大约为25%。肿瘤的鳞状上皮分化与腺体的分化程度平行,即分化好的腺癌伴有良性的鳞状上皮化生,分化差的腺癌则伴有鳞癌。中分化的腺癌伴鳞状上皮分化时,其鳞状上皮成分常具有一定的异型性。子宫内膜样腺癌中鳞状成分的分化程度不同,可分为:①子宫内膜样腺癌伴鳞状化生:是指肿瘤内的鳞状上皮成分是良性者,或称子宫内膜腺棘皮癌;②子宫内膜样腺癌伴鳞状分化:是指肿瘤内的鳞状上皮成分是恶性者,也称子宫内膜腺鳞癌。
3)乳头状子宫内膜样腺癌:又称“绒毛腺管状子宫内膜样腺癌”或“高分化乳头状腺癌”,形态以细长的乳头状结构为主,很像结肠的绒毛腺管状腺瘤。乳头被覆分化较好的立方或矮柱状子宫内膜样腺上皮,细胞核卵圆形,异型性较轻微,核分裂少见。与恶性程度高的子宫内膜浆液性乳头状腺癌的区别是,后者的乳头轮廓较粗短,并常伴有水肿或玻璃样变的间质,被覆的上皮细胞分化较差。
4)分泌型子宫内膜样腺癌:少见,肿瘤腺体分化好,组织结构和形态很像分泌早期的子宫内膜腺体。
5)纤毛细胞型子宫内膜样腺癌:极少见,镜下见这类肿瘤含有的腺体伴大量的纤毛细胞。肿瘤的病理分级按细胞核的分化程度,多数为Ⅰ~Ⅱ级,预后较好。
6)支持细胞型子宫内膜样腺癌:极少见。组织学上很像卵巢的支持细胞瘤。
(2)浆液性腺癌
又称乳头状浆液性腺癌,不到子宫内膜腺癌的10%。与卵巢的浆液性乳头状腺癌相似,肿瘤以复杂分支的乳头状结构为主,乳头结构突向大小囊腔,乳头中心为纤维组织和血管组成的轴心,轴心宽窄不一,常有水肿或玻璃样变,伴有裂隙样腺体、明显的细胞复层和芽状结构,核异型性较大,约1/3患者伴沙粒体。恶性程度很高,常广泛累及肌层、脉管。无明显肌层浸润时,也可发生腹膜播散。肿瘤的预后比同期的卵巢浆液性乳头状腺癌差,5年存活率为25%~36%。
(3)透明细胞腺癌
少见,约占子宫内膜癌的1%~5%。癌细胞呈实性片状、腺状、管囊状或乳头状排列,癌细胞胞质丰富,透亮,核异型居中,由鞋钉、扁平或立方形细胞组成。大部分肿瘤含有一种以上组织类型及不止一种的细胞形态,并常以某一种类型占优势,核分级常较高,恶性程度高,肿瘤的预后较差,易早期转移,5年存活率为33.9%~42.3%。
(4)黏液性腺癌
是少见的内膜癌类型,发生率占子宫内膜癌的1%~9%。要诊断此癌,肿瘤必须大部分是黏液性的,而黏液必须位于胞质内,与宫颈的黏液腺癌相似。肿瘤以分化较好的腺体结构为主,常伴有乳头状结构。分化较差时,可形成筛状或实性结构。组织化学和免疫组织化学染色同宫颈和结肠的黏液腺癌。肿瘤的预后较好,与分化好的子宫内膜样腺癌相同。
(5)鳞状细胞癌
很少见。一般发生在老年妇女,伴子宫积脓或子宫鱼鳞病。诊断必须具备以下两点:①癌内没有腺癌成分,否则为子宫内膜腺癌伴鳞癌分化;②子宫内膜鳞状细胞癌不是转移性癌,即宫颈内没有鳞状细胞癌存在,内膜癌与宫颈鳞状上皮无关系。内膜鳞癌与分化差的内膜腺癌的鉴别是腺癌中找不到细胞间桥。本类型对放、化疗均不敏感,预后差。疣状癌是一个少见的鳞状细胞癌的变异。
(6)未分化癌
非常少见。此癌几乎全由实性结构组成,癌细胞的非典型性显著,核分裂数多,恶性程度高。未分化癌包括小细胞、大细胞、巨细胞及梭形细胞型。小细胞型未分化癌含有嗜银细胞,肿瘤预后差。大细胞、巨细胞及梭形细胞型的未分化癌黏液染色阳性,诊断时需除外淋巴瘤或肉瘤。免疫组化染色:上皮膜抗原(EMA)、角蛋白(keratin)和癌胚抗原(CEA)均阳性;白细胞共同抗原(LCA)、波形蛋白(vim entin)和结蛋白(desmin)均阴性。有时多核的瘤巨细胞很像滋养细胞,诊断时需与绒癌区别,HCG阴性。
(一)治疗原则
目前,子宫内膜癌治疗的主要方法有手术治疗、放射治疗、化学抗癌药物及激素治疗。随着FIGO1988年采用的手术‐病理分期方法在临床上的广泛应用,根据手术探查及病理检查的分期结果,对病变范围及影响预后的相关危险因素作出准确地全面评估,结合患者全身状况选择制定最佳的治疗方案,对内膜癌患者进行个体化的治疗已成为当前总趋势。
(二)手术治疗
为首选的治疗方法,尤其对早期病例。其目的在于进行全面的手术‐病理分期,并同时切除子宫及肿瘤有可能的转移或已有转移的病灶。术式的选择主要根据以下几点:①术前临床分期;②术中探查,腹腔冲洗液细胞学检查,剖视子宫检查及可疑病变部位活检及冷冻切片检查;③结合患者年龄、全身健康状况、有无内科合并症等具体情况,决定术式。开腹后立即取腹水,若无腹水则注入生理盐水200ml冲洗盆腹腔,冲洗液进行细胞学检查。
1.临床Ⅰ期
经腹子宫全切或次广泛子宫切除术及双附件切除术,选择性的盆腔淋巴结及腹主动脉旁淋巴结切除术或取样术。附件可能是镜下转移的部位,所以原则上应被切除;另外,内膜癌患者增加了患卵巢癌的危险性,有时会同时存在两种肿瘤。对于低危组ⅠA~B G1患者淋巴转移率低,故可不作淋巴结切除或取样。除以上低危组外,下列临床Ⅰ期均应作淋巴结切除术:①分化3级;②分化2级、肿瘤直径大于2cm;③透明细胞癌,或乳头状浆液性腺癌、鳞状细胞癌;④大于50%肌层浸润;⑤宫颈受累者。除行淋巴结切除术外,大网膜活检也作为分期手术的内容。鉴于子宫内膜浆液性乳突状癌(UPSC)恶性程度高,早期易出现淋巴转移及盆腹腔转移,其临床Ⅰ期手术范围应与卵巢癌相同,除分期探查、切除子宫及双附件以及腹膜后淋巴结外,亦应切除大网膜及阑尾。
2.临床Ⅱ期
应行广泛性子宫切除术、双侧附件切除术、盆腔、腹主动脉旁淋巴结清扫术。对高龄、过度肥胖、有严重内科合并症,或宫颈肿瘤过大患者,可采用放疗与手术的综合治疗,先放疗后再行子宫及双侧附件切除、淋巴结取样术,可缩小手术切除范围,此类患者分期按1971年分期。
3.临床Ⅲ期及Ⅳ期
治疗应以综合治疗为主,一般首选放疗,或经放疗癌灶缩小后再行手术;部分患者可首选手术。手术行肿瘤细胞减灭术,而不主张作广泛性子宫切除术,因其可能影响晚期子宫内膜癌生存期及存活率。
(三)放射治疗
近年来在内膜癌的治疗中,虽然手术‐病理分期在人们心目中得到广泛认可并在治疗中广泛应用,但放射治疗在子宫内膜癌治疗中的重要地位仍不能忽视,特别是近20年来由于对子宫内膜癌转移途径及预后相关因素研究的深入及放射治疗技术的进展,已证实手术与放射联合治疗可明显降低局部复发,提高生存率,所以我们应该重视肿瘤的综合治疗,使放射治疗能够根据需要达到个体化。
1.放射治疗基本方法
子宫内膜癌的常用放射治疗方法为腔内照射及体外照射两种。腔内照射多用后装腔内照射,其放射源有低能放射源226镭或137铯,高能放射源为60钴或192铱。高剂量率腔内后装治疗在子宫内膜癌的腔内治疗中受到重视,亦取得满意临床效果。中国医学科学院肿瘤医院孙建衡等在用后装治疗本病时,采用了二个剂量参照点来评估腔内剂量分布的合理性。一个参照点即为子宫颈癌放疗中的A点,位于宫旁三角区内,代表着宫旁正常组织的受量;另一个称F点,位于宫腔放射源的顶端旁开子宫中轴2cm,相当于子宫角部,代表肿瘤部受量。体外照射亦为放射治疗的基本方法之一,很少单用,应用10MV以上高能X线,2野或4野照射,照射野上界为L4~5,下界为闭孔下缘包括阴道上1/2或2/3,两侧界为股骨头中心或内1/3(或骨盆侧壁外1~2cm),并有选择性使用腹主动脉旁淋巴结的照射。体外照射还有全腹照射及延伸野照射等形式。
2.放疗方案
(1)单纯放疗:由于患者自身状况如高龄、肥胖、高血压、糖尿病及病变范围等原因,手术不能适用,应按临床分期选用放射治疗。高剂量率腔内后装放疗F点剂量一般给40~45Gy。Ⅰ期患者F点剂量高于A点,对临床ⅠA期G1不宜或不愿手术患者可选用单纯腔内照射,F点剂量40~50Gy,A点剂量35~40Gy。ⅠA期G2、G3及ⅠB期患者应配合体外照射,全盆照射25~30Gy。Ⅱ期患者腔内后装放疗由于子宫颈管受累,F点、A点剂量大致相当,子宫下段剂量下降比较缓慢,配合体外全盆照射,肿瘤剂量25~30Gy(与中央挡铅照射相配合),全盆中央挡铅照射(过去习惯称四野照射)肿瘤剂量15~20Gy。Ⅲ期和Ⅳ期患者属于晚期病变放疗方案应根据患者情况个体化决定。阴道转移者,加用阴道内放疗,肿瘤剂量20~30Gy,盆腔转移明显者可适当提高体外放疗剂量同时减少腔内放疗剂量。腹主动脉旁淋巴结可疑转移者,应扩大放射野。少数患者放疗后,肿瘤局限,为手术提供机会,而最优化方案尚未确定。
(2)术前放疗:目的在于灭活肿瘤细胞,预防术中癌细胞播散和转移。放疗可缩小癌灶,创造手术条件或消除隐匿性的转移灶,缩小手术范围,对具高危复发因素者可提高生存率。对有宫颈侵犯及阴道可能受累病例术前放疗为手术保证。术前放疗需要根据期别选择放疗方案,再根据放疗方案来决定手术时机,最常用方案为术前腔内部分剂量照射:即在A及F点照射剂量大于20Gy,分2~3次,每周1次,放疗后10~14天可手术切除子宫及双附件;其他方案有术前全剂量照射(即腔内加体外照射),剂量与单纯放射治疗相同,完成治疗后2~3个月行子宫全切及双附件切除术;术前腔内全剂量照射,剂量为45~50Gy,完成照射后8~10周可行子宫及双侧附件切除;不宜行腔内照射者(如子宫大于10~12周,或有宫腔外播散病变者),盆腔外照射剂量为20Gy,于2~3周内完成,每周1次,放疗后10~14天可做手术。
(3)术后放疗:使有或可能有淋巴转移区提高治疗效果,使盆腔残留或可疑残留区得到进一步有效治疗,减少复发,补充对阴道切除的不足,减少阴道复发。术后放疗还可根据手术病理分期的结果明确癌变范围确定是否选用放射治疗及放射治疗的种类(腔内或体外)、范围及部位。除Ⅰ期患者中细胞分化良好、无肌层受累者外,均应术后补充全盆放疗,剂量40~50Gy/4~6周。对有主动脉旁淋巴转移或可疑转移者,术后可照射主动脉旁淋巴区,剂量30~40Gy/3~4周,照射前应行肾扫描,定出肾位置,保护肾脏。术前若曾接受过体外照射,术后照射应相应减少。肿瘤残存或疑有肿瘤残存、切缘离肿瘤近者,可术后加腔内治疗,于残端黏膜下10mm处,剂量10~20Gy/2~3周,术后腔内照射可在手术2周后进行。
以上所采用的为传统放疗方式,即体外全盆照射和(或)四野照射,此种照射方式消化道和泌尿系统的急慢性并发症发生率较高,特别是对于术后的患者,由于小肠进入盆腔内及术后肠粘连小肠活动受限等因素影响,并发症明显增加,严重影响了疗效和患者的生活质量,限制了局部剂量的提高。调强适形放疗具有分别调节肿瘤靶区即阴道上段、宫颈、宫体、宫旁三角区及盆腹腔淋巴引流区精确剂量照射的同时,减少邻近敏感脏器小肠、直肠、膀胱等的受量,达到提高肿瘤控制率、减少并发症的目的。因此,调强适形放疗将是今后体外照射的发展方向和趋势。
(四)化疗
子宫内膜癌对化学药物治疗有效率低。化疗用于某些特殊的病理类型、肿瘤组织分化较差、雌激素和孕激素受体的表达阴性者,或某些晚期或复发的患者。
1.单一药物治疗
因疗效不满意,近年研究已趋减少。目前发现氟尿嘧啶、长春新碱、甲氨蝶呤、足叶乙甙、顺铂(或卡铂)、阿霉素(或表阿霉素、脂质体阿霉素)、拓扑替康、异环磷酰胺及泰素等对子宫内膜癌有一定疗效。
2.联合药物化疗
多种药物联合化疗已成为近代抗癌药物治疗的趋势。在子宫内膜癌,最常用的联合化疗是顺铂加阿霉素(或表阿霉素)(PA方案),或者是顺铂加阿霉素(或表阿霉素)再加环磷酰胺(PAC方案)。据报道,对于子宫内膜癌晚期或复发病例,如果用PAC方案治疗失败后,改用紫杉醇联合阿霉素、顺铂或阿霉素联合顺铂仍然可以获得一定效果,并且前者疗效优于后者,但毒性较大。常用的还有以下化疗方案,见表3。
表3 子宫内膜癌常用的化疗方案
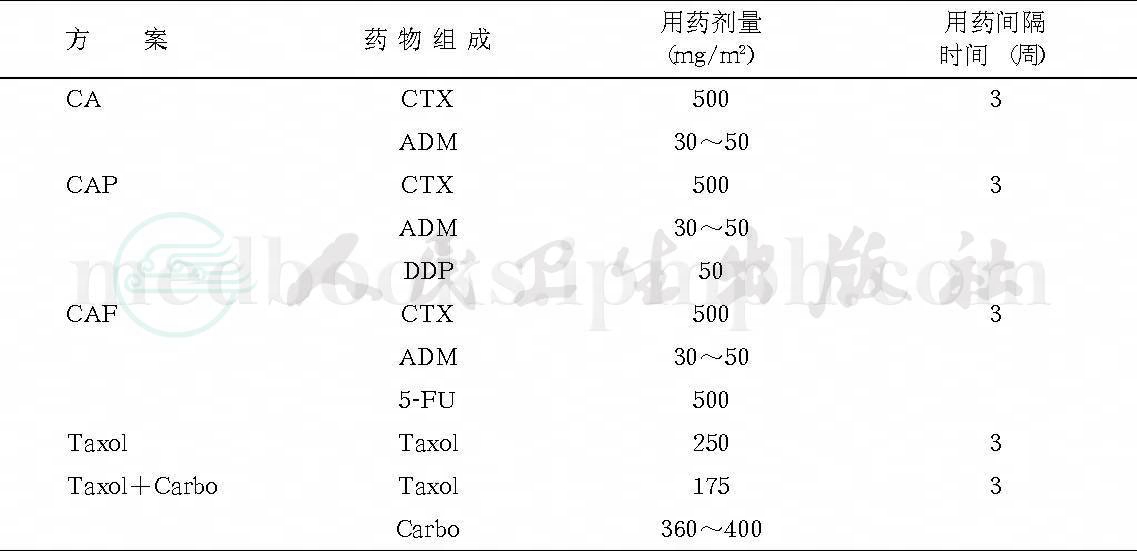
子宫内膜癌治疗中,化疗对晚期癌、复发癌以及具有高危因素的术后患者均有肯定疗效,但化疗不能代替手术及放疗。而目前晚期病例所应用的联合化疗方案,更多倾向于与孕激素类药物同时应用。
(五)内分泌治疗
主要是应用孕激素类药物治疗子宫内膜癌。孕激素抗肿瘤的作用机制可能除抑制雌激素的促增生作用外,对肿瘤细胞有直接作用,使肿瘤细胞生长受抑,促使其向成熟转化,细胞发生凋亡及萎缩。影响孕激素疗效的主要有:癌组织分化好、生长慢者,一般疗效较好;肺和骨的转移性病变的疗效,一般比盆腔或腹腔复发好。另外雌、孕激素受体(ER、PR)状况被认为是影响疗效的一项最重要因素。孕激素和雌激素受体是一种蛋白,分布于包括子宫、乳腺在内的一切孕激素和雌激素的靶器官内。激素在细胞质内和受体形成复合物,然后进入细胞核发挥其生理或药理的作用。研究证明,子宫内膜癌细胞内肯定存在着这些激素受体,而受体的有无又直接关系到孕激素治疗的效果。
目前很多学者认为除了患者具有高危因素和孕激素受体阳性,预防性孕激素治疗并不是经济有效的措施。临床上应用孕激素主要有以下几种情况:①早期内膜癌,孕激素不作为手术后的预防用药,除非患者具有高危因素,而且肿瘤的雌、孕激素受体为阳性者;②晚期或复发癌;③有手术禁忌证者;④年轻的早期内膜癌希望保留生育功能者。对年轻、需要保留生育功能的子宫内膜癌患者,孕激素治疗中,每3~6个月需行B型超声及内膜活检或诊刮,以观察疗效。
孕激素治疗子宫内膜癌,原则上剂量要大,时间要长。有学者指出治疗中孕激素如果取得客观有效率,可持续无限期应用,有些有效反应数年不变。根据孕激素剂型不同,可选择不同给药途径,以口服最常用。常用药物有:口服甲羟孕酮200~250mg/d;甲地孕酮(megestrol acetate,MA)160~320mg/d;醋酸甲羟孕酮(medroxypro gesterone acetate,MPA)200~250mg/d;己酸孕酮(长效黄体酮hydroxyprogester one caproate,HPC)250~500mg,每周2次;用药时间至少3个月。有学者主张最初3~6个月内给予大剂量,然后维持1年以上。孕激素治疗副作用一般较轻,可引起水钠潴留、浮肿、体重增加、头疼、恶心、呕吐、凝血障碍等。药物性肝炎(肝功不良者忌用)、血栓性静脉炎及高血压偶有发生。肌内注射给药者可有注射部位疼痛。一般说来,副作用于停药后即逐渐好转。
他莫昔芬(tamoxifen,TAM或TMX,三苯氧胺)为三苯己烯类物质,是一种非甾体类的抗雌激素药物,其本身具有极微弱的雌激素作用。他莫昔芬可与雌二醇竞争雌激素受体,占据受体而起抗雌激素的作用。TAM也可提高孕激素受体水平。PR水平低的肿瘤,可先用TAM使PR水平升高后再用孕激素;或TAM与孕激素同时应用,均可在晚期或复发的子宫内膜癌达到了一定的缓解率。TAM也可能直接作用于腺癌细胞,使之抑制有丝分裂。其适应证与孕激素治疗相同。一般剂量为10~20mg,每日两次,长期或分疗程应用。副作用主要是潮热、畏寒、急躁等类似围绝经期综合征的表现;也可有轻度骨髓抑制,表现为白细胞、血小板计数下降,以及头晕、恶心、不规则阴道出血或闭经。需要指出TAM在动物实验及对乳腺癌的治疗中均有导致子宫内膜癌的报道,也有学者指出TAM会使患子宫内膜癌的风险增加2~3倍,这可能与TAM的雌激素样活性有关。所以在子宫内膜癌的治疗中,单独应用TAM要十分慎重。
(六)其他治疗
近年来许多抗肿瘤靶向治疗药物在美国和欧洲获得批准上市,这些靶向药物避免了传统化疗和放疗由于缺乏特异性而带来较大的毒副作用,开创了肿瘤内科诊断和治疗相结合的新时代。近两年来,国外有报道在高危子宫内膜癌患者中应用靶向辅助治疗,并取得一定疗效,国内报道较少,这方面的治疗也有待于我们进一步研究、探索。













