英文名称 :pelvic endometriosis
盆腔子宫内膜异位症(pelvic endometriosis)指具有生长功能的子宫内膜组织出现在宫腔和宫壁肌层以外的部位,如卵巢、阔韧带、宫骶韧带、Douglas 窝、子宫浆膜层、脏层腹膜、膀胱、直肠等。生长于卵巢皮质内的异位内膜因周期性出血,可形成单个或多个含咖啡色黏稠液体的囊肿,俗称巧克力囊肿。近年来本病发病率有增多趋势。
1.子宫内膜移植学说
月经期脱落的子宫内膜经输卵管逆流入盆腔而种植在盆腔器官及腹膜上,或剖宫产手术时种植在腹部切口上。多见于有宫腔手术史、子宫颈狭窄或阴道闭锁等经血外流不畅者。
2.体腔上皮化生学说
腹腔及盆腔的体腔上皮具有高度化生能力,当受炎症、创伤刺激时,可被激活而转化为子宫内膜。
3.淋巴及静脉播散
子宫内膜进入淋巴管、静脉可远处播散,例如肺、肋膜、腹股沟、外阴等处,可发生子宫内膜异位症。
4.免疫学说
由于细胞及体液免疫功能缺陷而引致子宫内膜异位症。
5.遗传因素
约10%患者有家族遗传倾向。
6.黄素化未破裂卵泡形成
排卵功能障碍,不排卵,以致患者腹腔液中雌、孕激素水平降低,有利于子宫内膜种植。
【子宫内膜异位症与不育的关系】
患者常伴发不育,原因如下。
1.机械原因
输卵管粘连或堵塞,子宫后位及固定不动,卵巢巧克力囊肿形成及粘连,直肠子宫陷凹粘连等。
2.内分泌原因
黄体形成不良,黄体功能不足,卵巢LH受体不足,出现黄素化卵泡而无排卵等。
3.免疫功能缺陷
破坏精子或受精卵,干扰着床等。见图1。
4.前列腺素增高
患者腹腔液中前列腺素含量高可引致不孕。见图1。
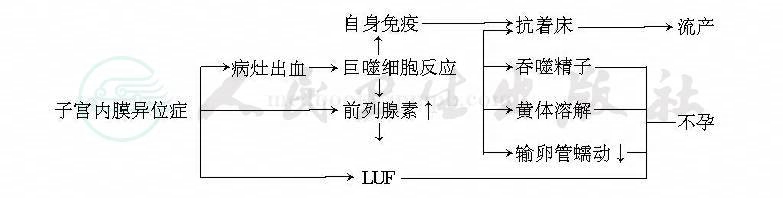
图1 早期子宫内膜异位症引起不育症的综合图解(引自:吴葆桢,1987年)
1.大体所见
异位内膜组织出血对周围组织刺激,形成粘连。异位内膜病灶在局部约数mm或1~2cm大小,呈结节状,表面紫蓝色或棕色,如果异位内膜在卵巢上,则形成囊肿,约1~10cm以上,表面呈黄白色,与周围组织粘连,手术时易破裂,囊内棕红色粘稠的陈旧性血性物流出,很像巧克力糊,故又称为巧克力囊肿。
2.显微镜下所见
镜下可见到子宫内膜腺体、上皮、间质和出血。卵巢异位内膜囊肿的上皮为子宫内膜上皮,呈高柱状,当受囊内液体压力的影响时,则变为扁平状,上皮下可见薄层间质,其中可见稀疏管状或较多腺体、小螺旋血管和吞噬含铁血黄素的吞噬细胞。
异位的内膜可以在卵巢激素的作用下发生周期性变化,但不如正常位置子宫内膜明显,异位内膜多数停留在增生早期或增生中期阶段。在位内膜与异位内膜可不同步,当在位内膜呈增生期时,异位内膜约67.5%呈增生期改变,32.5%呈分泌反应或静止状态。此种不同步表现估计可能由于异位内膜对卵巢激素不敏感,或与血液循环较差有关。当子宫内膜异位症合并妊娠时,异位内膜可出现蜕膜反应。
异位内膜在各器官的分布:
1.卵巢的子宫内膜异位
当月经血从输卵管逆流入腹腔时,首先接触到卵巢,卵巢活跃的上皮给异位内膜提供了良好的生存条件,一般多为双侧卵巢发生病变,形成囊肿,约3~10cm大小,称为卵巢子宫内膜囊肿,又称为卵巢巧克力囊肿。
2.直肠子宫陷凹的子宫内膜异位
由于重力的影响,经输卵管逆流入腹腔的月经血积存于腹腔的最低部位,故直肠子宫陷凹处的子宫内膜异位症最常见。种植灶在陷凹处可引致粘连,种植在宫骶韧带上则呈粗串状结节,有时可向下浸润到直肠阴道隔和阴道后穹窿的粘膜层。
3.宫颈的子宫内膜异位
当子宫颈受到创伤时,月经血中的内膜细胞可在裂伤处种植生长,故子宫颈电烙,激光治疗或锥形切除等手术应在月经后进行。
4.肠道的子宫内膜异位
子宫内膜可种植在任何肠管上,但以乙状结肠多见,如在肠管的浆膜层种植,多呈结节状,如向深部侵入肠管粘膜,则可发生便血,很易误认为直肠癌。
5.泌尿系的子宫内膜异位
子宫内膜种植于膀胱表面,有时向深部浸润达粘膜层发生血尿,此时通过膀胱镜取活检可以诊断。如果异位的内膜在盆腔内形成肿块,压迫输尿管,则易继发肾盂积水。
6.腹壁或会阴切口的子宫内膜异位
多见于妊娠中期剖宫取胎术,或足月妊娠剖宫产术的腹部切口,异位病灶呈结节状或团块状,约1~5cm大小,呈周期性肿胀及疼痛。偶尔异位内膜可种植于分娩时会阴的侧切伤口,呈周期性肿大及疼痛。
7.其他部位
少数患者可见腹股沟部、肺部等处有子宫内膜异位。
1.免疫缺陷
(1)巨噬细胞增高:由于经血倒流到入腹腔,内膜对腹膜的刺激,腹腔内巨噬细胞增高,吞噬内膜,分离出抗原决定簇,激发病态自身免疫反应。巨噬细胞增高有吞噬精子,损伤配子的作用。
(2)体液免疫反应增高:病态自身免疫反应刺激产生特异性免疫球蛋白,IgA上升,显示免疫排斥作用。
(3)补体C3、C4增高:由于体液免疫反应升高,激活了补体,出现损伤性反应。补体是体液免疫的最终途径,具有细胞毒作用,溶解破坏受精卵和细胞膜,干扰精子穿透和着床,导致不孕。
(4)血及腹腔液中抗子宫内膜抗体升高:子宫内膜抗原是一种源于腺上皮的糖蛋白。异位内膜细胞作为抗原,产生自身抗体(IgG、IgA),此种抗体升高对生育不利。
(5)血清及腹腔液中CA125升高:CA125是一种膜抗原,约82%的卵巢上皮癌患者血清中此抗原浓度高。1986年Barbieri等首先报道Ⅲ期及Ⅳ期子宫内膜异位症患者血清中CA125水平升高。CA125可作为诊断及监测子宫内膜异位症的手段,但敏感性不高。
2.前列腺素增高
异位内膜的前列腺素不能随经血排出体外,产生局部积蓄而增高,诱发炎性反应,增加通透性,激活缓激肽,使局部痛觉过敏,产生疼痛。子宫受前列腺素的激惹过度收缩,子宫血流量减少,局部缺血,产生疼痛,伴有恶心、呕吐、腹泻等症状。另外,异位内膜刺激产生巨噬细胞,激活了酶而产生前列腺素,前列腺素升高有融黄体作用,使孕酮下降,导致不孕或流产。
3.黄素化未破裂卵泡综合征(luteinized unruptured follicle syndrome,LUF)
卵巢内的卵泡不排出卵子,但在临床上却表现排卵的体征,即①基础体温双相;②血浆孕酮升高;③内膜呈分泌期。正常妇女LUF发生率为4.9%~7.0%,子宫内膜异位症患者LUF的发生率为29%~79%。
(1)LUF的检查方法
B型超声测排卵:患者已进入排卵期,在B超检查时见卵泡仍继续生长,不见排卵,此时诊断为LUF。本法准确率为30%。
腹腔镜检查有无排卵孔:在基础体温升高2~5天时行腹腔镜检查,若卵巢无排卵孔即为LUF,但如果排卵孔小或快速闭合,则不易诊断。本法不够准确。
测定腹腔液中甾体激素:正常排卵后腹腔液中的雌激素及孕激素浓度为血清中的5~10倍,无排卵时患者腹腔液中的雌、孕激素水平明显低于有排卵者。正常排卵者在早期分泌期腹腔液中的雌激素水平>750pg/ml,孕激素水平>80μg/ml,而无排卵者腹腔液中雌、孕激素水平低于上述值。本法诊断排卵的准确率达92%,诊断LUF的准确率达80%。
(2)LUF的发生原因有机械性及内分泌性两种
①机械性原因:输卵管梗阻、内膜异位症、盆腔手术及盆腔炎时,盆腔组织形成粘连、增厚,卵巢受周围组织粘连,卵泡不能破裂,卵子不能排出。②内分泌性原因:下丘脑-垂体-卵巢轴功能失常,促性腺激素释放激素(GnRH)失去正常的脉冲性释放频率和振幅,使LH峰无法形成,FSH与E2的分泌受到抑制,影响了正常排卵。
4.内分泌障碍
(1)黄体功能不全:基础体温显示黄体期少于10天,病理检查显示为早期分泌期内膜。
(2)催乳素(PRL)升高:子宫内膜异位症常伴有催乳素升高,发生率为21.4%~36.4%。催乳素升高可能由于腹膜应激引起神经内分泌功能失调。或局部病灶刺激腹膜体腔神经传导而引起。
(3)垂体性腺FSH及LH分泌低下。
(4)卵巢的LH受体不足。
一、分期
为了便于治疗及预测预后,国内外均根据病变的轻重程度而分期。1973年Acosta提出三期分期法,1979年美国生育协会(AFS)提出四期分期法,1985年AFS又提出改良分期法(RAFS),即用评分法分期。以上三种分期法均系经过腹腔镜检查或手术分期,不适于临床无腹腔镜检查条件及不手术的患者,故我国国内相继提出临床分期法,其中以北京协和医院妇产科提出的方法简单易记,被多数临床医师采用。见表1。
表1 子宫内膜异位症临床分期

二、治疗
由于子宫内膜异位症的病变范围广泛,轻重程度不等,诊断的早晚以及结局不同,故治疗方法因人而异,依据年龄,对生育的要求,分期以及病变的部位,分别选择适宜的治疗方法。
1.药物治疗
(1)前列腺素抑制剂:对轻症且有生育要求的患者以镇痛为主。常用药物以芬必得较好,或消炎痛栓肛门内用,此种方法的妊娠率约为52.9%。如果1年后仍未妊娠,则需药物或保守手术。
(2)孕激素疗法:本法治疗的目的是使异位内膜萎缩。常用药物有:醋酸炔诺酮8mg/d,或18-甲基炔诺酮0.5mg/d,或妇康片5mg/d,以上药物连续服用6个月,可使粘连软化,消灭小病灶,利于手术。近期疗效为60%~93%,但疗效短暂,停药后易复发,复发率为68%,妊娠率低。副作用为突破性出血,影响肝功能,易诱发卵巢巧克力囊肿破裂,故有囊肿者不宜应用此药。
(3)达那唑疗法:达那唑是人工合成的17α-乙炔睾丸酮的衍生物,有微量的雄激素活性。其治疗子宫内膜异位症的机制为:①抑制下丘脑促性腺激素释放激素(GnRH)和垂体促性腺激素的合成和释放;②直接抑制卵巢甾体激素的产生;③竞争性与子宫内膜细胞的雌激素受体结合;④增加体内雌二醇与孕酮的清除率;⑤直接抑制异位的子宫内膜细胞生长及腺体结构的形成。通过上述机制导致异位内膜萎缩而短暂绝经。用量400~800mg/d,轻症者可服400mg/d,中症者600mg/d,重症者800mg/d为宜。连续服用6~8个月,停药后4~6周月经可复潮。症状缓解率为66%~100%,体征改善为72%~85%,复发率为15%~30%,副作用为突破性出血、肝功能受损、男性化等,有肝、肾、心血管病者不宜服用。
(4)内美通疗法:即三烯高诺酮(R2323),为19去甲睾酮衍生物,能抑制脑垂体分泌FSH及LH,导致子宫内膜萎缩。用量:2.5mg,每周2次,共6个月。症状缓解率为96.7%,体征改善率为85.7%,复发率20%,副作用为少数人有肝损害,停药后肝功能即可恢复。
(5)促性腺激素释放激素激动剂(GnRH-a):此药对垂体有双相作用,当用小剂量、脉冲性输入时,可激发垂体功能,促进LH释放,诱发排卵;大剂量、长期持续输入时,可抑制垂体和卵巢功能,导致低促性腺激素血症。低雌激素血症,类似“药物性卵巢切除”,可使异位内膜萎缩。常用药物为:buserelin,nafarelin,goserelin,triptorelin(曲普瑞林,商品名达必佳)。用法:buserelin 300μg,鼻腔内滴入,每日3次,连用6个月,或buserelin300μg,皮下注射,每日3次,连用6个月。Triptorelin3.75mg,肌肉注射,每4周一次,共用6次。症状缓解率为85%~95%,体征改善率为50%~80%,复发率为16%~59%。停药后月经即可恢复。副作用为潮热,阴道干燥、头痛、阴道少量流血等,长期应用可发生骨质疏松,血清LH、FSH、E2水平明显抑制,血胆固醇和甘油三酯轻度升高。GnRH-a类药物价格较贵,可用于经达那唑治疗无效或副作用大或复发患者。
(6)三苯氧胺:是一种非甾体类抗雌激素药物。此药具有雌激素作用,能由胞浆转位到胞核中,成为抗雌激素受体复合物,停留在细胞核中,最终表现为抗雌激素的作用。用量为20mg/d,共服用6个月。症状缓解率为89.7%,体征改善率为57%。本药不抑制排卵,月经正常,镇痛作用强,副作用少,但疗效较差。
(7)棉酚:是由棉籽中提取的一种双醛萘化合物,具有直接抑制卵巢内分泌的作用,使子宫内膜萎缩,导致假绝经。用量为20mg/d,共2个月,同时加服缓释钾4片/d。近期疗效为83%,复发率为24%~41%。副作用为排钾增多,易发生低血钾。
(8)中药:治则为活血去瘀、清热解毒、调经止痛。药物为:丹参、赤芍、桃仁、乳香、没药、香附、蒲公英、紫花地丁等。
(9)米非司酮:近年来倡导服用米非司酮治疗子宫内膜异位症,100mg/d,连服3个月,可缓解疼痛,但体征无好转,50mg/d,连服6个月,疗效好,副作用少。正在追踪观察中。
2.手术治疗
(1)腹腔镜手术:已成为治疗子宫内膜异位症的主要手段,尤其对盆腔内小粘连引致的不孕更合宜,对卵巢囊肿手术的疗效不低于剖腹手术。术前通过阴道B超,磁共振及肿瘤标记物检查除外恶变的可能。对直径大于8cm者,术中先吸尽囊液,然后切除囊肿;囊肿直径为3~8cm者,可直接切除囊肿,然后行卵巢成形术。术后给予药物治疗以防复发。
腹腔镜治疗的优点为:腹腔镜下对直肠子宫陷凹、宫骶韧带、卵巢下缘、阔韧带后叶等部位的探查,均较剖腹手术清楚,而且可放大病灶,减少遗漏,又可彻底烧灼病灶。切口损伤小,恢复快,术后出院早。术后妊娠率高于或等于剖腹手术。
腹腔镜治疗子宫内膜异位症也有复发的可能,原因为:①细小异位病灶镜下有时看不到;②盆腔粘连重时,看不到腹膜或盆底深部的异位病灶,或烧灼有困难;③当子宫内膜异位症合并子宫腺肌症时,不能解决因子宫腺肌症引起的痛经。
(2)开腹保守手术:适用于要求保持生育功能的年轻患者。具有以下情况者宜行开腹手术:①腹腔镜手术或药物治疗后,不孕及疼痛无改善;②直肠子宫陷凹广泛严重粘连,硬结;③需要与卵巢肿瘤鉴别;④合并子宫肌瘤、子宫腺肌症。手术主要是分离粘连,切除病灶,剔除卵巢巧克力囊肿,修复卵巢,悬吊子宫,输卵管整形等。手术结束时腹腔内注入低分子右旋糖酐500ml以防粘连。术后短期用药物治疗以防复发。本类手术的近期疗效为90%,复发率为26%~36%。轻症者妊娠率为60%~70%。
(3)不开腹保守手术:当卵巢巧克力囊肿位于盆腔低位时,可在B超指引下,自阴道后穹窿穿刺囊腔,抽出囊液,注入与囊液同量的无水酒精,存留30min后吸出,最后以生理盐水清洗囊腔。穿刺后囊肿明显缩小,痛经减轻。本法易复发,最长复发时间为2年。
(4)半根治术:年龄大、且无生育要求者,同时合并子宫肌瘤、子宫腺肌症及卵巢巧克力囊肿者,可采用本术式,切除子宫及单侧附件。术前及术后须短期服用药物,以利手术分离粘连,减少出血。复发率为2.7%~20%。
(5)根治术:年龄大近绝经期患者,经药物治疗后疼痛未缓解,或病情复发以及病情严重者,可行根治术,即全子宫、双附件及盆腔内病灶切除。即使切除卵巢,若盆腔内仍有残留病灶,术后可能还有轻微症状,但未见复发的报道。约50%患者术后出现绝经期综合征。
3.其他部位异位症的治疗
(1)腹壁切口子宫内膜异位症:多发生在中期妊娠剖宫产或足月妊娠剖宫产。病灶在下腹切口腹直肌筋膜前方,少数病灶可达腹直肌及腹膜。首先采用药物治疗,如达那唑或内美通等。如无效可手术切除病灶,手术范围应广,须离开病灶至少2cm,以免遗漏,术后应服用药物3~6个月。
(2)产科会阴侧切伤口子宫内膜异位:先采用药物治疗,然后切除病灶。
(3)直肠前壁子宫内膜异位:病灶小者可服用药物或电灼,若病灶>2cm,或穿透直肠前壁达肠腔粘膜时多伴有血便,药物治疗往往效果不佳,可手术切除部分直肠壁,行肠壁吻合术。
(4)宫颈子宫内膜异位:宫颈的子宫内膜异位是由于手术操作导致宫腔内膜的种植,或淋巴道的移植,宫颈局部呈点状或片状紫红斑点,取组织活检即可确诊。浅层病灶可行深部电烧灼,摧毁异位的内膜可获治愈,如果病灶深,或反复出现病变,可在药物治疗后手术切除病灶。
开腹手术注意事项:
1.开腹保守手术时,以电烧灼局部小病灶代替缝合,减少渗血。
2.尽量切除大病灶,松解粘连 用“0”号丝线将输卵管缝合于两侧盆腔腹膜上,避免再次粘连。
3.彻底清洗腹腔、盆腔,洗后注入以下药物:①放置0.25%普鲁卡因200ml及氢化可的松50mg;②低分子右旋糖酐或林格液冲洗盆腔;③盆腔内放置庆大霉素8万单位及地塞米松2mg及透明质酸酶1500单位于生理盐水40~250ml;④肝素1支加生理盐水1000ml冲洗盆腔。
治疗小结:
1.轻度子宫内膜异位症采用期待疗法或药物治疗。
2.中度子宫内膜异位症首选药物治疗,无效时可考虑手术。
3.重度子宫内膜异位症先用药物控制2~3周,然后择期手术。
4.有卵巢内膜异位囊肿时,最好选用达那唑或GnRH-a治疗,避免囊内内膜脱落出血或破裂。
三、子宫内膜异位症恶变
近年来由于对子宫内膜异位症的重视及追随检查,不少作者陆续报道恶变的病例,其恶变率平均约为0.7%~1.0%。1993年蒋氏报道恶变率为15%,恶变者年龄平均为50.9岁,最小者34岁,最大者68岁。
异位内膜恶变的诊断标准:①显微镜下见到良性异位内膜向恶性移行的组织像,或癌灶与异位子宫内膜共存于同一部位,且有连续关系;②排除是由其他部位浸润或转移而来的癌灶;③良性的子宫内膜腺体和间质同时存在;④有较长的子宫内膜异位症病史。
蒋氏报告8例异位内膜的恶性肿瘤中,7例发生在卵巢,组织学类型为内膜样腺癌、透明细胞癌、混合性乳头状囊腺癌及交界性浆液性瘤。1例发生在直肠壁的异位内膜病灶,组织类型为内膜样腺癌。8例中7例为Ⅰ期,均进行了手术及化疗,其中6例存活,1例为Ⅳ期,死亡。
上海妇婴保健院报道7例卵巢异位内膜囊肿恶变,占卵巢异位内膜囊肿的1.2%。恶变的囊肿平均大小为7cm×6cm×7cm,所有肿瘤镜下均见短而宽的乳头及囊肿转变为癌的移行区。7例中4例发生在绝经后,1例手术后死亡。
临床须注意以下几点有恶变的可能:
1.当子宫内膜异位症的绝经妇女有盆腔痛及肿块时,应高度怀疑为内膜异位病灶恶变。
2.以往有子宫内膜异位病史,现在并发阴道出血或便血。
3.盆腔肿块>10cm,或生长快者,应剖腹探查有无恶变。
4.有内源性雌激素活动,或接受单纯雌激素替代疗法者。
预防恶变的措施:
1.有子宫内膜异位症的近绝经期妇女,特别是有卵巢内膜异位囊肿者,手术时应考虑行全子宫及双附件切除术。
2.更年期的子宫内膜异位症患者,应定期采用孕激素治疗,以对抗雌激素对异位内膜的持续刺激作用。
1.月经期不做妇科内诊,不要过强劳动,过强体育运动等,以防经血倒流。
2.及时矫正生殖道梗阻。
3.月经期、月经前或刮宫术后,当月不行输卵管造影、通气、通液。
4.剖宫产、中期妊娠剖宫取胎或切开子宫时,应保护好腹部切口。
5.人工流产吸引手术时,尽量避免过高负压。













