英文名称 :hypertriglyceridemia
高甘油三酯血症根据原因,可分为继发性和遗传性。继发性因素包括饮食、生活方式、疾病、药物等。导致高甘油三酯血症的继发性因素见表1。
表1 甘油三酯升高的继发性原因

 甘油三酯升高的另外一大原因是甘油三酯代谢相关的蛋白及酶类基因变异。包括脂蛋白酯酶(LPL)、ApoCⅢ、Apo AV、ApoCⅡ等。
甘油三酯升高的另外一大原因是甘油三酯代谢相关的蛋白及酶类基因变异。包括脂蛋白酯酶(LPL)、ApoCⅢ、Apo AV、ApoCⅡ等。
根据2010年我国流行病学调查显示,在被调查的97 409例18岁以上居民中,高甘油三酯血症(HTG)、低高密度脂蛋白胆固醇(HDL-C)血症和高低密度脂蛋白胆固醇(LDL-C)血症的患病率分别为11.3%、44.8%和2.1%,我国成年人血脂异常以低HDL-C血症、HTG为主。另一项对全国血脂异常的流行病学调查显示,我国血脂异常患病率为36.4%,其中HTG和低HDL-C的患病率分别为12.7%和14.3%,但对血脂异常的知晓率、治疗率和控制率仅分别为31.0%、19.5%和8.9%。此外,DYSIS中国研究纳入25 317例服用他汀至少3个月以上患者,结果表明,仍有高达47.6%的患者伴HTG和/或低HDL-C血症;在极高危患者人群中,其比例更高达74.2%。所以,我国HTG患病率高,经他汀治疗后仍有大量的患者TG未达标,治疗尚不充分,需要关注。
早期的队列研究进行单变量分析时,观察到TG与冠心病间存在正相关,但经总胆固醇(TC)或LDL-C校正后,两者的正相关强度明显减弱。一项荟萃分析纳入了68个前瞻性队列研究,结果表明,校正年龄、性别后,TG与冠心病及缺血性脑卒中存在显著正相关;但经确立性冠心病危险因素、HDL-C和non-HDL-C被校正后,TG与心脑血管疾病的关联强度显著减弱,因此TG不能被视为冠心病的独立危险因素。然而,前瞻性流行病学研究的结果却支持TG是冠心病独立的危险因素。例如,哥本哈根心脏研究发现,非空腹TG水平升高与缺血性卒中、心肌梗死、缺血性心脏病和死亡的风险相关。对26 509名45岁以上的体检健康的美国妇女进行了11.4年的随访,发现餐后TG水平升高与冠心病密切相关,且这种相关性独立于传统冠心病危险因素;而空腹TG水平却与心血管事件的关联性非常小。此外,即使用他汀控制LDL-C后,高TG的患者仍然具有较高的心血管风险。ACCORD研究中,TG≥2.3mmol/L、HDL-C≤0.9mmol/L的患者主要心血管事件发生率较其他患者升高71%。
血浆TG水平升高与冠心病的关系难有定论,在很大程度上与其生物学特性有关。血浆TG水平个体间变异大,在人群中呈偏态分布;同一个体的血浆TG水平波动大,且TG水平越高者,波动越大;TG与HDL-C及ApoAⅠ呈显著负相关,三者间关联复杂性可导致分析时难以确定其因果关系。此外,高甘油三酯血症常与某些疾病(如2型糖尿病和代谢综合征)相伴随,因此难以判定TG升高是否仅仅是因胰岛素抵抗或代谢综合征所致。
由于血浆TG主要存在于乳糜微粒(CM)、极低密度脂蛋白(VLDL),两者统称为富含甘油三酯脂蛋白(TRL),血浆TG水平增高反映了TRL水平增高。食物摄取外源性TG和肝脏合成及分泌富含TG的VLDL均可导致血浆TG升高。
食物摄取的外源性TG经胰脂肪酶水解后由肠道吸收,在小肠内合成CM并进入淋巴管,后经由胸导管运送至血液。CM中的TG被脂蛋白脂酶(lipoprotein lipase,LPL)水解后形成残粒,并能够被肝细胞识别并摄取。空腹时,血浆中一般无CM存在。食物来源的CM体积较大,无法直接进入血管内皮下,但其残粒和LDL一样,可侵入血管内皮下。其中的TG被LPL降解之后可形成游离脂肪酸,刺激局部引起炎症反应,促进单核细胞吞噬脂质形成泡沫细胞。
肝脏中内源性TG的合成由底物供给(游离脂肪酸的可用性)、能量平衡(肝糖原的储存水平)和激素状态(胰岛素与胰高血糖素之间的平衡)所调节。上述情况可促进脂肪组织中的游离脂肪酸向肝脏流入,并刺激VLDL的合成和分泌。因此,肥胖、单糖和饱和脂肪摄入过多、缺乏运动、饮酒和胰岛素抵抗者常伴有HTG。
TG轻至中度升高反映VLDL及CM增多,两者颗粒较大,无法穿过动脉内皮进入动脉壁,但它们经分解代谢后可生成残粒脂蛋白,后者由于颗粒变小,不仅可以穿过动脉内皮,还可滞留于血管内皮下层组织基质中,具有直接致动脉粥样硬化作用。但多数研究提示,TG升高很可能是通过影响LDL或HDL的结构而具有致动脉粥样硬化作用。
血浆中各种脂蛋白之间不断进行脂质交换。当TG升高时,胆固醇酯转移蛋白(CETP)活性增加,导致富含甘油三酯脂蛋白(如CM、VLDL)的TG向富含胆固醇的脂蛋白即HDL、LDL转移,而后者的胆固醇酯反向转移给CM、VLDL,因而CM、VLDL中的胆固醇酯含量增高。转移至HDL、LDL中的TG增加至一定程度,被肝脂酶、LPL水解,形成密度增大、颗粒变小的HDL和LDL颗粒。小而致密的HDL因为体积小,表面的ApoAⅠ易脱落,被肾脏清除,导致HDL-C下降;小而致密的LDL不易被肝脏代谢,在血管中停留的时间更长,更容易沉积在血管壁,促进动脉粥样硬化性病变。TG的浓度越高,脂质交换越活跃。脂质交换结果:使sLDL浓度增加,HDL及HDL-C水平降低,二者与高TG血症统称为致粥样硬化性脂蛋白;使CM、VLDL中的胆固醇酯增加,在LPL作用下,生成富含胆固醇酯的残粒,具有强致动脉粥样硬化作用。
在糖尿病或糖尿病前期的患者中,胰岛素抵抗导致脂肪分解增加,游离脂肪酸释放增加,使肝脏产生的TG和VLDL颗粒增多,发生HTG。这是糖尿病患者因血脂异常导致动脉粥样硬化性病变的病理生理机制之一。
高TG血症患者的治疗策略主要取决于个体TG升高的程度和心血管危险程度。属心血管病高危者,可从降TG治疗中获益。因此,TG轻中度升高(2.3~5.6mmol/L),LDL-C达标仍为主要目标,non-HDL-C达标为次要目标。对TG临界升高(1.7~2.3mmol/L)者,治疗重点是减轻体重和增加体力活动;当TG升高至2.3~5.6mmol/L时,除了上述非药物治疗外,对高危患者应考虑使用药物(较大剂量的降LDL-C药物或加用烟酸、贝特类药物),使non-HDL-C达标。TG重度升高时(≥5.6mmol/L),应立即启动降低TG的药物治疗,以预防急性胰腺炎。
1.治疗性生活方式改变
饮食治疗和改善生活方式是血脂异常治疗的基础措施,无论是否选择药物调脂治疗,都必须坚持控制饮食和改善生活方式。
(1)饮食
改变饮食结构,合理搭配食物中脂类、糖类和纤维的比例,有利于高甘油三酯血症的治疗。总脂肪摄入量每减少5%,TG水平可降低6%。糖类的摄入量过高(占供热量60%以上)可引起HDL-C浓度下降及TG浓度升高,所以糖类的供热量比例不应超过60%。有研究发现,膳食纤维可降低2型糖尿病患者的血浆TG水平。同时,流行病学调查及临床研究观察到,地中海式饮食即富含不饱和脂肪酸及膳食纤维的食物结构,可降低血浆TG水平,并可减少心血管事件发生的危险。
(2)控制体重
肥胖是血脂代谢异常的重要危险因素。体重下降的程度可直接影响血浆TG的浓度。体重每下降5%~10%,可使血浆TG浓度下降20%。
(3)运动
无论有无体重下降,有氧运动都能降低血浆TG水平。有氧运动能增加肌肉组织中LPL的活性,促进TG的代谢分解,减少肝脏中TG和VLDL的合成和分泌。此外,运动还可降低餐后TG,减弱高胆固醇低脂餐后所致血浆TG升高的效应。
(4)限酒和戒烟
吸烟者血清TG水平显著高于不吸烟者。此外,吸烟使餐后TG水平明显升高,此效应独立于影响血脂水平的其他因素之外。
在甘油三酯水平正常的个体中(即空腹甘油三酯水平低于150mg/dl),采集血样前食用低脂早餐(进食脂肪<15g),餐后甘油三酯水平不应该超过200mg/dl。这种情况下,不需要再进行任何高甘油三酯血症相关的检测。然而,若餐后甘油三酯水平达到或高于200mg/dl,那么建议在随后的时间(2~4周)进行空腹脂蛋白测定。其监测流程,见图1。
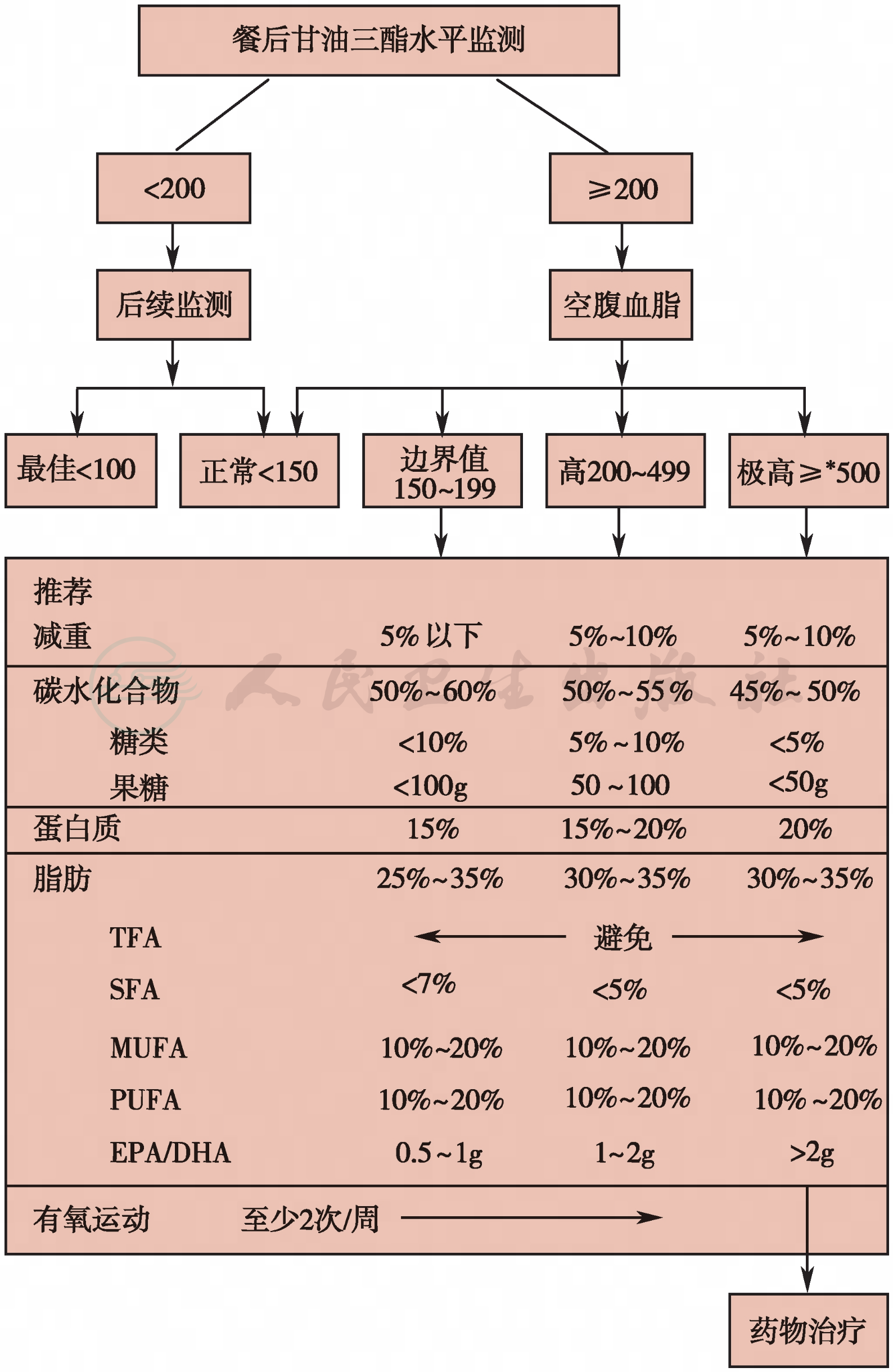
图1 高甘油三酯的监测与管理
注:TFA:反式脂肪酸;SFA:饱和脂肪酸;MUFA:单不饱和脂肪酸;PUFA:多不饱和脂肪酸;EPA/DHA:花生酸/二十二碳六烯酸。*若患者出现因高甘油三酯导致的胰腺炎而引起的腹痛,患者须停止食用任一类型脂肪[中链甘油三酯(MCT)可以除外],直至患者甘油三酯水平经治疗显著降低。
2.调脂药物治疗
对于心血管疾病患者及其高危人群,经过积极的生活方式干预后,TG仍未能满意控制者(TG≥2.26mmol/L)应考虑药物治疗。临床上常用于降低TG的调脂药物有贝特类、烟酸类、他汀类、ω-3脂肪酸、胆固醇吸收抑制剂等,其中以贝特类作用最强。临床上,推荐根据患者LDL-C是否达标决定调脂药物的选择:LDL-C未达标者首选他汀治疗,LDL-C已达标者选用贝特类、烟酸或ω-3脂肪酸等。
(1)贝特类
贝特类调脂药是过氧化物酶增生体活化受体α(PPARα)激动剂,可激活PPARα,增强脂蛋白脂酶(LPL)的脂解活性,有利于清除富含TG的脂蛋白,降低血浆TG水平和升高HDL-C水平,并使LDL亚型由小而密颗粒向大而疏松颗粒转变。其适应证为高甘油三酯血症或以TG升高为主的混合型高脂血症和低HDL-C血症。许多临床试验的亚组荟萃分析结果提示,对于有高TG伴低HDL-C的患者,贝特类药物可明显降低TG和升高HDL-C水平,延缓冠状动脉粥样硬化的进展,降低心血管事件风险,以降低非致死性心肌梗死和冠状动脉血运重建术为主,对心血管死亡、致死性心肌梗死或卒中无明显影响。
常用的贝特类药物有非诺贝特片,每次0.1g,3次/d。常见不良反应与他汀类药物类似,包括肝脏、肌肉和肾毒性等,血清肌酸激酶和ALT水平升高的发生率均<1%。绝对禁忌证为严重肝、肾疾病。
(2)烟酸类
烟酸也称作维生素B3,属人体必需维生素,有明显的调脂作用。大剂量时具有降低TC、LDL-C和TG以及升高HDL-C的作用。适用于高甘油三酯血症,低HDL-C血症或以TG升高为主的混合型高脂血症。烟酸的调脂作用机制可能与抑制脂肪组织中的脂解和减少肝脏中VLDL合成和分泌有关。此外,烟酸也可增强LPL的活性,加速TG的水解。早期临床试验结果荟萃分析显示,烟酸能降低冠状动脉事件,改善心血管预后。但由于在他汀基础上联合烟酸的临床研究提示与单用他汀相比无心血管保护作用,目前欧美多国已将烟酸类药物淡出调脂药物市场。
烟酸有普通和缓释剂两种剂型。普通剂型不良反应明显,现已不常用;目前多采用缓释型烟酸,其不良反应明显减少。缓释片常用量为每次1~2g,1次/d。建议从小剂量(0.375~0.5g/d)开始,睡前服用;4周后逐渐加量至最大常用剂量。常见不良反应有颜面潮红、高血糖、高尿酸、上消化道不适等。绝对禁忌证为慢性肝病和严重痛风。
(3)他汀类
该药为细胞内胆固醇合成限速酶,即HMGCoA还原酶的抑制药,使细胞内游离胆固醇减少,反馈性上调细胞表面LDL受体的表达,因而使肝细胞LDL受体数目增多及活性增强,加速LDL的清除,可显著降低血浆TC和LDL-C。此外,他汀类也可加速血液中VLDL残粒、IDL的清除,因此还具有一定的降低TG及升高HDL-C作用。
(4)ω-3脂肪酸
鱼油主要成分为ω-3脂肪酸,均属必需脂肪酸,临床制剂为其乙酯。ω-3脂肪酸可降低TG和轻度升高HDL-C,对TC和LDL-C无影响。ω-3脂肪酸通过调节VLDL和乳糜微粒代谢降低血清TG水平,其效果与使用的剂量及基础TG水平有关。当血TG正常时该药几乎没有调脂作用;若血TG>2.26mmol/L,ω-3脂肪酸(4g/d)治疗可使TG降低30%。其与贝特类合用用于治疗严重高甘油三酯血症,也可与他汀类合用治疗混合型高脂血症。早期有临床研究显示,高纯度鱼油制剂可降低心血管事件,但未被随后的临床试验证实。
最新的REDUCE-IT研究显示,鱼油的主要成分EPA(二十碳五烯酸)能降低动脉粥样硬化心血管病及其高危患者的心血管事件。该研究纳入8 179例或确诊的ASCVD患者,或糖尿病合并一个以上冠心病危险因素的患者,接受稳定的他汀(-/+依折麦布)治疗后LDL-C在40~100mg/dl,空腹TG在135~499mg/dl。随机接受EPA 2g,bid或安慰剂治疗,经过平均4.9年随访,EPA组较对照组TG下降19.7%,一级终点(心血管死亡,非致死性心肌梗死,非致死性卒中,冠脉重建或不稳定型心绞痛)下降25%(P<0.001)。这一结果支持对于ASCVD患者接受他汀治疗后TG仍高的患者给予高剂量的鱼油治疗。另一项关于他汀+鱼油的ASCVD二级预防的大规模临床研究(STRENGTH)也即将公布结果。
鱼油类药不良反应较少,最常见为轻微消化不良。有2%~3%服药后出现恶心、腹胀等消化道症状,少数病例出现转氨酶或肌酸激酶轻度升高,偶见出血倾向。
(5)胆固醇吸收抑制剂(依折麦布)
其作用于小肠细胞的刷状缘,减少胆固醇的吸收,降低小肠中的胆固醇向肝脏中的转运,使得肝脏胆固醇贮量减少,从而降低血浆胆固醇水平。此外,其可促进肝脏LDL受体的合成及加速LDL的代谢。依折麦布单用或与他汀类联用,可降低血浆LDL-C水平18%~25%,同时使TG降低约5%,HDL-C水平升高约3.5%,且二者间未见有临床意义的药物间药动学的相互作用,安全性和耐受性良好。临床SHARP研究和IMPROVE-IT研究均证实他汀联合依折麦布能有效降低心血管事件。
依折麦布推荐剂量为10mg/d。其不良反应轻微且多为一过性,主要表现为头痛和消化道症状,与他汀联用也可发生转氨酶增高和肌痛等副作用,禁用于妊娠期和哺乳期。
总之,心血管病高危患者即使经过大剂量他汀强化降胆固醇治疗后,患者仍然存在发生大血管及微血管事件的风险,即心血管剩留风险。心血管剩留风险与诸多因素有关,高甘油三酯血症作为我国最常见的血脂异常,与心血管剩留风险的相关性值得关注。在2型糖尿病、肥胖、代谢综合征和/或心血管病患者中,TG升高和HDL-C降低是构成心血管剩留风险的主要血脂异常表型。因此,在关注胆固醇的同时,也应充分重视对TG增高等其他类型血脂异常的筛查和干预。
3种降低TG药物对不同血脂指标调节作用见表3。
表3 烟酸、贝特类以及ω-3脂肪酸的调脂效应
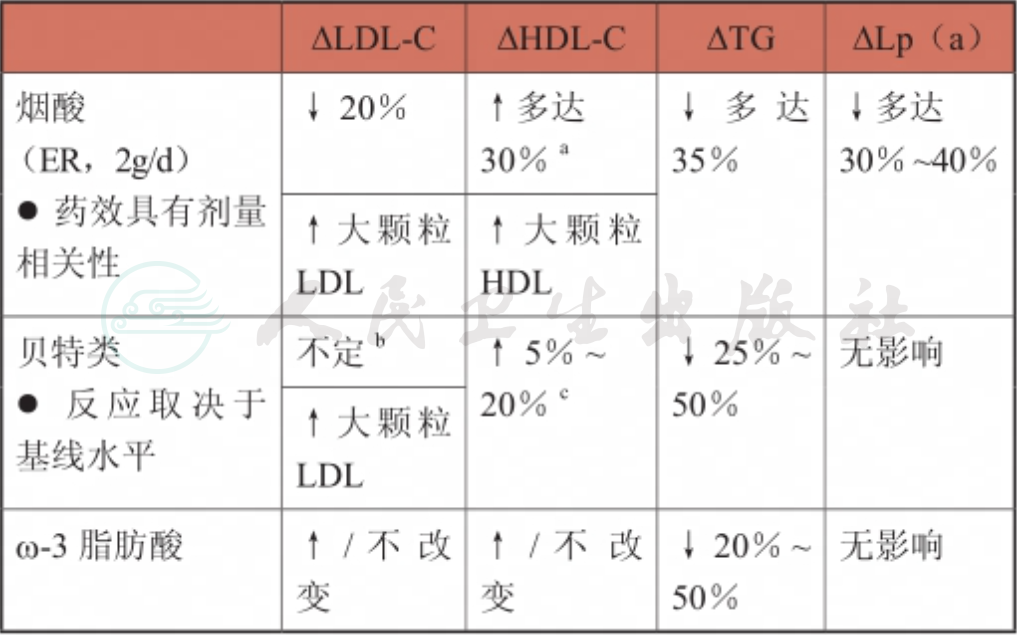
注:a.在2型糖尿病(T2DM)的患者中,已观测到HDL-C的持久性升高,升高幅度可达25%;b.对LDL-C的影响主要取决于所用贝特类药物的具体种类、脂质的基线水平以及血脂异常的代谢特质;C.虽然在短期研究中,贝特类药物可使HDL-C的水平升高多达20%,但在对T2DM患者的长期研究中,HDL-C对非诺贝特的反应却显著减弱(在研究结束时<5%),提示对于这个群体,贝特类药物并不能升高HDL-C的水平。













