上消化道出血(upper gastrointestinal hemorrhage)包括食管、胃、十二指肠、胆道、胰以及空肠上段病变的出血。上消化道大出血的临床病死率与病因误诊率目前仍然较高,分别约在10%与20%。上消化道大出血,是一种需要紧急处理的常见疾病,应尽快明确病因和出血部位,若不及时处理,可危及生命。
引起上消化道出血的原因甚多,不同国家、甚至同一国家的不同地区有差异,如:①食管病变,食管和/或胃底静脉曲张、食管炎、食管癌,食管贲门黏膜撕裂综合征(Mallory-Weiss综合征等;②胃十二指肠病变,胃十二指肠溃疡、胃癌或其他肿瘤(间质瘤、淋巴瘤等)、息肉、胃幽门黏膜脱垂、十二指肠憩室炎、胃手术后病变(吻合口溃疡、残胃癌)、Zollinger-Ellison综合征、胃血吸虫病、胃或十二指肠结核以及重度钩虫病等;③邻近器官或组织病变,胆道出血、胰腺癌、急性胰腺炎并发脓肿溃破导致出血、动脉瘤破入食管、胃或十二指肠等;④全身性疾病,应激性溃疡等;⑤血管异常,先天性血管畸形、Dieulafoy病等,以及一些罕见的病因和疾病。但引起大出血且急需外科处理的,在我国仍以下列几种比较常见。
1.胃、十二指肠溃疡
又称消化性溃疡,其出血占上消化道出血的40%~50%。大出血的溃疡一般位于十二指肠球部后壁或胃小弯(图1)。都由于溃疡基底血管被侵蚀破裂所致,多数为动脉出血。特别在慢性溃疡,因伴有大量瘢痕组织,出血的动脉裂口缺乏收缩能力,往往引起不能自止的出血。
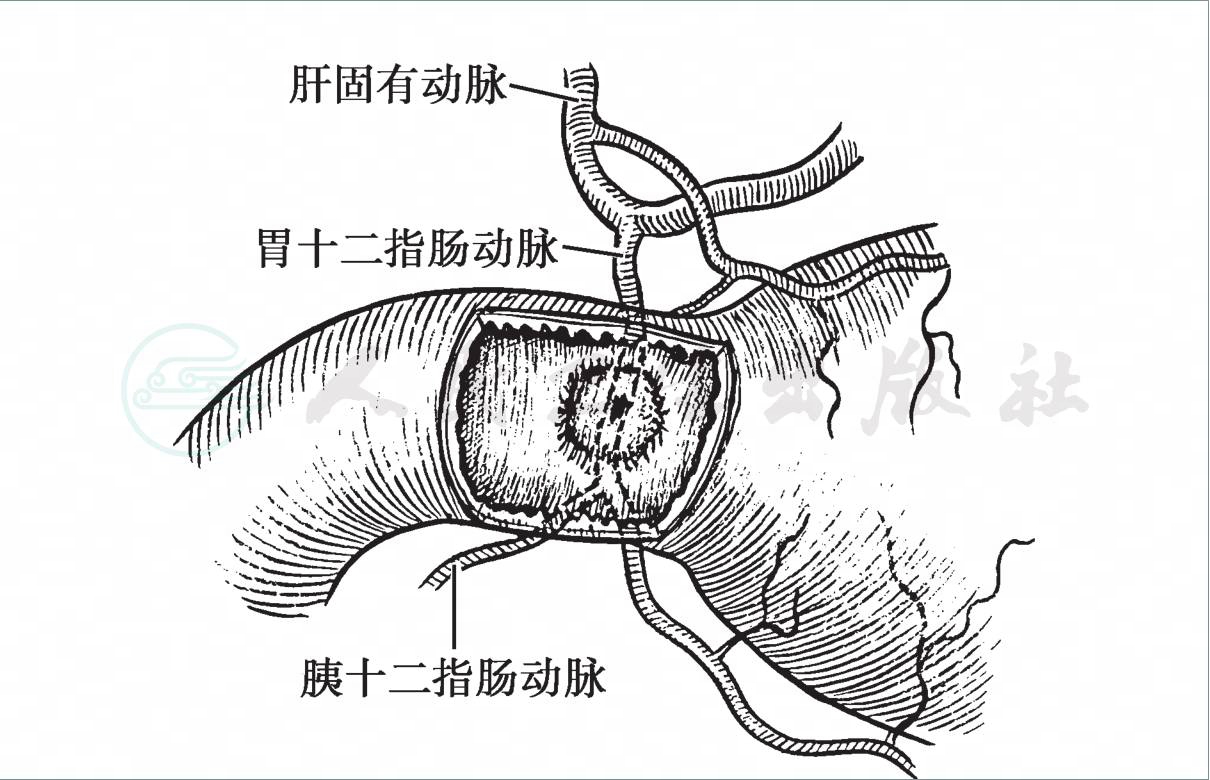
图1 十二指肠球部后壁溃疡出血
溃疡基底胃十二指肠动脉被侵蚀破裂
幽门螺杆菌(H.Pylori)和非甾体类抗炎药已被公认为消化性溃疡两个最主要的病因,非甾体类抗炎药、保泰松、阿司匹林、吲哚美辛以及肾上腺皮质激素可的松等有促进胃酸分泌增加和导致胃黏膜屏障损害,抑制黏液分泌,加重胃局部血管痉挛的作用,长期应用较大剂量可引起急性溃疡形成,或使已有的溃疡活动化,导致大出血。
胃部分切除术后或在单纯的胃空肠吻合术后,在胃和空肠吻合口附近可发生溃疡,在前者发生率为1%~3%,在后者可高达15%~30%。发生时间多在术后2年内,也可在手术后十余日。50%吻合口溃疡会出血,且可引起大出血,常不易自止。
2.门静脉高压症
其所占的比例逐渐增多,约占20%。肝硬化引起门静脉高压症多伴有食管下段和胃底黏膜下层的静脉曲张。黏膜因曲张静脉而变薄,易被粗糙食物所损伤;或由于胃液反流入食管,腐蚀已变薄的黏膜;同时门静脉系统内的压力又高,以致曲张静脉破裂,发生难以自止的大出血。近年来有研究机构对大量肝硬化门静脉高压症病人所做的长期随访中发现,很多病人于1~3年内有胃肠道出血。D’Ainico等经过10年随访,大量内镜检查有食管静脉曲张的肝硬化病人,发现15%病人的死因为食管曲张静脉破裂出血。每年新增加的肝硬化病人中会有11%出现静脉曲张。
3.应激性溃疡或急性糜烂性胃炎
应激性溃疡出血约占20%。近年,国外报道其发生率已明显上升。如休克、重症感染、严重烧伤(Curling溃疡)、严重脑外伤(Cushing溃疡)或大手术、血液系统疾病、尿毒症、肺心病、心力衰竭等均可引起。在这些严重情况下,交感神经兴奋,肾上腺髓质分泌儿茶酚胺增多,使胃黏膜下血管发生痉挛性收缩,组织灌流量骤减,导致胃黏膜缺血、缺氧,直接破坏胃黏膜屏障,胃腔H +反向弥散明显增加,以致发生表浅的(不超过黏膜肌层)、边缘平坦的溃疡或多发的大小不等的糜烂。这类病变位于胃的较多,位于十二指肠的较少,常导致大出血,很难自止。
4.胃癌
占2%~4%,肿瘤表面可形成局部溃烂或溃疡。侵蚀血管而引致大出血。胃癌引起的上消化道大出血,黑便比呕血更常见。
5.邻近器官或组织的疾病
胆道出血,又称胆血症(hemobilia)。各种原因导致血管与胆道相通,引起血液涌入胆道,再进入十二指肠,统称胆道出血。胆道出血是胆道疾病和胆道手术后的严重并发症,国内胆道出血以肝内胆管出血为主,引起胆道出血常见的原因如胆石症、胆道蛔虫病等引起肝内局限性感染,可致肝内胆小管扩张合并多发性脓肿,脓肿直接破入门静脉或肝动脉分支。肝癌、胆囊或胆管癌、术后胆总管引流造成的胆道受压坏死侵蚀血管以及肝动脉瘤破入胆道等。此外,如胰腺癌、急性胰腺炎并发脓肿溃破导致十二指肠出血;动脉瘤破入食管、胃或十二指肠引起的出血等。
6.消化道的血管异常
内镜和血管造影技术的广泛应用,使消化道血管病变引起的出血越来越被人们所认识,血管病变可以是单发或多发,可以是独立的异常表现或是全身性疾病、综合征的表现。如先天性动静脉畸形、血管发育异常、血管瘤、动脉瘤和Dieulafoy病等。Dieulafoy病又称Dieulafoy溃疡、黏膜下动脉畸形(submucosalarterial malformation)、恒径动脉(caliber persistentartery)等,占消化道出血的0.3%~6.7%,可见本病并非罕见,多见于男性中老年人,可发生于消化道任何部位,但绝大多数位于贲门下6cm范围内的胃小弯侧后壁,属先天性病变,病灶多为1~3mm,呈局灶性黏膜缺损或糜烂或呈孤立圆锥状突起,其中央可见搏动性动脉突出黏膜外,病变周围黏膜多正常,无炎症改变。
要再进一步明确上消化道大出血的病因和部位,有时需要进行下列几种辅助检查。
1.纤维内镜检查
为迅速明确出血的部位和性质,首选急诊纤维胃镜检查,可在出血后24小时内进行,检查距出血时间愈近,诊断阳性率越高,一般诊断正确率可达95%。不但能发现表浅的胃黏膜病变,且能在食管或胃底静脉曲张和溃疡两种病变同时存在时,用以确定何者为引起出血的原因。胃镜诊断的同时可进行内镜治疗(双极电凝、电灼、热探头、激光、药物局部注射等)。纤维内镜检查安全、方法简单,并发症少于1%,死亡率0.1%。目前,钡餐透视检查已逐渐被内镜取代。对有失血性休克的病人,应在补充血容量,生命体征平稳后,行急诊胃镜检查。但对动脉性出血,药物治疗不能止血,休克状态无法纠正时,亦有在快速输血、吸氧和生命体征监护下行急诊胃镜检查,但要考虑到大量出血观察病变困难,检查者要具备熟练的内镜止血技术。对于呕吐鲜血较多者,既往检查前用4~8mg去甲肾上腺素加入冷盐水500ml洗胃,目前认为温盐水更有利于激活凝血因子。内镜检查的禁忌证为病人不能合作或怀疑脏器穿孔,严重心肺功能不全及意识变化等。
2.选择性内脏动脉造影
经股动脉插管行选择性腹腔动脉、肠系膜上动脉以及超选择性动脉造影,可显示活动性出血部位,出血的表现为造影剂外溢,但每分钟至少要有0.5ml含有显影剂的血量自血管裂口溢出,才能显示出血部位。在明确了出血部位后,还可将导管推进至出血部位,进行栓塞以止血。
部分病人血管造影虽未能显示出血,如有血管性病变或实质性病变,血管造影剂亦可予以显示,具有定位和诊断的价值。
3.鼻胃管或三腔管检查
鼻胃管吸引常可有助于诊断上消化道出血的部位、判定出血的速度。如果鼻胃管放至食管与胃交界处(约距门齿40cm),经该管注入少量等渗盐水,轻轻抽吸,如有血液说明出血来自食管或胃;如胃管抽出清亮胃液,表明出血部位在胃以下的消化道;如抽出清亮的胆汁,可以排除出血在十二指肠的近端。鼻胃管吸引简单、安全,但并非完全可靠,约10%的上消化道出血病人,鼻胃管抽吸呈阴性。
对怀疑为食管或胃底曲张静脉破裂出血者,可应用三腔管检查。三腔管放入胃内后,胃囊充气,拉出三腔管至有阻力时,表明胃气囊已压住胃底贲门部,再将食管气囊充气,用生理盐水经第三腔将胃内积血冲洗干净,如不再出血,则表示食管或胃底曲张静脉破裂出血;如洗净胃内容物后仍有鲜血抽出,表示胃或十二指肠出血。需要指出,肝硬化伴发胃或十二指肠溃疡出血较一般人为多,占10%~15%,因此,肝硬化病人即使已有食管或胃底静脉曲张,也不能排除溃疡出血的可能,对这种病人,用三腔管检查来明确出血部位更有实际意义。这种检查方法虽较简单易行,但需要取得病人的充分配合。
4.X线钡餐检查
急诊行上消化道钡餐检查有助于发现食管静脉曲张或胃、十二指肠病变,但误诊率较高。钡餐发现的病变也许仅属有潜在出血的可能性,对表浅黏膜病变和血管畸形则无诊断价值。胃底静脉曲张有时需要多次改变体位才能发现。在出血情况下,胃溃疡龛影不宜采用手法按压显示。应采用高浓度、低黏度小量钡糊和气钡双重对比造影法较为安全。有时钡剂因溃疡浅表或过小,或溃疡基底部被血块或坏死组织填盖而无法显示龛影。其他如胃窦或幽门部溃疡,因括约肌收缩或球后溃疡,也容易漏诊。因此,X线钡餐检查多用于出血停止,病情稳定后的病因诊断。
5.放射性核素检查
应用核素99mTc(锝)标记红细胞的腹部扫描方法,可观察到有放射性核素标记的血液溢出至血管外而显示该部位的放射性浓集区,出血速度仅0.1ml/min(5ml出血量)即能检出,对确定胃肠道出血相当敏感。但主要只能显示出血在腹部某个区域,而不能判定确切的出血部位,也不能明确病变的性质。对内镜检查不能确定出血部位,仍有活动性出血者,可采用此项检查。注射一次99mTc标记的红细胞,可以监视病人消化道出血达24小时。
应注意,核素扫描和血管造影仅能帮助确定出血部位,而不能诊断病因。即使是阴性结果也不能忽略,需进一步选择其他辅助检查,如重复内镜检查及胃肠钡餐造影等。
通过上述的临床分析和体格检查,或结合辅助检查,基本上可明确上消化道大出血的病因和部位,从而针对不同情况有目的地采取有效的止血措施。
确定为上消化道大出血的病人,都应视为紧急情况收住院或重症监护病房,积极进行如下处理。
1.初步处理
对于严重上消化道出血的病人,应迅速采取复苏措施。立即建立一条够大的静脉通道,有条件者,必要时可行锁骨下静脉穿刺插管,保证快速输液。先滴注平衡盐溶液或乳酸钠等渗盐水,同时即进行血型鉴定、交叉配血和血常规、血细胞比容检查。要每15~30分钟测定血压、脉搏,并记录尿量,观察周围循环情况,作为补液、输血的指标。一般失血量不超过400ml,循环血容量的轻度减少可很快地被组织液和脾脏贮血所补充,血压、脉搏的变化不明显。如果收缩压降至70~90mmHg,脉搏增速至每分钟130次,这表示失血量约达全身总血量的25%,病人黏膜苍白,皮肤湿凉,表浅静脉塌陷。此时即应大量补液、输血,将血压维持在100mmHg,脉搏在每分钟100次以下。需要指出,平衡盐溶液的输入量宜为失血量的2~3倍。只要保持血细胞比容不低于0.30,大量输入平衡盐溶液以补充功能性细胞外液的丧失和电解质,有利于抗休克治疗。
对于有严重循环功能紊乱者,应立即行中心静脉插管测压,以指导输液速度和输液量。既往无明显心脏病者,中心静脉压的变化能相当准确地反映血容量的大小。有条件者可用压力换能器连续监测。怀疑有心肺功能损害者应置Swan-Ganz导管以监测肺动脉楔压及心输出量。连续心电图监测可明确有无冠状动脉供血不足和严重水电解质平衡紊乱。留置导尿管监测尿量既可作为补充血容量的指标,又能早期发现肾功能的损害。动脉血气分析可以综合评价病人体内酸碱代谢平衡、呼吸功能、组织氧合情况等,有重要的指导价值。
2.药物止血
根据出血的病因不同,选择相应的药物止血。
(1)制酸剂:胃内酸性环境不利于纤维蛋白凝聚的形成并加速凝块的溶解。当pH≥6.0时胃黏膜出血时间显著降低,接近中性时,可促进血小板聚集和纤维蛋白凝块的形成,避免凝块过早溶解,有利于止血和预防再出血。由消化性溃疡、胃空肠吻合口溃疡、胃泌素瘤及急性胃黏膜病变等引起的出血,可应用制酸剂控制胃内酸度以减少氢离子逆向弥散,降低胃蛋白酶活力,防止胃黏膜损害及促进凝血。H2 受体拮抗剂西咪替丁(cimetidine)或雷尼替丁类药具有强力抑制胃酸分泌作用,但停药后胃酸分泌可反跳。一般方法为静脉滴注西咪替丁400mg,每6~8小时1次,直到胃液pH达到7.0为止。然后根据pH变化调节剂量,出血停止后改为常规剂量口服维持。
质子泵抑制剂具有强效、长时间抑酸作用,保证胃内酸度持续稳定下降维持pH>6,奥美拉唑(omeprazole,洛赛克)对H+-K+-ATP酶抑制作用具剂量依赖性,可高效快速的抑制胃酸分泌。首日剂量80mg,分2次服,以后每日40mg。或静脉滴注40mg,每12小时1次,连用3日。
可先插胃管抽尽胃内容物,并用石蕊试纸测定其pH,然后经胃管注入抗酸剂氢氧化铝或镁乳60ml,每15分钟1次,每次注药前抽取少许胃液并用石蕊试纸测定,直到胃液pH达7.0,再调节制酸剂用量,每隔1小时抽取胃液测pH,使其保持在7.0左右。
(2)血管加压素:此药能使内脏小动脉收缩,减少门静脉血流量达40%~50%,使门静脉压力下降,控制食管胃底曲张静脉及十二指肠出血。常用的方法为10U溶于5%葡萄糖溶液100ml内,在30分钟内静脉滴注完,必要时可4小时后重复注射1次,如出血停止或减少,可持续以0.1U/ml浓度,在20~30滴/min的速度滴注4~6小时,如仍出血,不宜继续使用。此药可引起的不良反应有:腹痛、血压升高、心律失常、心绞痛,严重者可发生心肌梗死,应注意,故对高血压和有冠状血管供血不足的病人不适用。
(3)生长抑素(somatostatin)及其衍生物:除抑制生长激素释放外,可明显减少内脏血流量,降低门静脉压力;可抑制胃肠道及胰腺的内外分泌,其中抑制胃泌素及胃酸分泌的作用可提高胃内的pH;并可增加食管下端括约肌压力,对食管下端静脉丛有收缩作用以减少血流量,又可减少胃酸反流入食管消化血凝块中纤维蛋白的机会,从而减少再出血的危险。但这类药物价格昂贵。目前用于临床的有14肽天然生长抑素,用法为首剂250μg静脉缓注,继以250μg/h持续静脉滴注。本品半衰期极短,仅2~3分钟,滴注过程中不能中断。奥曲肽(octreotide)是人工合成的8个氨基酸组成的环状多肽,半衰期较长,约2小时,常用剂量为首剂50μg,继之以25~50μg/h持续静脉滴注。上述两种药物临床疗效相似,治疗食管曲张静脉破裂止血率70.0%~94.4%,治疗消化性溃疡及急性胃黏膜病变出血,止血率达87%~100%。
(4)其他止血药:维生素K、卡巴克络、酚磺乙胺、血凝酶、氨甲环酸(血速宁)等,可能有一定的止血效果,可选择应用。
3.胃灌洗
有呕血者应安放胃管,连续用生理盐水灌洗。每次100~200ml,直到胃液清亮为止,胃灌洗本身虽无止血作用,但可清除胃内血块及残渣,使胃恢复张力,间接起到止血作用。还可将去甲肾上腺素8mg或凝血酶1 000U加入生理盐水100ml,分次从胃管灌洗。值得注意的是,过多的冷盐水灌洗有造成体温下降、上腹疼痛不适、甚至诱发心律不齐的危险,应予注意。
4.三腔管压迫止血
食管胃底曲张静脉破裂所致大出血病人,可在药物止血治疗的同时放置三腔气囊管压迫止血。
5.内镜下止血
目前已成为上消化道出血的常规止血方法。使用方法如下:
(1)药物喷洒止血法,喷洒去甲肾上腺素冰盐水,5%或10%的孟氏液、巴曲酶和凝血酶以及组织黏合剂等。主要用于较浅表的黏膜面糜烂或小的溃疡面出血。
(2)内镜下在出血局部注射止血药物,有1:10 000肾上腺素、1%乙氧硬化醇、无水酒精、高渗盐水等。
(3)热凝方式:用单或双极电凝、热探头、微波、激光氩等离子凝固(argon plasma coagulation,APC)止血等治疗。对于小的出血点、片状出血的病人在药物喷洒治疗的同时采用电凝或微波治疗,效果较好。
(4)内镜下用钛夹直接夹闭肉眼可见的出血性血管和病灶,用于胃黏膜血管畸形,胃黏膜恒径小动脉的出血以及息肉摘除后的血管性出血等。
(5)内镜下对食管曲张静脉破裂出血的治疗。
近来报道,多普勒超声内镜在上消化道出血时的应用,可正确判定溃疡底部的血管,指导内镜治疗,并可检验内镜治疗的效果。当发现有持续动脉血流时,提示有再出血的可能,需要再次治疗;对食管胃底静脉曲张的超声内镜诊断和治疗,提供重要的附加信息与其他黏膜下病变的鉴别、判定硬化剂治疗的疗效。
6.介入治疗
选择性血管造影诊断及治疗上消化道出血,适用于各种原因的胃肠道大出血,部位不明、原因不详经内科保守治疗无效者。采用Seldinger技术,先行靶动脉造影确定出血部位和靶血管后,将导管超选择送入靶血管,以0.2U/min的速度灌注血管加压素20~30ml。如止血无效,应改用血管栓塞或手术治疗。栓塞成功后,复查动脉造影,无造影剂外溢征象,经观察无再出血,即可拔管结束栓塞治疗。
7.对部位不明的上消化道大出血,经积极的初步处理后,出血仍不能得到有效控制,血压、脉搏仍不稳定,以及出血停止后近期又反复出血时,不宜延误时机,应及时行剖腹探查。急症手术的首要目的是紧急止血,若条件允许,可进一步对原发病进行彻底处理。
剖腹探查一般行上腹部正中或经右腹直肌切口。进入腹腔后,首先探查胃和十二指肠,如果初步探查没有发现溃疡或其他病变,第二步即检查有无肝硬化和脾肿大,同时要注意胆囊和胆总管的情况。胆道出血时,胆囊多肿大,且因含有血性胆汁呈暗蓝色;必要时可行诊断性胆囊或胆总管穿刺。如果肝、脾、胆囊、胆总管都正常,则进一步切开胃结肠韧带,探查胃和十二指肠球部的后壁。另外,切不可忽略贲门附近和胃底部的探查。同时,必须提起横结肠及其系膜,自空肠上段开始顺序探查空肠的上段。临床实践中,已有不少病例由于空肠上段的病变如良性肿瘤、血管瘤、结核性溃疡等而引起呕血的报道。如果仍未发现病变,而胃或十二指肠内有积血,即可在胃大弯与胃小弯之间血管较少的部位纵行切开胃窦前壁,进行探查。切开胃壁时,要结扎所有的黏膜下血管,以免因胃壁出血而影响胃内探查。胃壁切口不宜太小,需要时可长达10cm或更长些,以便在直视下检查胃内壁的所有部位。浅在而较小的出血性溃疡容易被忽视,多在胃底部,常在胃内壁上黏附着的血凝块下面,以及溃疡中含有一动脉瘤样变的小动脉残端(如Dieulafoy病)。如果仔细检查胃内壁后仍不能发现任何病变,最后要用手指通过幽门,必要时纵行切开幽门,来检查十二指肠球部后壁靠近胰头的部分是否有溃疡存在。经过上述一系列的顺序检查,多能明确出血的部位和病因。
手术探查和术中胃镜相结合对于寻找出血部位很有帮助,有主张探查找不到病灶时才置入胃镜检查。亦有认为手术开始即在胃壁切开一小口,清除积血后即置入胃镜检查,这不仅可避免因探查牵拉造成胃肠黏膜损伤出血而混淆真正的出血灶,而且使术中探查病灶的步骤简化。术中胃镜配合分段钳夹阻断胃肠腔,自上而下用生理盐水反复冲洗,更有助于发现出血灶。
此外,也有术中结合选择性血管造影以助于发现出血病灶的。













