中文别名 :胃印戒细胞癌
过去半个多世纪,许多国家的胃腺癌发病率和死亡率呈现下降态势,这种态势主要反映在Lauren肠型胃癌方面,但弥漫型胃癌特别是 印戒细胞胃癌的流行则呈上升趋势。2004年美国乔治华盛顿大学Henson等根据《 国家肿瘤研究院监测流行病学和终末结果》(SEER)的数据库资料,对1973年至2000年弥漫型胃癌的3种组织学亚型的发病率绘成曲线图(图19-10-1),该曲线显示,弥漫型进展期胃腺癌特别是 SRC胃癌的发病率上升势头非常明显。综合西方国家的报告,SRC胃癌占胃腺癌的比例从原来的28%上升至70%。虽然SRC胃癌发病率上升不能排除与过度使用这一诊断名词有关,但这种趋势的确存在,因此这类胃癌的诊治问题广泛受到关注。最近20年有关SRC胃癌是否应作为胃癌一种特殊类型看待,文献仍然存在争议。
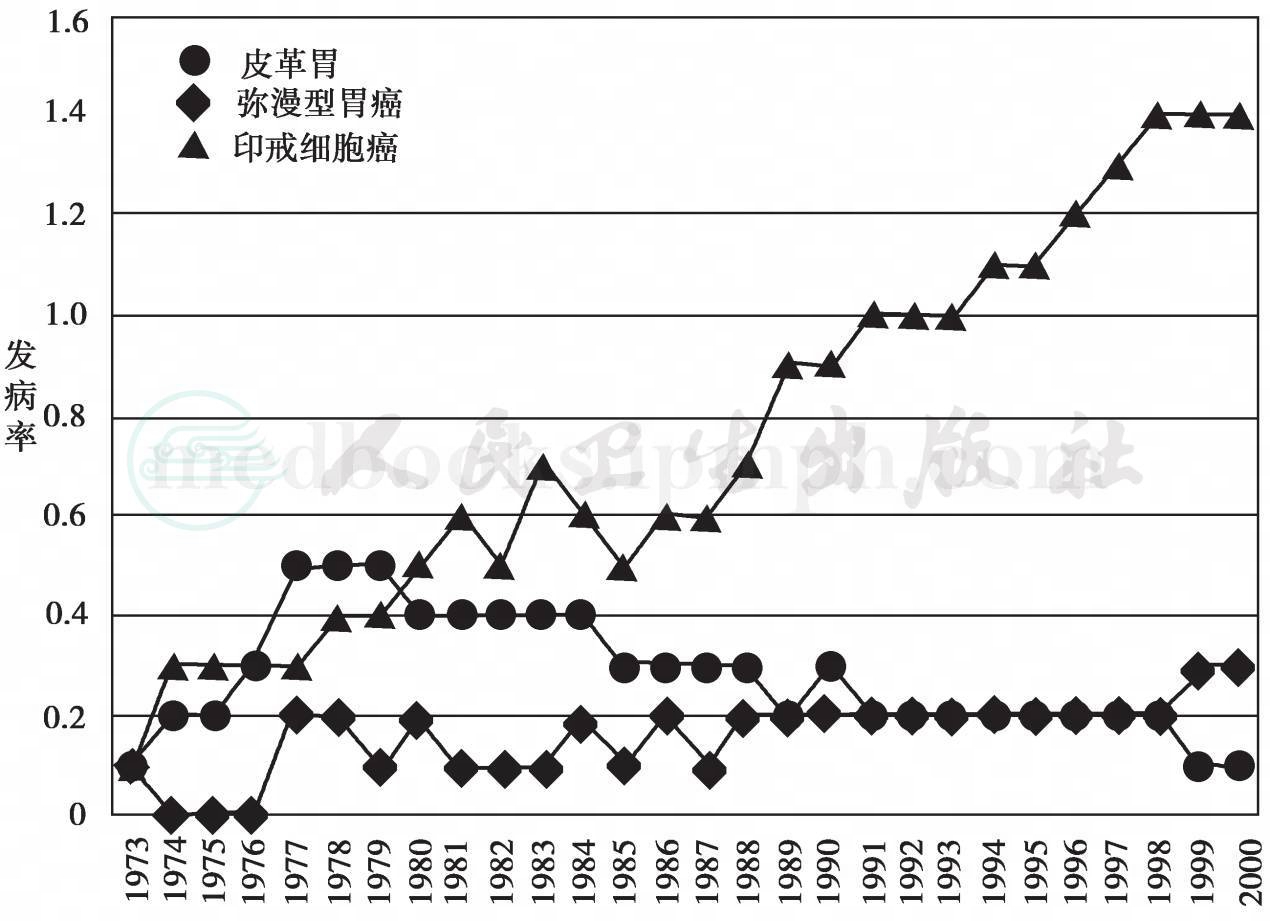
图19-10-1 美国1973—2000年SRC胃癌发病率的年代变迁,发病率单位为1/10万人,本图摘自Henson DE,等(Arch Pathol LabMed. 2004)原图修改成中文标记
(一)WHO的胃癌组织学分型
胃癌组织学有主流和非主流两类分型方法,主流分型法包括Lauren分型法和世界卫生组织(WHO)分型法,非主流分型法包括Ming、维也纳和日本等多种分型法。Lauren分型法简单实用,兼顾了组织形态学和生物学行为特点,为多数欧美国家所采用。WHO分型法是一种描述性分型,1979年由WHO提出,是以组织来源及其异型性为基础的国际分型法,该分类法将胃癌分为腺癌、腺鳞癌、鳞状细胞癌、未分化癌和类癌5个类型,再将腺癌分为乳头状腺癌、管状腺癌、黏液腺癌和印戒细胞癌4个亚型。胃黏液癌与胃印戒细胞癌组织病理学上都属于分化差的类型,肿瘤细胞的分化程度与肿瘤侵袭性相关,两者均有较强的侵袭性,并提示预后较差。我国多采用WHO分型法。第4版的WHO胃肠道肿瘤分类已于2010年底出版,该版组织学分型保留胃腺癌亚型中的乳头状腺癌、管状腺癌和黏液腺癌3种,用黏附性癌取代原印戒细胞癌,并增加一个混合性腺癌亚型。黏附性癌包括了印戒细胞癌及其变异型。混合型癌则具有清晰的不同形态学亚型的混合体,包括管状/乳头状腺癌与印戒细胞癌/差黏附性癌的混合体。印戒细胞是含有大量黏液的癌细胞,细胞内充满黏液,将细胞核挤向细胞一侧,形似戒指,故得其名。WHO的SRC胃癌定义为:占肿瘤的50%以上的主要成分由细胞浆内富含黏液的孤立或小群的恶性细胞组成的腺癌。WHO分型中的SRC胃癌是基于肿瘤细胞在显微镜下的组织形态学而不是生物学行为进行分型。
日本分型法把SRC胃癌归为未分化型,Lauren分型法归入弥漫型,Ming分型法归入浸润型。
(二)印戒细胞的起源
胃黏膜组织学的基本结构单位是胃单元,该结构为单克隆起源,由胃小凹和胃腺组成,其中胃腺又依次分为峡部、腺颈和基底部。胃腺的峡部以及腺颈上部的细胞增殖活跃,被称为增殖区。研究证实,胃印戒细胞癌起源于胃黏膜上皮,增殖区是胃印戒细胞癌起源的真正部位。进一步研究认为胃印戒细胞癌起源于胃腺增殖区MUC5AC-/lowMUC6-的胃小凹前体细胞,同时该区域细胞的异型增生可能是此类胃癌的癌前病变。然而,这一区域实际上含有多种低分化细胞,并具有不同分化方向,印戒细胞癌究竟起源于增殖区的何种细胞,目前尚不十分清楚。Humar等发现同一癌灶内的印戒细胞其CDH1基因甲基化的位点相同,说明病灶具有单克隆性,起源于同一始祖细胞,可能来自黏膜固有层中腺体颈部未分化干细胞,是一种低分化、具有特征性的黏液分泌性腺癌。因此也提示胃印戒细胞癌内很可能存在胃癌干细胞。
(三)印戒细胞癌比率
大多数西方国家的研究报告称,SRC胃癌占胃癌的6%~45.4%。SRC胃癌在总体胃癌人群中的比率各作者报告相距甚远,最低者不超过1%,最高者超过45%,究其原因有三,其一是SRC胃癌认定标准的差异;虽然目前有WHO标准可供诊断参考,但事实上也有不按WHO标准执行的情况发生;其二是胃癌的基数差异,文献计数方法各异,胃癌基准例数可来自下述多种方法获取:胃癌检出总例数、胃癌黏膜下剥离治疗早期胃癌例数、住院胃癌总例数、手术总例数、手术切除总例数等;其三是国际疾病编码误用,组织学类型按照国际肿瘤疾病编码表述,美国SEER对应于Lauren肉眼病理分型中的弥漫型胃癌有3种疾病编码,即印戒细胞癌为M8490,弥漫型胃癌为M8145,皮革胃为M8142。皮革胃是大体形态分型,指胃壁中的印戒细胞癌和弥漫型胃癌。弥漫型胃癌又可分为小细胞型和低分化型胃癌。这些分类的误用可导致SRC胃癌病例数统计上出现偏差。这就不难理解SRC胃癌比率相差悬殊的现象。
(一)早期SRC胃癌的治疗对策
1.限制性手术
如上所述,在早期胃癌,SRC胃癌预后优于非SRC胃癌,这就意味着限制性胃手术可能适合早期SRC胃癌患者,例如使用前哨淋巴结技术的部分胃切除加最小化的淋巴结廓清手术对于40mm或更小的黏膜癌和20mm或更小的黏膜下癌患者是可取的。就临床病理特点和手术结局而言,早期SRC胃癌是一种特殊疾病的实体,其较佳的手术结局提示,采用侵袭性较小的策略治疗如局部切除和前哨淋巴结取样有合理的基础。
韩国Lee等为了甄别早期SRC胃癌淋巴结转移的危险因素,分析早期胃癌胃切除1362例,淋巴结转移率在SRC胃癌和非SRC胃癌分别为10.7%和9.0%(P=0.307),Logistic回归分析显示肿瘤浸润深度是SRC胃癌患者淋巴结转移的预测因素(P<0.001),单因素和多因素分析均显示,肿瘤大小与淋巴结转移无关。SRC胃癌患者病灶小于2cm和淋巴结转移(6/48例,13%)者并非少见。建议早期SRC胃癌行胃切除加上淋巴结廓清。
2.内镜下黏膜切除术
虽然目前日本学者认为早期SRC胃癌不宜用EMR方法治疗,但如果该类早癌病灶直径较小、患者有全身性基础疾患、手术风险较高等条件下,可考虑EMR。
3.内镜黏膜下剥离术
韩国大邱庆北国立大学医院报告2001年至2009年接受根治性胃切除的186例早期印戒细胞癌,淋巴结转移8例(4.3%),91例(48.9%)肿瘤大于15mm,其中40例(21.5%)切除标本显示黏膜下侵犯。多因素分析显示,淋巴脉管浸润是唯一与淋巴结转移相关的因素。缺乏淋巴脉管浸润且肿瘤小于15mm患者未发现淋巴结转移。据此作者做出推断,ESD仅适合于黏膜层小于15mm的早期SRC胃癌。进展期SRC胃癌的处理:SRC胃癌在进展期胃癌的比率较低,与其他类型胃癌比较并无明显的生存优势,甚至预后更差。其侵犯深度、淋巴结转移和肿瘤直径等是影响预后的独立因素,有报告称进展期SRC胃癌以肉眼弥漫硬化性形态为主,较易出现腹膜转移,是预后不良的重要原因。SRC胃癌不是进展期胃癌接受根治性手术后的独立预后因素,即进展期SRC胃癌并不影响预后,当前推荐用进展期胃癌的标准方法处理进展期SRC胃癌。
4.胃切除加淋巴结廓清
韩国Lee等分析早期胃癌胃切除1362例,淋巴结转移率SRC和非SRC分别为10.7%和9.0%(P=0.307),Logistic回归分析显示肿瘤浸润深度是SRC胃癌患者淋巴结转移的预测因素(P<0.001),单因素和多因素分析均显示,肿瘤大小与淋巴结转移无关。SRC胃癌患者病灶小于2cm和淋巴结转移(6/48例,13%)者并非少见。建议早期SRC胃癌行胃切除加上淋巴结廓清。
(二)术前辅助化疗未能使印戒细胞癌患者获益
胃癌围手术期治疗策略的优点已在多项随机对照研究获得证明,MAGIC研究证明围手术期化疗能提高13%的5年生存率,该临床试验结果确认了围手术期化疗是可切除进展期胃癌的标准治疗,但该试验没有分层分析方案对SRC胃癌的疗效。少许有限例数的回顾性和前瞻性文献提示,SRCs可能具有内在的化疗耐药性。对于侵袭性强和现有化疗明显耐药的肿瘤,延期确切的切除手术而进行新辅助治疗,患者是否受益尚属疑问。
Messager等认为,相对于非SRC胃癌,SRC胃癌预后甚至更差,且对化疗的敏感性尚未有定论。他们回顾性评价围手术期化疗对胃印戒细胞癌患者生存率的影响。该研究收集法国19个中心1997年1月至2010年1月登记的胃癌共3010例,其中1050例(34.9%)诊断为SRC胃癌,1050例SRC胃癌中,接受根治性意向治疗924例,其中171例(18.5%)手术患者接受围手术期化疗,753例(81.5%)初始治疗选择手术治疗。围手术期化疗使用氟尿嘧啶和顺铂为主的双药或三药方案。结果显示,两组年龄、性别、美国麻醉学会评分、营养不良、肿瘤部位和临床TNM分期等均有可比性。60例患者由于术中发现肿瘤进展(10例)和转移(50例)未行切除手术。初始手术组和围手术期化疗组的R0切除率分别为65.9%和62.3%(P=0.308)。中位随访期为31.5个月,围手术期化疗组的中位生存期12.8个月,而初始手术组为14.0个月(P=0.043)。多因素分析显示,围手术期化疗是生存率不良预后的独立因素(HR=1.4,95%CI=1.1-1.9,P=0.042)。结论是胃印戒细胞癌患者未能从围手术期化疗中获益。这是一项最大型的组织学亚型研究,共有1050例SRC胃癌入组,结果发现该类患者并未获益于围手术期化疗,也未能获益于术前辅助化疗,肿瘤和淋巴结分期也没有降低,R0切除率也未提高,复发也没有减少。事实上作者发现某些证据说明新辅助化疗期间肿瘤进展多发生在这类患者,常需扩大切除,患者单独手术后中位生存期比联合围手术期化疗更长。这些结果已经在2006年写进了法国的胃癌指南之中。最后,围手术期化疗组中位首次复发出现时间明显短于对照组,可见化疗对SRC胃癌的细胞毒作用甚微。在新辅助化疗期间,部分疾病显然有所进展,使得围手术期化疗后的切除手术扩大化,如胃食管和邻近脏器扩大切除。这说明需要寻找合适的替代策略。SRC胃癌患者辅助化疗未能获益的理由是多方面的,全身化疗对于腹膜侵犯效果有限,而腹膜侵犯是SRC胃癌的一大特点。化疗的毒性导致相关的免疫缺陷,患者的体能行为状态下降,严重的药物毒性作用导致全身状态和明晰的生存获益必须取得平衡。如果没有生存获益,化疗的毒性对患者的全身状态有负面影响,且可导致肿瘤进展、早期复发和死亡。关于其他辅助治疗的效果,如美国的化放疗和亚洲S-1为主的化疗,由于没有对SRC胃癌进行分层分析,目前下结论为时尚早。特别有趣的是INT0116试验的10年随访结果显示,弥漫性胃癌作为亚组分析并未从辅助性化放疗结合中获益。
迄今,SRC胃癌的化学耐药机制尚不明确,但有研究提示,大量细胞浆内的黏液成分可能在药物和细胞相互之间的竞争中起重要的作用。有假设称,特殊的分泌模式和细胞膜的粘蛋白可能在药物和肿瘤细胞之间作用起重要作用。与此相似的情形,Ott等认为,SRC胃癌的高黏液含量可降低肿瘤内的氟脱氧葡萄糖浓度,导致PET信号的误读。因此,PET是评价这一组织类型的不良工具。因此,迫切需要探讨SRC胃癌的生物学特性解释所涉及的化学耐药性的机制,明确能被标靶的特殊信号通路。
越来越多的证据显示,印戒细胞癌具有内在的化疗耐药性,这留给临床医生许多悬念,如劝说患者延期手术去接受新辅助化疗是否有益?是否导致肿瘤进展?需要用随机对照试验来解答这些问题。目前有一项前瞻性多中心对照随机的Ⅱ、Ⅲ期试验正在法国进行之中,编号为PRODIGE19-FFCD1103-ADCI002,Piessen等比对评价当前围手术期化疗的标准方案(手术前、后各3疗程的表阿霉素、顺铂和氟尿嘧啶化疗)与初始手术治疗后6个疗程相同药物辅助化疗方案对ⅠB-Ⅲ期SRC胃癌患者的作用。Ⅱ期试验(84例)目的是确定试验组(初始手术后辅助化疗)在24个月存活后是否有足够的百分比患者有兴趣继续参加Ⅲ临床试验。如果试验组存活24个月的患者为7例,将不启动Ⅲ期试验。Ⅲ期试验(再增加230例患者)的主要终点是试验组在总生存率方面的优势,次要终点是评估36个月的总生存率、24和36个月的无病生存率、R0切除率;用Clavien-Dindo严重程度指数评价治疗的耐受性、术后的死亡率和并发症,并评估生活质量。一项附加研究还将评价手术和围手术期化疗对患者及其对照组在情感和认知方面的影响。这项Ⅱ/Ⅲ期试验首次专门针对印戒细胞癌作为分层研究对象,将为初始手术治疗胃SRC肿瘤的价值提供了高级别证据,其结果相当令人期待。本研究的结果将有助于催生肿瘤患者个体化的治疗方案。
1.Henson DE,Dittus C,Younes M,et al. Differential trends in the intestinal and diffuse types of gastric carcinoma in the United States,1973-2000:increase in the signet ring cell type. Arch Pathol Lab Med,2004,128(7):765-770
2.Novotny AR,Schuhmacher C,Busch R,et al. Predicting individual survival after gastric cancer resection:validation of a US-derived nomogram at a single high-volume center in Europe. Ann Surg,2006;243(1):74-81
3.Cunningham SC,Kamangar F,Kim MP,et al. Survival after gastric adenocarcinoma resection:eighteen-year experience at a single institution. J Gastrointest Surg,2005,9(5):718-725
4.于颖彦,朱正纲.2010版WHO 胃肿瘤临床病理学分类及分期解读.外科理论与实践,2011,16(5):508-512
5.Watanabe H,Jass JR,Sobin LH,Ota K. Histological Typing of Oesophageal and Gastric Tumours(WHO International Histological Classification of Tumours no.18)(2nd edn). Springer:Berlin,1990
6.Messager M,Lefevre J,Pichot-Delahaye V,et al. The Impact of Perioperative Chemotherapy on Survival in Patients With Gastric Signet Ring Cell Adenocarcinoma:A Multicenter Comparative Study. Ann Surg,2011,254(5):684-693
7.Maehara Y,Sakaguchi Y,Moriguchi S et al. Signet ring cell carcinoma of the stomach. Cancer,1992,69(7):1645-1650
8.Otsuji E,Yamaguchi Y,Sawai K,et al. Characterizationof signet ring cell carcinoma of the stomach. J. Surg. Oncol,1998,67(4):216-220
9.Hyung WJ,Noh SH,Lee JH,et al. Early gastric carcinoma with signet ring cell histology. Cancer,2002,94(1):78-83
10.Hass HG,Smith U,Jäger C,et al. Signet ring cell carcinoma of the stomach is significantly associated with poor prognosis and diffuse gastric cancer(Lauren’s):single-center experience of 160 cases. Onkologie,2011,34(12):682-686
11.Kim JP,Kin SC,Yang HK. Prognostic significance of signet ring cell carcinoma of the stomach. Surg Oncol,1994,3(4):221-227
12.Theuer CP,Mastanski F,BrewsterWR,et al. Signet ring cell histology is associated with unique clinical features but does not affect gastric cancer survival. Am Surg,1999,65(10):915-921
13.赵刚,詹文华,彭俊生,等. 进展期胃印戒细胞癌患者的临床病理特点与预后.中华普通外科杂志,2006,1(4):251-253
14.Piessen G,Messager M,Leteurtre E,et al. Signet ring cell histology is an independent predictor of poor prognosis in gastric adenocarcinoma regardless of tumoral clinical presentation. Ann Surg,2009,250(6):878-887
15.Zhang M,Zhu G,Zhang H,et al. Clinicopathologic features of gastric carcinoma with signet ring cell histology. J Gastrointest Surg,2010,14(4):601-606
16.Jiang CG,Wang ZN,Sun Z,et al. Clinicopathologic characteristics and prognosis of signet ring cell carcinoma of the stomach:results from a Chinese mono-institutional study. J Surg Oncol,2011,103(7):700-703
17.Taghavi S,Jayarajan SN,Davey A,et al. Prognostic significance of signet ring gastric cancer. J Clin Oncol,2012,30(28):3493-3498
18.石晓燕,王润洁,刘超英,等. 胃印戒细胞癌临床病理特征研究. 肿瘤防治研究,2012,39(7):826-828
19.Honoré C,Goéré D,Messager M,et al. Risk factors of peritoneal recurrence in eso-gastric signet ring cell adenocarcinoma:results of a multicentre retrospective study. Eur J Surg Oncol,2013,39(3):235-241
20.Huh CW,Jung da H,Kim JH,et al. Signet ring cell mixed histology may show more aggressive behavior than other histologies in early gastric cancer. J Surg Oncol,2013,107(2):124-129
21.Kwon KJ,Shim KN,Song EM,et al. Clinicopathological characteristics and prognosis of signet ring cell carcinoma of the stomach. Gastric Cancer,2013,Feb 7. [Epub ahead of print]
22.Bu Z,Zheng Z,Li Z,et al. Clinicopathological and prognostic differences between mucinous gastric carcinoma and signetring cell carcinoma. Chin J Cancer Res,2013,25(1):32-38
23.Jiang H,Zhang H,Tian L,et al. The difference in clinicpathological features between signet ring cell carcinoma and gastric mucinous adenocarcinoma. Tumour Biol,2013 May 1. Published online:01 May 2013
24.Lee JH,Choi IJ,Kook MC,et al. Risk factors for lymph node metastasis in patients with early gastric cancer and signet ring cell histology. Br J Surg,2010,97(5):732-736
25.Kim JY,Kim YY,Kim SJ,et al. Predictive factors for lymph node metastasis in signet ring cell gastric cancer and the feasibility of endoscopic submucosal dissection. J Gastric Cancer,2013,13(2):93-97
26.Macdonald JS,Benedetti J,Smalley S. Chemoradiation of resected gastric cancer:a 10-year follow-up of the phase Ⅲtrial INT0116(SWOG 9008). J Clin Oncol,2009,24(15S):4515,ASCO Annual Meeting Proceedings
27.Ott K,Herrmann K,Schuster T,et al. Molecular imaging of proliferation and glucose utilization:utility for monitoring response and prognosis after neoadjuvant therapy in locally advanced gastric cancer. Ann Surg Oncol,2011,18(12):3316-3323
28.Piessen G,Messager M,Le Malicot K,et al. Phase Ⅱ/Ⅲmulticentre randomised controlled trial evaluating a strategy of primary surgery and adjuvant chemotherapy versus perioperative chemotherapy for resectable gastric signet ring cell adenocarcinomas-PRODIGE19-FFCD1103-ADCI002. BMC Cancer,2013,13:281 http://www.biomedcentral.com/1471-2407/13/281













