中文别名 :间变性大细胞淋巴瘤”;anaplastic large cell lymphoma;ALCL
1982年,德国病理学家Stein和Lennert等发现了一种细胞表面标记Ki-1(后被命名为CD30,为一种肿瘤坏死因子家族成员)。1985年,Stein等首次提出了“间变性大细胞淋巴瘤”(anaplastic large cell lymphoma,ALCL)的概念,因瘤细胞强表达Ki-1/CD30抗原,也称“Ki-1阳性淋巴瘤”或者“Ki-1阳性大细胞淋巴瘤”。ALCL是一种较少见的侵袭性非霍奇金淋巴瘤,也是一种成熟T/NK细胞淋巴瘤。瘤细胞常较大,具多形性,胞质丰富,常有马蹄形的核,大多数瘤细胞CD30阳性(Ki-1,Ber-H2),且大多数病例表达细胞毒性颗粒相关蛋白。该组肿瘤的共同特征为细胞体积大,核大而不规则,细胞弥散或巢样沿淋巴窦或滤泡间浸润,也有沿血管周围生长。
在随后的数十年中,国内外学者对ALCL的临床病理、病因及发病机制进行了深入的研究,确认ALCL为一类独立的淋巴瘤。在2008年WHO淋巴瘤新分类中,将ALK阳性间变性大细胞淋巴瘤和ALK阴性间变性大细胞淋巴瘤均归属于成熟T/NK细胞淋巴瘤中。
根据美国流行病学调查,1992~2001年,ALCL占所有淋巴瘤比例为0.8%,占T/NK细胞淋巴瘤的比例为13.9%,每年发病率是0.25/10万人,在高加索人群及美国非洲裔人群中发病率稍高(分别是0.34/10万人和0.38/10万人)。根据WHO淋巴瘤分类,ALCL占成人淋巴瘤的比例为3%,占儿童淋巴瘤的比例为10%~30%。ALCL在儿童和成年人均可见,在老年人中呈明显“双峰”特征。儿童ALCL平均发病年龄在10.2~11岁,婴儿ALCL罕见。大约60%~70%的患者初诊时因外周或者腹部淋巴结肿大表现为Ⅲ/Ⅳ期,5%~40%的患者表现为纵隔淋巴结肿大。此外,40%~50%的ALK阳性及ALK阴性的ALCL患者表现为结外病变,常累及皮肤、骨及软组织。中枢神经系统及胃肠道很少受累。在儿童ALK阳性ALCL中,罕见的结外侵犯部位包括直肠、骶尾部肌肉软组织、硬腭、鼻软骨、腹部、支气管、腰大肌等。但病因尚未明确。
文献报道约12%~80%的ALCL患者中可检测到t(2;5),这种易位使第5号染色体上的NPM核磷酸蛋白基因和第2号染色体间变性淋巴瘤激酶(ALK)基因连接从而产生融合基因NPM-ALK。
NPM-ALK融合基因编码一个80kD的NPM-ALK杂合蛋白,包含NPM分子N端的117个氨基酸和ALK蛋白完整的胞质部分(1058~1620个氨基酸)。NPM-ALK阳性细胞表现出大量的NPM-ALK自身酪氨酸磷酸化反应,以及其他一些蛋白质的磷酸化反应。ALK分子的胞质部分在生理情况下通过配体结合形成同源二聚体而产生活性。具有N端寡聚作用的NPM与ALK的胞质酪氨酸激酶区融合,使激酶触发结构域激活,类似于通过一个自然配体使受体发生寡聚作用,使ALK的酪氨酸激酶组成性激活。有关机制的推测可能是致癌性酪氨酸激酶募集并依次激活,触发促有丝分裂级联反应,导致细胞的转化。在淋巴瘤细胞中普遍存在的NPM启动子能够使NPM-ALK融合基因处于高表达状态。
ALK主要表达于新生儿和成人的中枢神经系统中,而不表达于正常的淋巴细胞。近来的报道显示,ALK部分的寡聚化起了重要的作用,与激酶的转化能力有关。采用PCR或抗NPM-ALK融合蛋白抗体,在50%原发系统型ALCL(T细胞/裸细胞)患者中可检测到这种融合蛋白。但在一些形态学上没有明显间变性的T细胞淋巴瘤中也可检测到。这些病例可能代表单形性的ALCL病例,如小细胞型和组织细胞型ALCL。此外,尚有少数伴t(2;5)的B细胞性淋巴瘤的病例报道。
根据最近的资料,存在t(2;5)易位或表达ALK的病例似乎在临床上具有相对的同源性如多为年轻患者且预后较好。但ALK并不是诊断原发系统型ALCL的必备条件,因为约一半病例ALK阴性。现证实,在ALK阳性的病例中,ALK基因的2p23除了与5q35发生易位以外,还与其他相关染色体发生易位,如inv(2)、t(1;2)、t(2;3)等,但通过免疫组化染色仅可见在胞质内的定位。这些患者的临床病理特征及预后与伴t(2;5)的ALCL相同。
ALCL还存在其他染色体及融合基因异常,包括t(1;2)(q21;p23)产生TPM3-ALK融合基因,t(2;3)(p23;q21)产生TFG-ALK基因,inv(2)(p23;q35)产生ATIC-ALK基因,t(2;22)(p23;q11)产生CLTCL-ALK基因,以及t(X;2)(q11-12;p23)产生的MSN-ALK基因等,导致多种具有寡聚结构域的蛋白替代NPM而形成变异型ALK嵌合蛋白(非NPM-ALK),这类患者的临床特征与ALK-NPM阳性者相似。
MUC1(epithelial membrane antigen,EMA):MUC1黏液素也被称为上皮细胞膜抗原,是一个大分子量跨膜糖蛋白,ALCL中MUC1的表达率为60%。在ALCL中,MUC1表达与ALK具有相关性,即MUC1的高表达主要见于原发系统型ALK阳性ALCL,MUC1的预后价值与ALK有关。在原发系统型ALK阴性ALCL、原发皮肤型ALCL及经典霍奇金淋巴瘤中MUC1均为低表达或不表达,但是前者与后两者相比其预后较差。
研究表明,ALCL的瘤细胞来源于激活的滤泡外CD30阳性淋巴细胞,ALCL的特征为CD30阳性,细胞膜和(或)高尔基复合体染色呈强阳性。一组报道显示,CD30阳性见于96%的ALCL患者。但对于ALCL来说,CD30并不具有特异性,因其也表达于霍奇金淋巴瘤的R-S细胞、其他类型的弥漫性大细胞淋巴瘤以及良性反应性淋巴结病伴明显的免疫母细胞型。在所有报道的ALCL病例中,根据免疫表型其肿瘤细胞可来源于T细胞、裸细胞和B细胞。一组对70例ALCL患者的研究表明,T细胞占46%,其表型为CD3阳性和(或)CD45RO阳性而CD20阴性和(或)CD79a阴性;裸细胞型占36%,表型为所有系列标志均阴性并且无TCR和IgH基因重排;B细胞型占18%,表型为CD20阳性和(或)CD79a阳性而T细胞重排。
ALCL临床上可分为原发型和继发型。2008WHO分类中,原发型ALCL根据分子学和临床特征又可以分为原发系统型ALK阳性ALCL、原发系统型ALK阴性ALCL和原发皮肤型ALCL。
(一)原发系统型ALK阳性ALCL
原发系统型ALK阳性ALCL具有以下特征:①ALK阳性患者约占ALCL的50%~60%;②发病年龄较小,多小于30岁(尤其多见于10~30岁);③男性多于女性,男女发病比例为1.2∶1~2∶1;④诊断时多为疾病晚期(Ⅲ~Ⅳ期),常伴有B症状(75%),特别是高热;⑤浅表或者腹部淋巴结肿大常见(30%~54%),儿童患者约40%出现腹股沟淋巴结肿大,相比霍奇金淋巴瘤,ALCL较少出现纵隔受侵;约25%的患者有脾大;⑥结外侵犯多见(60%),约40%的患者有2个或2个以上结外病变。在一项大样本研究中发现结外累及部位的比例如下:皮肤占21%,骨占17%(孤立或多发),软组织占17%,肺占11%,肝脏占8%,而肠道和中枢神经系统罕见;⑦用HE染色分析时骨髓侵犯约11%,如用免疫组化检查则达到30%左右,因为骨髓病理中散在分布的ALCL细胞仅在特殊标记后才能测到;⑧免疫表型:CD30阳性,EMA大多数病例阳性,约2/3病例CD43阳性,CD2和CD4大多阳性,而CD8、CD3常为阴性;⑨化疗疗效好,生存率较高。
(二)原发系统型ALK阴性ALCL
原发系统型ALK阴性ALCL具有以下特征:①发病年龄相对较大,多见于45岁到60岁患者;②霍奇金淋巴瘤样ALCL多见,约85%的患者初诊时为ⅡA期;③大约60%的患者侵犯纵隔,很少出现皮肤和骨骼受侵;④男/女发病比例为0.9∶1;⑤结外病变的发生率较低;⑥常规放化疗疗效较差;⑦预后不良。
(三)原发皮肤型ALCL
原发皮肤型ALCL具有以下特征:①主要见于老年人,儿童和青春期罕见。发病中位年龄60岁,约占皮肤淋巴瘤的9%;②原发于皮肤,常为无症状的孤立性肿瘤,表面可形成溃疡。通常呈结节状或小肿块,有时呈一个或数个丘疹样或一个巨大的溃疡性肿瘤。仅小部分患者(大约10%)皮肤损害超出某一个解剖部位。部分病例皮肤损害可以部分甚至全部自行消退。本病可呈反复发作,皮肤损害范围越大,发展为皮肤外病变的危险性越高,约25%的患者最终发展为全身性疾病;③一般不表达ALK蛋白,与系统型ALCL相比预后较好;④少数患者可见皮肤外侵犯,常见于病灶局部引流区的淋巴结;⑤局限性病灶经手术切除(加或不加放疗)能获得较高的生存率;⑥但是播散性的皮肤病变侵犯皮肤以外组织的危险性较大,需要进行多药联合化疗(表43-1)。


表43-1原发皮肤型与原发系统型ALCL的鉴别
注:EMA,上皮膜抗原;HECA,高度内皮细胞抗原
(四)ALCL的多样性
临床上,ALCL可以是原发性的,也可以继发于进展性淋巴细胞增殖性疾病,如淋巴瘤样丘疹病、蕈样霉菌病或霍奇金淋巴瘤,甚至也继发于AIDS。若不是特别指出,新的WHO分类中指的ALCL即是指原发系统性ALCL。原发性ALCL又可进一步分为原发系统型ALCL和原发皮肤型ALCL。
1.组织学
ALCL细胞形态谱较广,但所有病例均可出现不等量的怪异核、马蹄铁或肾形核伴有核旁的嗜酸性区域的细胞,这些细胞被认为是标志性细胞(hallmark cell),因为这些细胞可出现在所有形态学类型中。尽管典型的标志性细胞体积大,但也可见到具有类似形态特征的较小的细胞,也有助于正确的诊断。由于切面的不同,一些细胞可能出现核内包涵体,但不是真正的包涵体,而是由于细胞核膜的凹陷形成的假包涵体。具有这些特征的细胞被称为“面包圈”样细胞(doughnut cell)。这些瘤细胞呈现实性、黏着成片生长,破坏淋巴结或其他的组织结构。当淋巴结的结构存在时,肿瘤细胞呈现典型的窦内或T区黏着式生长,类似于癌。部分病例瘤细胞表现为在血管周围生长的特点。ALCL肿瘤细胞可以小,也可以很大。现在认识到的有5种形态学类型。
(1)普通型(60%):肿瘤细胞胞质丰富,胞质可以是透亮的、嗜碱性或嗜酸性(图43-1)。细胞多核,排列为花环状,类似于R-S细胞。核染色质通常呈细小块状或弥散分布,有多个小的、嗜碱性核仁。由较大细胞组成的病例中,细胞核的核仁更明显,但嗜酸性的包涵体样核仁很少见。当淋巴结的结构仅部分破坏时,肿瘤细胞呈现典型的窦内生长,因此可类似于转移性肿瘤。
(2)淋巴组织细胞型(10%):特征是肿瘤细胞夹杂大量反应性的组织细胞。组织细胞可以掩盖通常比普通型小的肿瘤细胞。肿瘤细胞经常围绕血管周围,借助免疫组化CD30和(或)ALK可清楚地显示。偶尔,组织细胞可出现噬红细胞现象。
(3)小细胞型(5%~10%):主要由小至中等大小的肿瘤细胞组成,细胞核不规则。一些病例中,多数肿瘤细胞胞质浅染,中位核,呈“煎蛋细胞(fried egg cell)”。很少情况下,可见到印戒样细胞。通常可见到标志性细胞,且常聚集在血管周围。在常规检查中,ALCL这种形态学类型常被误诊为外周T细胞淋巴瘤-非特异型。当外周血受累时,血涂片上可见到似花朵样的异型细胞。
(4)霍奇金样型(3%):形态上类似于结节硬化型经典性霍奇金淋巴瘤的瘤细胞形态(图43-2)。

图43-1 普通型ALCL
肿瘤细胞密集排列,细胞成类梭形,胞质粉染,核大,椭圆形或圆形,核仁明显。核分裂可见。残存成熟小淋巴细胞罕见
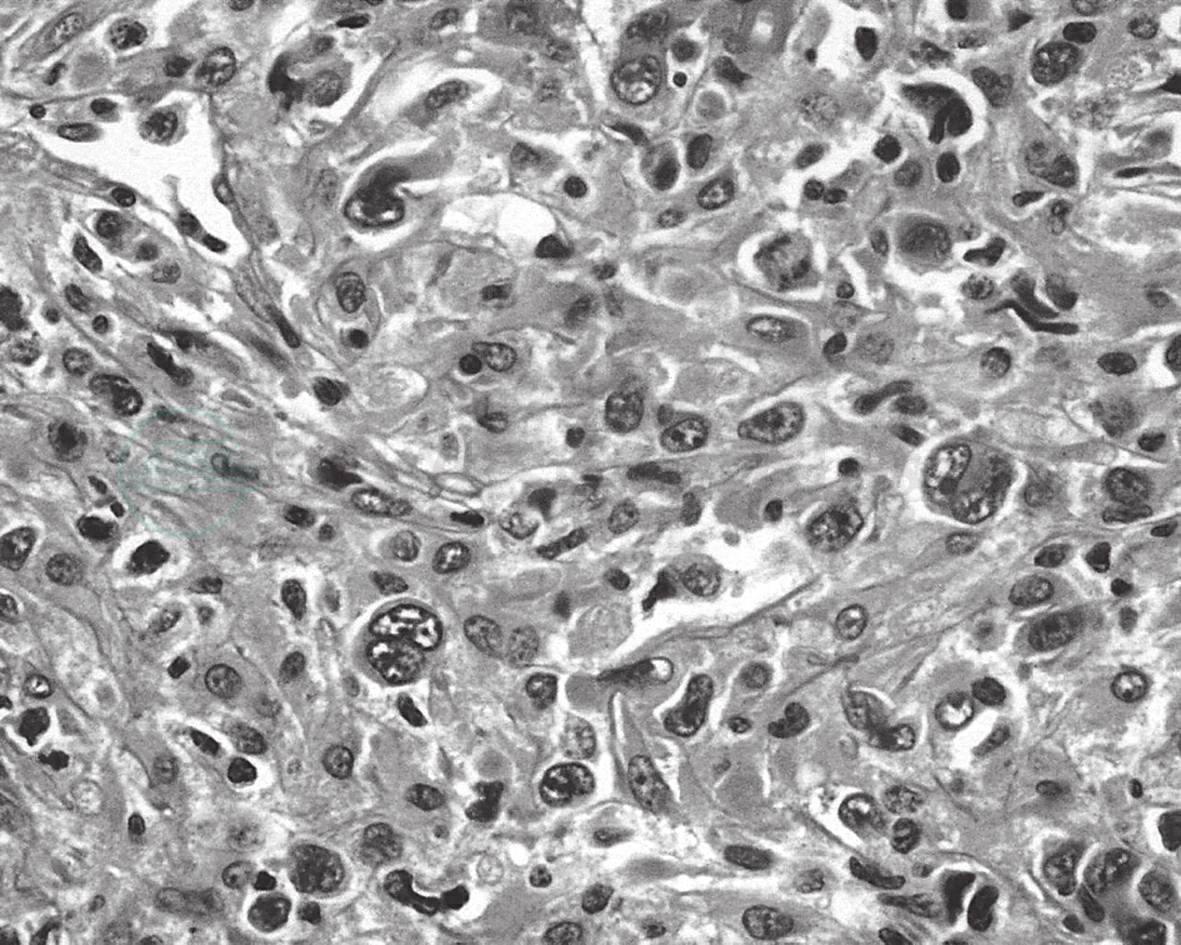
图43-2 霍奇金样ALCL
肿瘤细胞多形性,双核,核仁明显,红色,似R-S样细胞。有的细胞核排列成典型的马蹄铁样,核旁见粉染嗜酸性物,即Hallmark细胞
(5)混合型(15%):在同一个淋巴结活检中,可同时存在两种或两种以上的组织学类型。复发病例可出现与原发病变不同的组织学形态。其他的组织学形态包括单一性肿瘤细胞增生、核圆形,这些细胞也可能是肿瘤的主要组成部分或夹杂更加多形性的细胞,有的病例出现肿瘤性多核巨细胞或呈现肉瘤的特点。少数病例肿瘤细胞少,间质呈黏液样或水肿,梭形细胞明显增生,类似于软组织肉瘤。很少数的病例,恶性细胞非常少,散在分布于反应性的淋巴结中。可出现被膜的纤维化及淋巴结的纤维化,类似于转移性的非淋巴组织的恶性肿瘤。
与ALK阳性ALCL相比,ALK阴性ALCL的肿瘤细胞较大,而且更加多形,核浆比更高。
2.免疫表型
①肿瘤细胞CD30阳性(图43-3),阳性信号位于细胞膜和胞质高尔基区。大细胞的染色信号最强,小一些的肿瘤细胞CD30为弱阳性甚至阴性。对于淋巴组织细胞型和小细胞型的病例,最强的CD30阳性信号也见于大的肿瘤细胞;②大多数ALCL病例表达一种或更多的T细胞抗原。然而,由于丢失几种全T抗原,一些病例可能呈裸细胞表型,但在基因水平上已证明其为T细胞来源。因为在T细胞和裸细胞表型病例中未见明显的区别,因此T/裸的ALCL被认为是同一种疾病。75%以上的病例中CD3最常用的全T细胞标记物阴性。CD2、CD5和CD4在相当部分的病例中(70%)为阳性,因而对于诊断更为有用;③尽管在少数ALCL的病例中,仅部分肿瘤细胞表达EMA,但大部分病例EMA为阳性(图43-4);④大多数病例表达细胞毒性相关抗原TIA-l、颗粒酶B和(或)穿孔素。CD8通常阴性,但可罕见有CD8阳性病例存在。CD43在2/3的病例中阳性表达,但这种抗原缺乏细胞来源的特异性;⑤肿瘤细胞CD45和CD45RO的表达情况不定,而CD25常为强阳性。CDl5表达少见,即使表达也仅见于少数肿瘤细胞。BCL-2阴性。EBV(如RBER和LMP-1)阴性;⑥其他一些抗原,如凝集素、SHP1磷酸酶、BCL6、C/EBP、serpin A1(丝氨酸蛋白酶抑制剂A1)和fascin也可在ALK阳性ALCL肿瘤细胞中表达。

图43-3 间变性大细胞淋巴瘤
肿瘤细胞围绕血管排列。单克隆抗体CD30免疫组化标记瘤细胞胞膜和胞质阳性
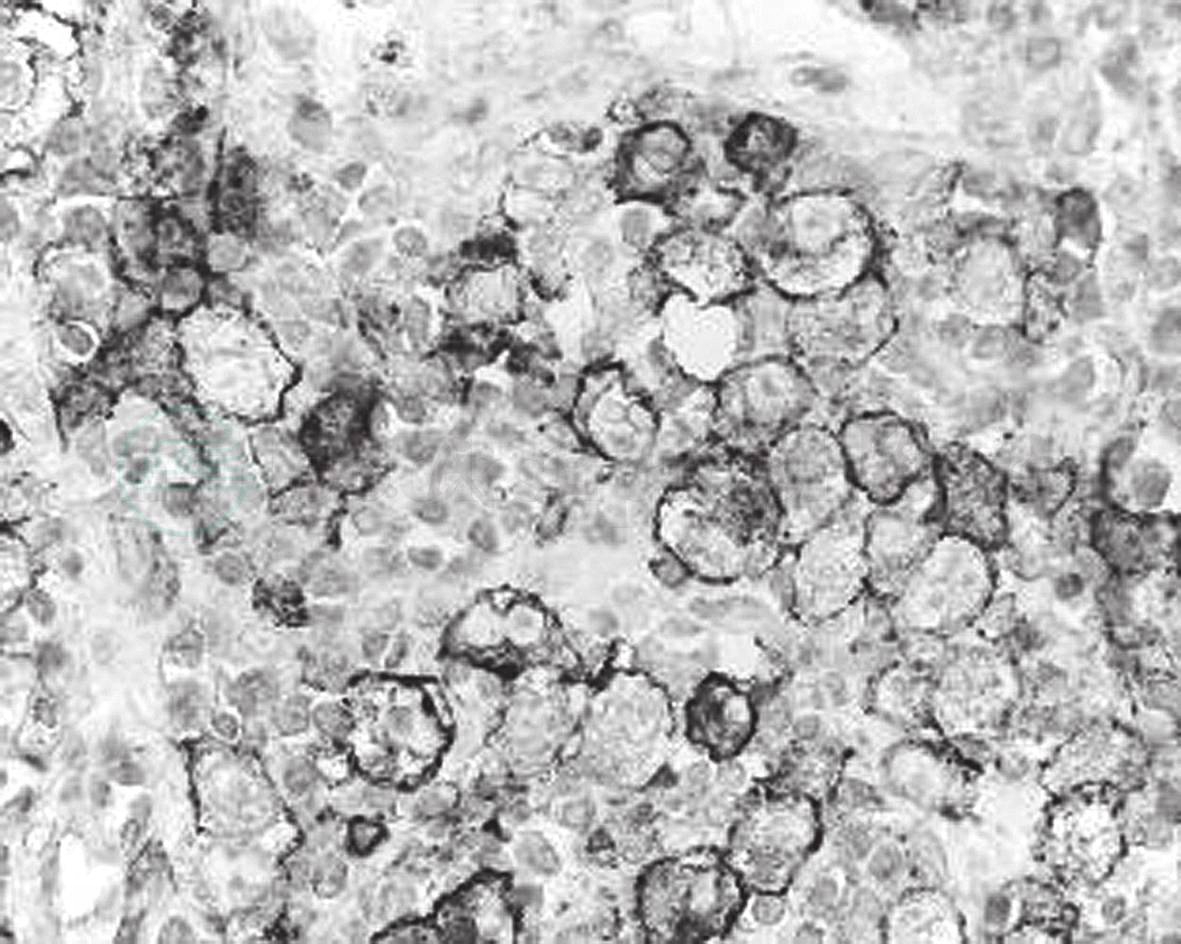
图43-4 间变性大细胞淋巴瘤
与小淋巴细胞掺杂分布的肿瘤细胞单克隆抗体EMA免疫组化标记瘤细胞胞膜和胞质阳性
ALK表达对于确诊ALK阳性ALCL还是ALK阴性具有特异性,因为ALK仅表达于少数脑细胞中,而出生后的人体其他正常组织均不表达。部分病例有t(2;5)/NPM-ALK染色体易位。大细胞的ALK染色示胞质和胞核均可阳性(图43-5),而在小细胞型ALK阳性信号通常局限于肿瘤细胞的胞核。在存在其他染色体易位的病例中,ALK染色可能是胞膜或胞质阳性,如t(1;2),t(2;3)。ALCL形态学及其相关免疫表型见表43-2。
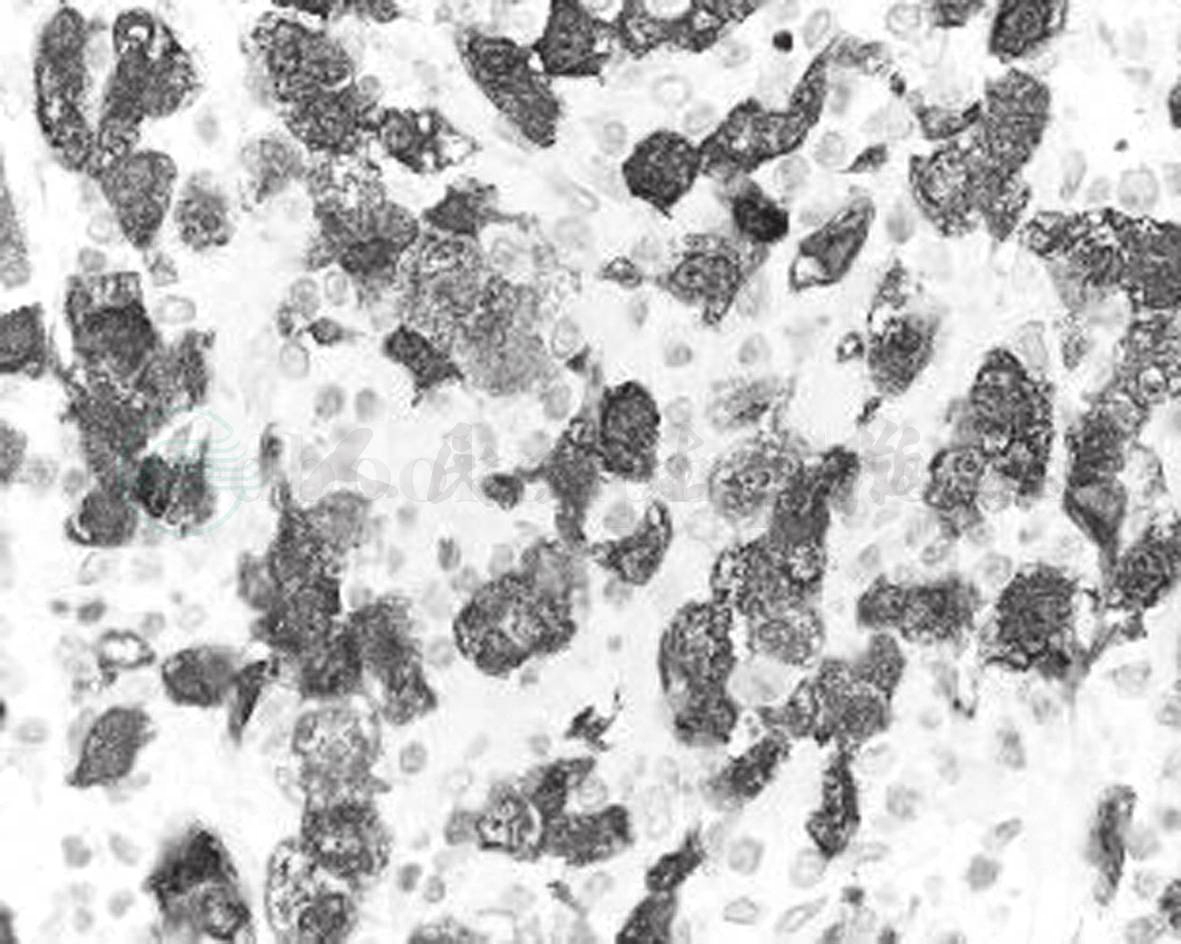
图43-5 间变性大细胞淋巴瘤
肿瘤细胞单克隆抗体ALK免疫组化标记瘤细胞胞质和细胞核阳性
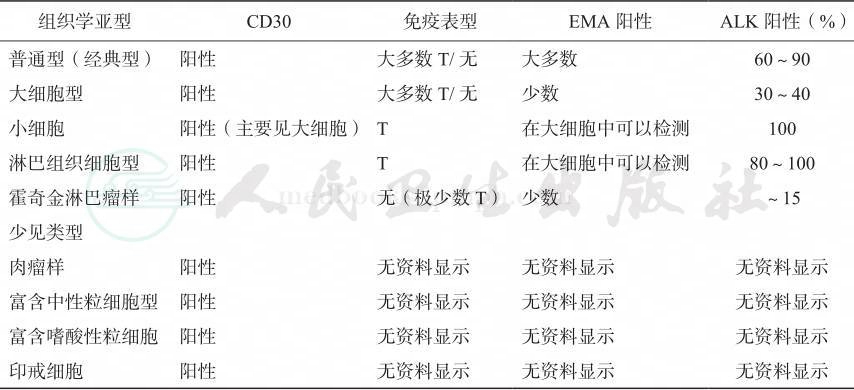
表43-2 ALCL形态学分类及其相关的免疫表型
3.分子生物学及细胞遗传学
约90%的ALCL病例存在T细胞受体(TCR)基因的克隆性重排,与T细胞抗原的表达与否无关,而其余病例既无TCR基因重排又无Ig基因重排。
位于不同染色体上的伙伴基因与ALK基因发生易位后形成不同的融合蛋白X-ALK(表43-3)。最常见的染色体易位是t(2;5)(p23;q35),由于位于2号染色体上的ALK基因和5号染色体上的NPM基因发生易位,形成融合蛋白NPM-ALK。应用特异性的ALK和NPM基因设计的引物,利用RT-PCR可检测到t(2;5)易位,而不能检测到其他类型的染色体易位。所有不同类型的染色体易位均可上调ALK蛋白表达,但不同染色体易位引起的ALK表达的部位不同。
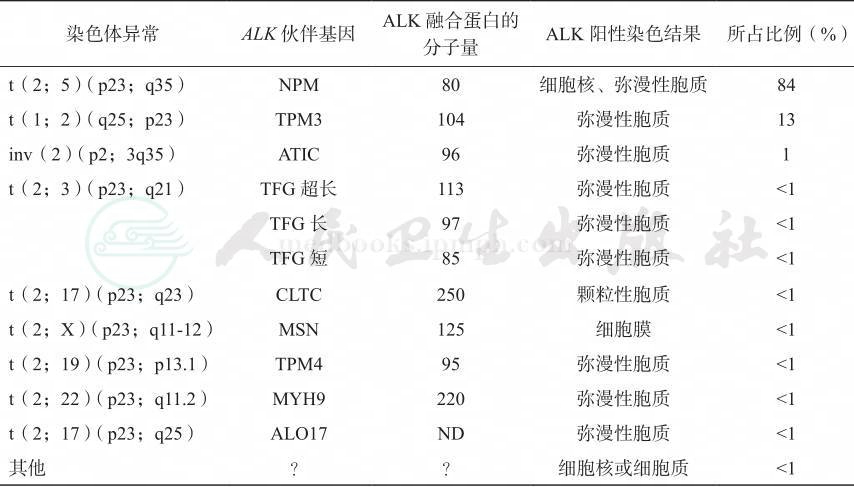
表43-3 涉及2p23染色体上的ALK基因的染色体易位和融合蛋白
比较基因组研究显示,ALCL常常继发染色体的不平衡,包括4号染色体、11q和13q的丢失,以及7号染色体、17p和17q的扩增。ALCL基因表达谱的研究结果显示,117个高表达的基因中,BCL-6、PTPN12、SerpinA1和C/EBP排在前四位。蛋白水平也同样显示C/EBP、BCL-6和SerpinA1高表达。
(一)成人ALCL的初始治疗
原发系统型ALCL被认为是一种恶性程度较高的侵袭性淋巴瘤,因为ALCL发病率低,有关其治疗及预后的报道比较少,缺乏大宗随机对照研究结果。目前尚缺乏ALCL的标准治疗模式。根据回顾性研究资料显示,目前对ALCL的治疗主要采取常规化疗、联合化疗加放疗、大剂量化疗联合骨髓移植等方法。ALK阳性间变性大细胞淋巴瘤对化疗敏感,5年OS可以达到71%~93%。而ALK阴性间变性大细胞淋巴瘤对化疗不敏感,5年OS约为15%~40%。根据2010年NCCN指南,对ALCL的治疗方案选择主要根据其分期和IPI预后指数。对于低危ALK阳性患者(IPI为0~1分)采用常规化疗,而不支持将大剂量化疗后行自体造血干细胞移植作为一线治疗。对于高危ALK阳性患者(IPI≥2)或ALK阴性患者,一些报道认为大剂量化疗后造血干细胞移植支持疗效较好,但仍需进一步与常规联合化疗行对照研究。
(二)儿童ALCL的治疗
多数研究中,成年人采用以蒽环类为主的联合化疗方案,如CHOP方案和MACOP方案等。但在儿童患者,多采用治疗淋巴细胞白血病的方案如LNH-92方案或Burkitt淋巴瘤的方案如B-NHL-BFM-90方案等。目前一般采用联合治疗,已有多项报道认为儿童及成人患者多药联合化疗效果较好。在儿童患者因其病程类似Burkitt淋巴瘤,故倾向于用治疗淋巴细胞白血病的强烈联合化疗,并预防中枢神经系统侵犯。
Deley等在2010年9月更新了ALCL99-长春花碱临床试验结果,在以B-NHL-BFM-90方案为基础的化疗方案中,采用增加长春花碱这一化疗策略来评估儿童高危ALCL患者的疗效。儿童及青少年高危患者入选标准为具有纵隔、肺、肝脏、脾或皮肤受侵。在接受一线治疗后,患者随机分为试验组及对照组。试验组入组患者110例,患者在化疗同时接受每周1次长春花碱(6mg/m2)治疗共1年,对照组入组患者107例,不接受长春花碱治疗。试验组中位生存时间4.8年,第一年复发风险降低(HR=0.31;95%CI,0.15~0.67,P=0.002)。试验组1年EFS为91%,对照组为74%,但2年EFS无差别(73%对70%)。作者认为,在诱导治疗阶段增加长春花碱维持治疗一年的策略可以显著延缓复发,但不能减低失败风险。
Reiter等研究了62位CD30阳性ALCL患儿,进行了短期(2~5个月)强化治疗。其中58位患儿(93%)达到了完全缓解,80%的患儿持续缓解。估计9年的无病生存率和总生存率分别为81%和83%。其中4位患儿在诱导失败后死亡,3位复发患儿接受了补救治疗,另1例复发患儿有弥漫性皮肤受累,未进行治疗,但36个月后病情无很大进展。总之,绝大部分复发患儿的生存期为22个月至36个月,复发的间隔期为6.5个月。
(三)复发或难治性患者的治疗
对于儿童及青少年复发及难治性ALCL,Woessmann等报道了最新的研究结果,通过对74例复发患者进行Cohort分析,发现在接受B-NHL-BFM方案一线治疗后复发的患者,挽救治疗策略主要是再诱导化疗后自体造血干细胞移植。中位生存时间达到8.4年,第一次复发后5年OS达到57%±6%。5年EFS及OS分别是59%±8%与77%±7%。他们推荐,对于CD3阴性的ALCL患者,在一线治疗缓解后第一次复发时,采用再诱导化疗随后ASCT是可行及有效的办法,一线治疗失败及CD3阳性的ALCL患者也可以从ASCT中获益。
(四)新的治疗药物及治疗策略
1.ALK抑制剂
Crizotinib是一种新的ALK抑制剂,新英格兰医学杂志于2011年2月报道两例复发的ALK阳性的ALCL患者,口服Crizotinib,250mg,1天两次,1个月后复查PET-CT,均达到CR。提示对于复发进展期的ALK阳性的ALCL患者,ALK抑制剂具有明显的治疗前景。Deng等基础实验发现3,5-二氨基1,2,4-三唑-苯甲基尿素是一种潜在的新的ALK抑制剂,可以抑制NPM-ALK阳性ALCL细胞系SU-DHL-1的增殖活性,具有潜在的临床应用价值。
2.CD30单抗
为增强靶向CD30治疗的抗肿瘤活性,将微管蛋白抑制剂(monomethyl auristatin E,MMAE)通过酶可裂解的连接部分附着至CD30特异性单克隆抗体,产生抗体-药物结合物brentuximab vedotin(SGN-35)。SGN-35是一种CD30靶向抗体,通过一个酶可裂解二肽连接物连接至MMAE。与CD30结合后,ADC被迅速内化和交流至溶酶体,在那里肽连接物被选择性裂解,释放MMAE进入细胞,与微管结合,促使G2/M细胞周期停止和诱导细胞凋亡。在Ⅰ期开放的多中心剂量递增研究中SGN-35(剂量0.1~3.6mg/kg)每周1次,治疗45例复发或难治CD30阴性患者,主要是霍奇金淋巴瘤和间变性大细胞淋巴瘤。最大耐受剂量为1.8mg/kg,每3周给药1次,在17例患者中观察到客观反应,包括11例完全缓解。其中12例患者接受1.8mg/kg剂量,6例(50%)客观有效。中位反应时间至少9.7个月。可评价的42例患者中36例观察到肿瘤缩小(86%)。最常见的不良反应是疲乏、发热、腹泻、恶心、中性粒细胞减少和周围神经病变。
3.白介素融合2毒素
为包含白喉毒素活性域和IL-2蛋白的融合蛋白,与表达IL-2受体细胞具有高亲和力。50%~60%的皮肤T细胞淋巴瘤(CTCL)表达IL-2受体。Ⅲ期临床试验中ONTAK与安慰剂对照治疗144例CTCL的总有效率分别为44%与13.6%,CR率分别为10%与2%,中位分别为PFS>2年与124天(P值均小于0.05)。主要不良反应为输液反应和毛细血管渗漏综合征,但与安慰剂组对比无显著增加。
4.NPM-ALK特异性核酶
体外试验证实其可阻止淋巴瘤细胞转录NPM-ALK融合蛋白,但是目前将核酶导入细胞还存在困难,且当核酶在NPM-ALK阳性细胞过度表达时仅有抗增殖效应。
5.抑制信号传导通路
RAS途径、PLC-γ、PI-3激酶、STAT蛋白及Notch1等可能在NPM-ALK介导的致瘤作用中发挥一定作用,已有研究发现阻遏PLC-γ能抑制NPM-ALK阳性细胞的增殖。仅仅抑制信号通路中的一种异常可能不足以清除ALCL的所有恶性克隆,因此抑制NPM-ALK信号级联反应的源头,即持续激活的酪氨酸本身,可能更为有效。目前正在寻找ALK的特异性抑制剂,希望能像STI571治疗BCRIABL阳性白血病一样取得良好疗效。
6.基因治疗
Wrobel等报道,在对1名11岁复发难治性ALCL儿童患者采用反义寡核苷酸下调BCL-2蛋白表达,并应用长春新碱及拓扑替康大剂量联合化疗后进行自体造血干细胞移植,可以逆转化疗耐药,该患者获得长期生存。
7.新的治疗方法
还包括应用抗CD30免疫毒素、放射性同位素及维A酸等。
[1]Swerdlow SH,Campo E,Harris NL,et al. WHO classification of tumours of haematopoietic and lymphoid tissues. 4th edition. Lyon,France:IARC Press,2008.317-319.
[2]时云飞,刘翠苓,周春菊,等. 原发系统型间变性大细胞淋巴瘤间变性淋巴瘤激酶基因异常与其融合蛋白表达及预后分析. 北京大学学报,医学版,2008,40(4):380.
[3]Damm-Welk C,Klapper W,Oschlies I,et al. Distribution of NPM1-ALK and X-ALK fusion transcripts in paediatric anaplastic large cell lymphoma:a molecular-histological correlation. British Journal of Haematology,2009,146(3):306.
[4]Ten Berge RL,Meijer CJ,Dukers DF,et al. Expression levels of apoptosis-related proteins predict clinical outcome in anaplastic large cell lymphoma. Blood,2002,99(12):4540.
[5]沈志祥,朱增雄. 恶性淋巴瘤. 北京:人民卫生出版社,2003:631-648.
[6]李晔雄. 间变性大细胞淋巴瘤. 中华放射肿瘤学杂志,2004,13(1):60.
[7]Savage KJ,Harris NL,Vose JM. ALK-anaplastic large-cell lymphoma is clinically and immunophenotypically different from both ALK+ALCL and peripheral T-cell lymphoma,not otherwise specified:report from the International Peripheral T-Cell Lymphoma Project. Blood,2008,111(12):5496.
[8]Medeiros LJ,Elenitoba-Johnson KS. Anaplastic Large Cell Lymphoma. Am J Clin Pathol,2007,127(5):707.
[9]ounes A,Bartlett NL,Leonard JP,et al. Brentuximab vedotin(SGN-35)for relapsed CD30-positive lymphomas. N Engl J Med,2010,363(19):1812.
[10]Stein H,Foss HD,Dürkop H,et al. CD30(+)anaplastic large cell lymphoma:a review of its histopathologic,genetic,and clinical features. Blood,2000,96(12):3681.
[11]Merkel O,Hamacher F,Sifft E,et al. European Research Initiative on Anaplastic Large Cell Lymphoma. Novel therapeutic options in anaplastic large cell lymphoma:molecular targets and immunological tools. Mol Cancer Ther,2011,10(7):1127.
[12]Woessmann W,Zimmermann M,Lenhard M,et al. Relapsed or refractory anaplastic large-cell lymphoma in children and adolescents after Berlin-Frankfurt-Muenster(BFM)-type first-line therapy:a BFMgroup study. J Clin Oncol,2011,29(22):3065.
[13]Deng X,Wang J,Zhang J,et al. Discovery of 3,5-Diamino-1,2,4-triazole Ureas as Potent Anaplastic Lymphoma Kinase Inhibitors. ACS Med Chem Lett,2011,2(5):379.
[14]Le Deley MC,Rosolen A,Williams DM,et al. Vinblastine in children and adolescents with highrisk anaplastic large-cell lymphoma:results of the randomized ALCL99-vinblastine trial. J Clin Oncol,2010,28(25):3987.
[15]Duvic M,Reddy SA,Pinter-Brown L,et al. A phase II study of SGN-30 in cutaneous anaplastic large cell lymphoma and related lymphoproliferative disorders. Clin Cancer Res,2009,15(19):6217.
[16]Shiota M,Nakamura S,Ichinohasama R,et al. Anaplastic large cell lymphomas expressing the novel chimeric protein p80NPM/ALK:a distinct clinicopathologic entity. Blood,1995,86:1954.
[17]Tilly H,Graulard P,Lepage E,et al. Primary anaplastic large cell lymphoma in adults:clinical presentation,immunophenotype and outcome. Blood,1997,90:3727.
[18]Gascoyne RD,Aoun P,Wu D,et al. Prognostic. Significance of Anaplastic Lymphoma Kinase(ALK)Protein Expression in Adults With Anaplastic Large Cell Lymphoma. Blood,1999,93(11):3913.













