英文名称 :neuroglioma
中文别名 :胶质细胞瘤;脑胶质瘤;胶质瘤
神经胶质瘤(neuroglioma)又称胶质细胞瘤(gliocytoma)或简称胶质瘤,是最常见的颅内肿瘤,占全部脑肿瘤的33.3%~58.6%(平均43.5%)。
胶质瘤(glioma)发生于神经外胚层,也称为神经外胚叶肿瘤(neuroectodermal tumors)或神经上皮瘤(neuroepithelial tumors)。神经外胚叶组织发生的肿瘤包括两类,分别是神经间质细胞形成的胶质瘤和神经元形成的神经细胞瘤。原发性脑肿瘤是人类十大常见的致命性肿瘤之一,儿童的脑肿瘤是仅次于白血病的第二大恶性肿瘤,也是儿童期最常见的实体瘤,15岁以下儿童脑肿瘤的年发病率为3.7~4.1/10万,约仅6%的患儿能活到成人期。欧洲报道胶质瘤占颅内原发性肿瘤的36%~50.1%,我国早年统计16所医院(1981)胶质瘤占颅内原发性肿瘤的44.6%。
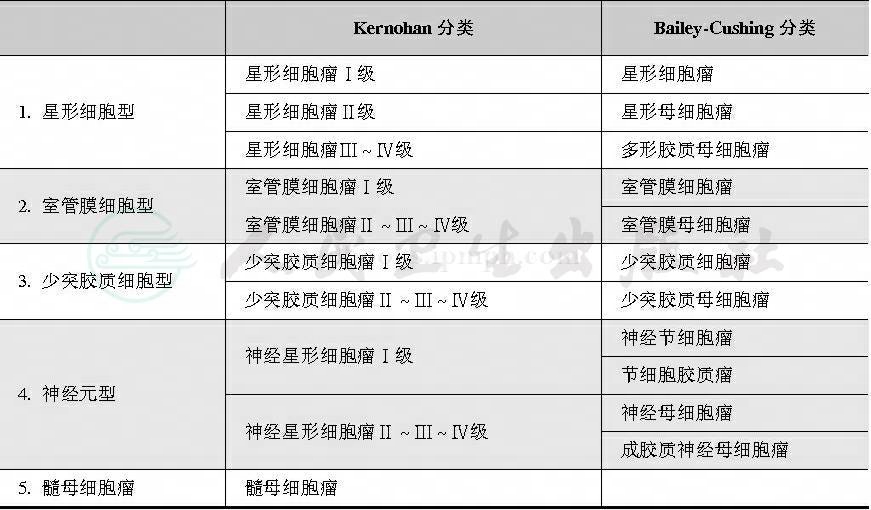
胶质瘤分类尚不统一,目前临床常用Bailey-Cushing分类法及Kernohan分类法。Bailey-Cush-ing分类法(1926)根据不同神经胚胎组织确定相应肿瘤类型名称,便于临床医师预测患者预后,但忽略肿瘤间变特性,不能动态反映胶质瘤发生与发展。Kernohan分类法(1949)把所有胶质瘤分成星形细胞瘤、室管膜细胞瘤、少突胶质细胞瘤、神经-星形细胞瘤及成神经管细胞瘤等五组,由这些成熟细胞形成肿瘤发生间变,成为恶性型,根据间变程度分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四级;该分类法较简便,多为临床采用,缺点是某些肿瘤迄今无法确定来源于何种细胞。此外,有些肿瘤实际上只有恶性型,这种分级无实际意义。两种分类法对照见表1。
表1 Kernohan分类与Bailey-Cushing分类对照
中枢神经系统肿瘤的传统分类法通过HE与免疫组化染色,在光镜下描述肿瘤组织病理学特征,是一种以静态的经验性肉眼判断高度复杂的动态的肿瘤生物学过程,虽然可以描述许多肿瘤细胞的表型特征,并已建立了CNS肿瘤分类,但准确预测肿瘤细胞侵袭性生长能力、复发程度以及对肿瘤特异性辅助治疗价值仍不尽如人意,正在发展的分子细胞遗传学技术将弥补其不足,如组织切片激光捕获显微分割技术可明确反映组织中某个细胞特异性基因扩增与表达,以及肿瘤细胞的增殖侵袭能力。在传统病理学基础上结合细胞分子遗传学检测、影像学、初次治疗反应及生存期等,期望建立符合疾病变化的动态分类法(图1)。
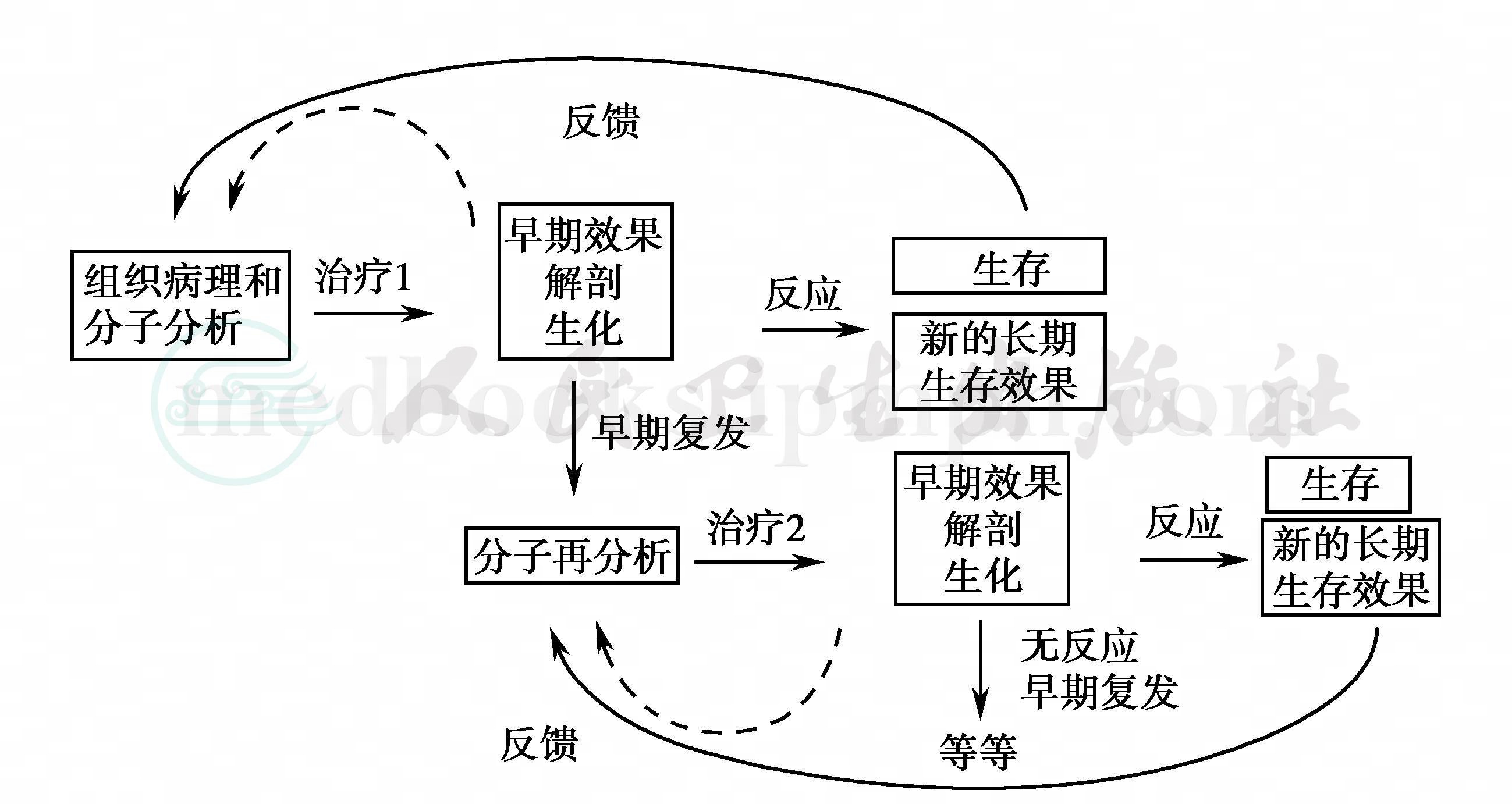
图1 改进临床评价示意图
1.CT
肿瘤部位可见密度异常的病灶,不同类型胶质瘤表现各自的信号特征,如囊性变为低密度,出血为高密度,钙化为为极高密度,坏死为混杂密度等;瘤体周围有不同宽度的低密度水肿带,占位严重程度通常与肿瘤实体大小一致,但水肿带可加重占位效应,可见脑室受压变形和移位,脑池变小或消失。如果病变在脑脊液循环通路或附近,因阻碍其循环出现病变部位以上的脑室扩大。
2.MRI
可提供更清晰的肿瘤图像,还可从冠状位、矢状位及轴位图像使肿瘤空间定位更加准确。弥散张量成像(diffusion tensor imaging,DTI)技术可显示锥体束与胶质瘤的解剖位置关系(图2),可作为手术切除肿瘤时有效保护肢体功能的依据;结合电生理检测也可保护语言功能不受损伤;术中MRI结合神经导航可达到肿瘤全切;结合MR波谱有助于对恶性肿瘤定性。对钙化灶和与颅骨关系显示不清是其不足,危重患者或植入金属物者不宜做MRI检查。
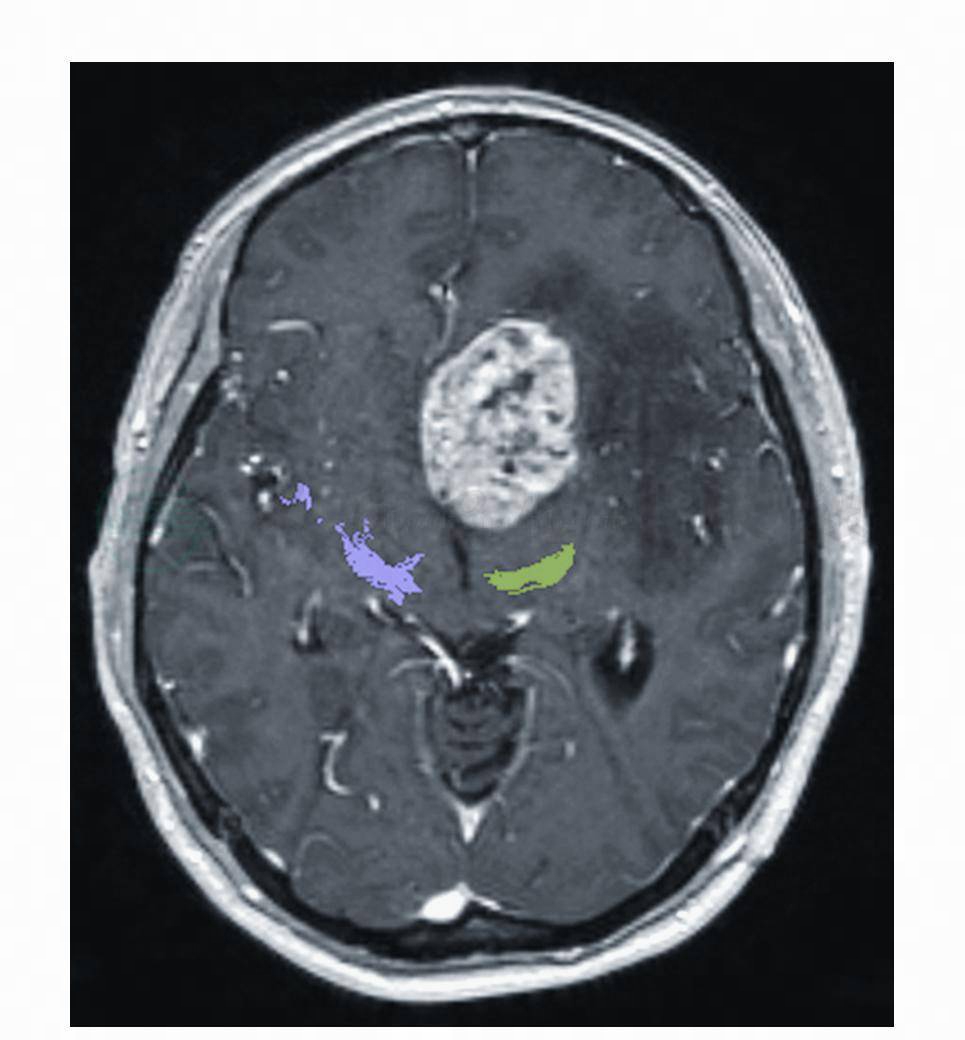
图2 胶质瘤患者弥散张量成像(DTI)检查,显示锥体束与肿瘤位置关系,在增强T1WI可见位于左侧丘脑的高信号肿块与显示彩色的锥体束尚有一定的距离,提示可以作肿瘤全切除
3.数字减影血管造影(DSA)
对胶质瘤诊断虽有帮助,但已被磁共振血管造影(MRA)或CT血管造影(CTA)所取代(图3)。正电子发射断层扫描(PET)显示组织葡萄糖代谢水平,有助于鉴别肿瘤良恶性程度,以及肿瘤的放射性坏死或复发。脑电图对伴癫痫发作者是常规检查。视觉诱发电位(VEP)有助于视觉通路上的肿瘤定位,脑干听觉诱发电位(BAEP)对脑干胶质瘤诊断有意义。脑脊液脱落细胞检查有利于确定髓母细胞瘤、室管膜细胞瘤及脉络丛乳头癌等是否有肿瘤细胞播散。
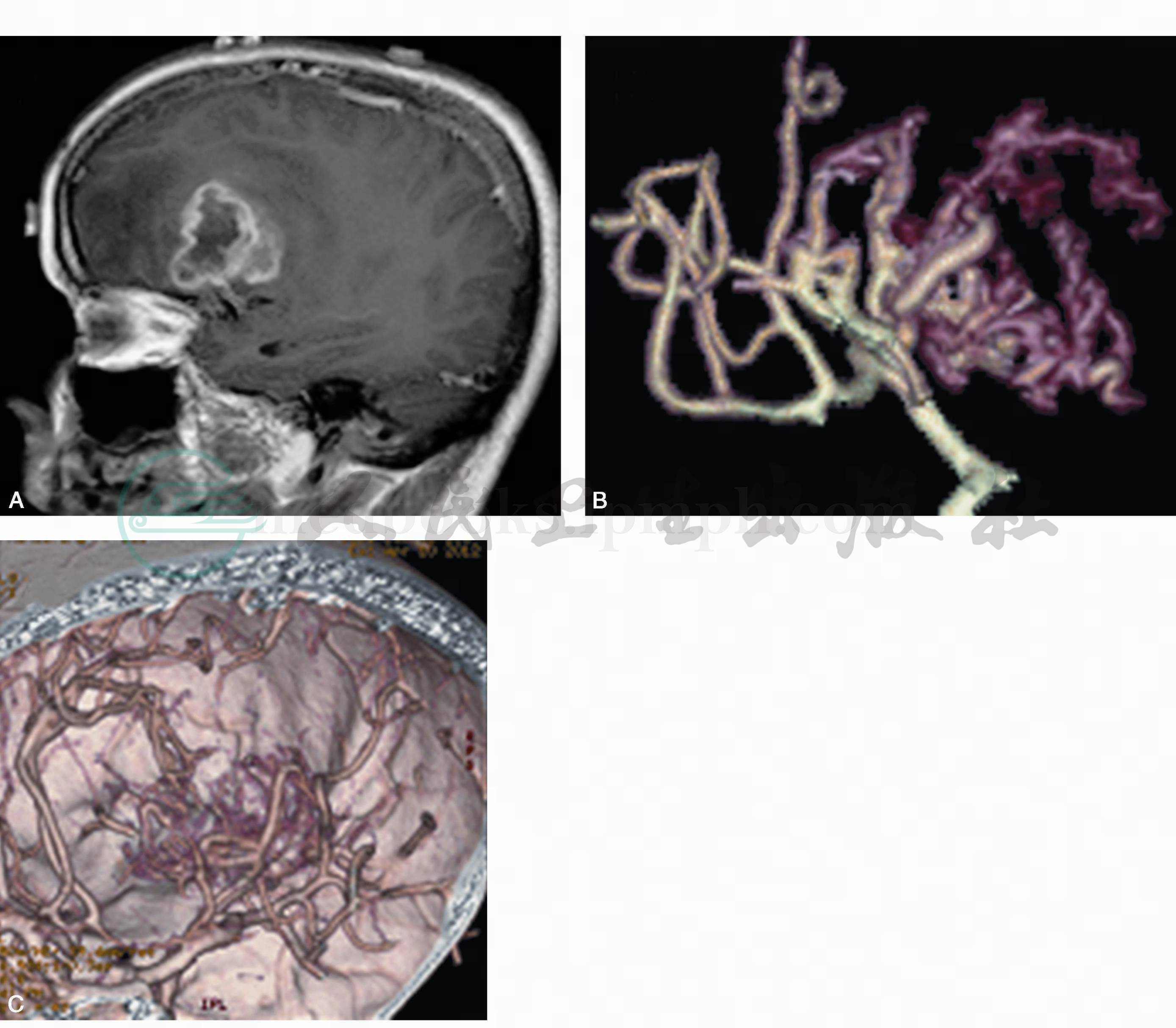
图3
A.MRI的T1WI增强像,显示肿瘤位于左外侧裂上方的额下及额中回附近,边缘呈高信号;B.脑组织减影的CTA显示肿瘤由左大脑中动脉系统的血管供血,进入肿瘤的是显示深红色的未成熟血管;C.脑组织与血管同时显影的CTA显示在左额下回脑表面可见异常的肿瘤血管。
胶质瘤是难治性颅内肿瘤,国内外都在寻求有效新疗法,临床上准确判定疗效很重要。目前尚无统一的疗效判定标准,有五种常用方法可采用。
1.CT测量
(1)疗效判定方法:①肿瘤长径(cm)乘以与其直角交叉的最大径(要求算出各层面积总和);②2个病灶以上要计算总和,治疗前表示为A.B.C,治疗后为a.b.c;③缩小率=100-(a+b+c/A+B+C)×100(%)。
(2)疗效表示方法:①显效:肿瘤病灶消失;②有效:肿瘤缩小50%以上;③微效:肿瘤缩小25%~50%;④无变化:肿瘤缩小25%以下及增大25%以内;⑤恶化:肿瘤增大25%以上或出现新病灶。临床上有的病例治疗结束后肿瘤继续缩小,有效率继续提高,此种情况本法难以表述。
2.存活率或存活期指标
是临床常用方法,可观察1年、2年、3年及5年存活率。存活期是经治疗后生存期间,须与对照组比较,通常以月或年来计算。存活率或存活期均以死亡日期为基点,是较客观的指标。如患者死于其他疾病而非胶质瘤则不应计算在内。
3.缓解期指标
采用此法绘制成图较方便(图4),治疗开始日期为A,肿瘤开始缩小日期为B,缩小达50%日期为C,完全消失日期为D,再度恶化(增大)日期为E,肿瘤增大至治疗前大小的50%日期为F。疗效表示:D~E为显效期,C~E为有效期,A~E为全部有效期。缓解期判断以CT图像肿瘤大小变化为主,参考患者的症状。约15%的病例临床症状虽见好转而CT显示肿瘤却在增大,此为缓解期指标的不足之处。
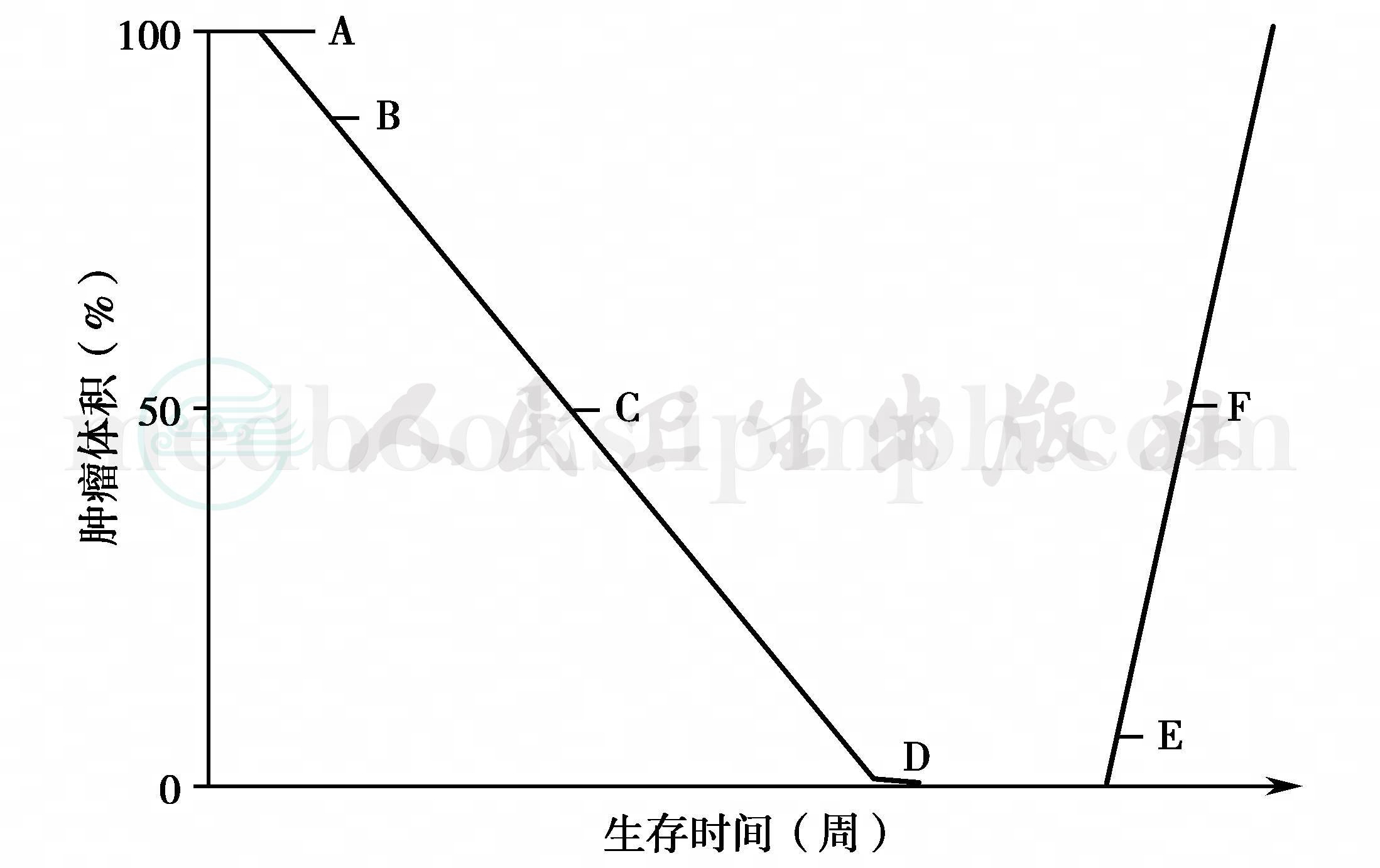
图4 缓解期指标绘制图
4.病灶变化及神经学变化指标
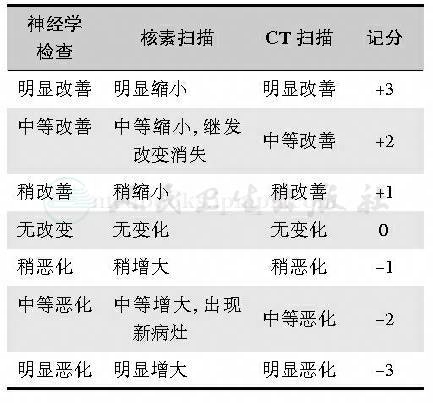
综合神经学检查的症状和体征,核素扫描(占位大小),CT扫描(肿瘤大小、密度、增强效应、周围水肿及脑室大小等)分作7级(表2)。疗效判定:①有效:上述三项中2项得分+2以上;②发展:三项中2项得分-2以下;③无变化:在有效与发展之间。有效率=有效例数/全部例数×100%。本法的不足是评价指标客观性较差。
表2 神经学检查、核素及CT扫描的7级划分表
5.功能状态判定指标
常用Karnofsky记分指标(表3),术后存活者功能状态与术前功能状态有关。Karnofsky 70分以上者术后状态较好,胶质瘤复发时Karnofsky 70分以上可作为二次手术可行性指标,低于70分手术不易获得疗效。
表3 Karnofsky评分表














