神经内分泌肿瘤(neuroendocrine neoplasms,NEN)是一类较罕见的起源于神经内分泌细胞的异质性肿瘤。可合成、分泌、储存多种生物活性胺、小分子多肽或激素等,具有不同的临床表现,好发于胃肠道及胰腺。
以往由于NEN发病率不高、临床表现各异、疾病的命名和分期等不统一,人们对NENs的认识不足,也缺乏有效的治疗手段。近年来,NEN的发病率明显升高。最新流行病学调查显示,胃肠胰腺神经内分泌肿瘤(GEP-NEN)的年发病率约为5.25/10万[2]。虽然GEP-NEN仍较为少见,仅占胃肠道恶性肿瘤的2%,但在欧美已是发病仅次于结直肠癌的居第二位的胃肠道肿瘤。
我国近年来GEP-NEN的报道也逐渐增多,但尚缺乏完整的统计数据。结直肠是NEN的好发部位,但目前对结直肠NEN的认识尚不完善。随着结肠镜筛查以及诊断性活检的广泛应用,预计结直肠NEN的检出率将越来越高。
据报道,长期存在大肠溃疡性结肠炎或Crohn病的患者可以出现内分泌细胞增生及类癌。由于存在这些情况,肿瘤趋向于多发。然而,没有证据可以证实炎性肠病同类癌之间有直接关系,因为几乎所有的类癌病例都是在对炎性肠病进行手术切除时偶尔发现的。
直肠是胃肠道神经内分泌肿瘤的好发部位,常偶然发现,但很少发生类癌综合征。据报道直肠类癌诊断时平均年龄为58岁;直肠类癌的男女之比为1.06∶1。
1.大体检查
大部分病例的肿瘤发现于齿状线上的4~13cm,位于前或后肠壁。直肠类癌多数直径大于2cm,小者只能在显微镜下看到或在肛诊时发现,无症状。大于2cm者表现为结节状突起,位于黏膜下层,常有完整的表层黏膜或有溃疡形成。切面呈灰白色或黄色,界限清楚,无包膜,质硬,浸润性生长。大部分病变趋于固定于直肠壁内。
2.组织病理学
(1)类癌(高分化神经内分泌肿瘤)
据以往文献报道,肠道神经内分泌癌最常见于阑尾和回肠末端,其中直肠类癌占15%,结肠类癌占10%。但Jetmore等报道了170例胃肠道类癌中,94例发生在直肠,占55%,居于首位,其次是回肠和阑尾(各占12%)。
类癌细胞的镜下排列结构很有特点,细胞排列呈器官样或图案样,没有广泛性扩散及坏死,多形性核及分裂象少见,根据组织结构可分为5种类型,其中L细胞,A细胞和PP/PYY细胞发生的肿瘤组织学特点呈典型的B型梁状或条带状,常混有C型(腺管状、腺泡状或菊形团状)以及局部区域偶尔可见A型实性巢状或结节状区域。这种方式与EC细胞肿瘤不同,EC细胞肿瘤中更多见的结构是A型。亲银反应常为阴性,而Grimelius染色为恒定阳性。免疫组化表达神经内分泌标记(NSE、Syn、CgA、Leu-7)、大多数CK阳性,CD99阳性率也很高,而CEA染色常常阴性。在一项84例直肠肿瘤的研究中发现,82%直肠类癌前列腺酸性磷酸酶免疫反应阳性,这个发现在其他部位的类癌中并不多见,这可能与直肠和前列腺共同起源于泄殖腔有关。超微结构观察,直肠L细胞内可见到圆形小的分泌颗粒,Grimelius染色银反应阳性,这同正常人类肠道中所见到的L细胞相似。
直径≤2cm性质类似良性L细胞类癌免疫组化表现ki-67指数≤1%,临床上很少有转移;而大的(>2cm)L细胞肿瘤免疫组化ki-67指数≥5%,则转移发生率很高。
(2)小细胞神经内分泌癌
最好发生于直肠,其次是乙状结肠、盲肠、升结肠和横结肠等部位,肿瘤细胞由小圆形、卵圆形或梭形小细胞组成,细胞质稀少,核浆比例明显增加,较多核分裂象,按Rindi等分级法,相当于3级。小细胞癌在超微结构上可见具有致密核心颗粒(神经内分泌颗粒),大小为90~300nm,单个或成簇分布在膜下或核周,免疫组化染色表达神经内分泌标记物(Syn、CgA、CD56),其表达率≥90%。这些肿瘤可以单独存在或与腺癌混合存在。小细胞癌侵袭性强,恶性程度高,患者早期出现血行转移,约70%~75%的患者初次手术时就已经发生肝转移。
(3)大细胞神经内分泌癌
大体表现为息肉状、环状,可围绕肠腔引起梗阻,由大细胞排列成器官样、巢状、小梁状、玫瑰样和栅栏状,伴有灶状坏死,通过免疫组化(CgA、Syn、CD56)及电镜证实存在神经内分泌改变,提示了肿瘤的神经内分泌分化。与小细胞癌相比,肿瘤细胞质更丰富,细胞核卵圆形,核空泡化更显著,核仁更加突出。这些肿瘤发病低,诊断时部分病例已经发生局部淋巴结或肝转移,预后差。
1.生化指标
目前尚缺乏结直肠NEN的特异性标志物。血清嗜铬粒蛋白(chromogranin A,CgA)仍是结直肠NEN诊断以及疗效评估中最重要的指标。CgA是一种49kD的酸性多肽,存在于大部分神经内分泌细胞的分泌颗粒基质中,与肽类或胺类激素共同释放,它还是血管生成抑制因子、胰抑素等多种功能肽的前体。其诊断NEN的灵敏度和特异度可达70%~100%。还可用于疗效监测及预后评估。但对于使用生长抑素类似物、质子泵抑制剂以及肾功能或肝衰竭、慢性胃炎的患者,CgA的水平可能受到影响,因此在选择CgA检测方法及结果解读时需要谨慎。
对于具有类癌综合征的患者,24小时尿5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)有很大的价值。5-HIAA是5-羟色胺的代谢产物,其检测类癌综合征的灵敏度为100%,特异度为85%~90%。但是由于食物或药物对这些激素水平都可能造成影响,因此其应用受到限制。
Thanasupawat等和Mashima等分别研究发现,胰岛素样因子INSL5通过与其受体RXFP4结合进而激活下游信号通路可能在结直肠NEN中起到了特殊作用。INSL5可能是肠内分泌细胞的独特标志,但目前有关INSL5的研究尚处初级阶段,暂未得到临床应用。另外绒毛促性腺激素、胰腺多肽、肠高血糖素等水平在结直肠NEN患者中也可能发生改变,但目前尚缺少临床数据支持。
2.影像学检查
影像学检查是协助NEN诊断和定位的重要方法。最常用的诊断结直肠NEN的方法是结肠镜检结合病理以及超声内镜(echo endoscopy,EUS)。超声内镜可精确评估病变的大小、浸润的深度以及淋巴结转移的情况。应用超声内镜的确定浸润深度的敏感度和特异性分别为87%和93%。但直径>1cm的直肠NEN患者不推荐应用超声内镜检查评估病期。
对于部位较高的病变,结肠镜很难通过,因此计算机断层扫描(computed tomography,CT)和磁共振成像(magnetic resonance imaging,MRI)也推荐使用。为评估病情,生长抑素受体扫描(somatostatin receptor scintigraphy,SRS)、正电子发射计算机断层成像(positron emission tomography,PET)以及选择性血管造影等也可使用。
腹部超声检查可用于初步评估肝转移的情况以及可能的细针穿刺活检。肺部、腹腔、盆腔病变常借助CT和MR成像来评估。生长抑素受体扫描可用于评估患者是否适宜接受生长抑素类似物的治疗。对于SRS阴性患者,可使用PET-CT来检查。
由于结直肠NEN患者常常没有特异性的临床症状,因此在初诊时影像检查的目的主要是鉴定原发肿瘤、评估肿瘤的范围以及制定治疗计划等。后期则用于术后或治疗后疾病稳定期的监测,或对疗效进行评价。
3.病理诊断与分期
怀疑结直肠NEN的患者需经病理确诊。2011年中国GEP-NEN病理学诊断共识推荐以NEN泛指所有高、中、低分化的NEN。其中高、中分化NEN命名为(neuroendocrine tumor,NET),为潜在恶性肿瘤,发生于结肠的NET在早期常表现为息肉,但在确诊时已有约30%患者存在淋巴结、肠系膜、腹膜以及肝脏转移;而发生于直肠的NET常表现为直径1~2cm的息肉,浸润黏膜及黏膜下层,但确诊时也有部分患者转移至淋巴结。低分化NEN命名为(neuroendocrine carcinoma,NEC),为高度恶性肿瘤,结直肠NEC常发生于右半结肠,约75%起源于大细胞,分裂指数较高(中位核分裂象34/10HPF),Ki-67指数>20%。
目前常用免疫组织化学(immunohistochemistry,IHC)染色来确定NEN的分化程度和特殊类型多肽激素及生物活性胺的表达[18-20]。组织标本常来源于手术、内镜下活检以及超声引导下肝脏穿刺活检。标志物常采取突触素(synaptophysin,Syn)和CgA。其他指标如神经元特异性烯醇酶(neuron-specific enolase,NSE)和CD56等在NEN中常呈阳性表达,但无特异性。特异性的染色,如5-HT(5-羟色胺)、胃泌素、胰岛素、胰高糖素可用于确定肿瘤类型,但由于激素的表达并不一定意味着会分泌,所以单纯免疫组织化学染色并不能确定NEN是功能性的。
2010年新的WHO分级标准将NEN按照组织学和增殖活性分级,根据核分裂象数和/或Ki-67阳性指数将NEN分为G1、G2、G3,见表1。
表1 2010年WHO神经内分泌肿瘤分级
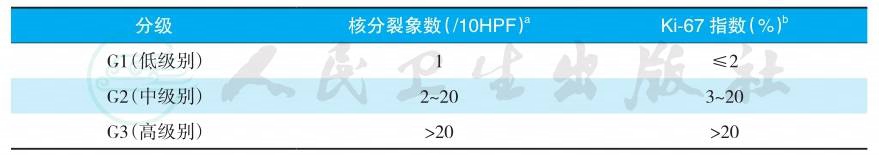
注:a核分裂象数需至少计数50个高倍视野;b用MIBI抗体,在核标记最强的区域计数500~2000个细胞的阳性百分比
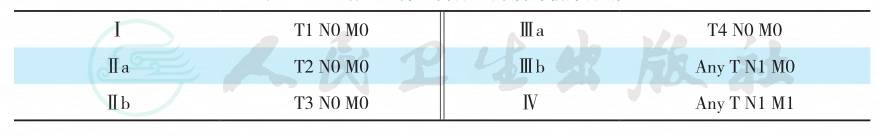
结直肠NEN的TNM分期及临床分期见表2、表3。
表2 结直肠神经内分泌肿瘤的TNM分期
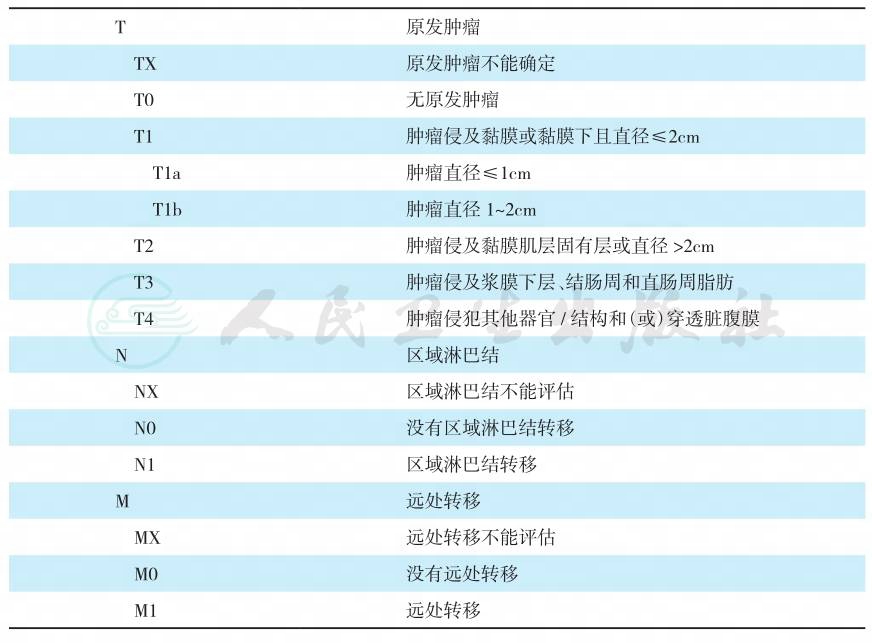
表3 结直肠神经内分泌肿瘤的临床分期
完整的病理报告需包括:根据WHO分类的组织学类型、组织分化程度、G分级、TNM分期、外科切缘。病理诊断NEN必须行免疫组织化学检测NEN标志物的表达,包括突触素和CgA、Ki-67增殖指数等。
预后不良因素包括:肿瘤直径>2cm、侵及肌层、血管侵犯、切缘阳性以及核分裂象数>2个/10HPF。
(一)手术治疗
结直肠NEN的治疗需经MDT团队(包括有经验的外科医师)综合评估。首选的治疗方式是根治性手术。肿瘤距切缘>1mm提示完整切除,反之则为切除不完全。
对于结肠NEN,如能确定肿瘤边缘阴性,可行根治性切除(包括区域淋巴结)。对于NEN G1和G2级有转移的患者,推荐采用姑息性切除联合区域淋巴结清扫。对于有邻近器官受侵的患者,如果可能,可行多器官切除联合左半或右半结肠切除。如果已不可能完整切除肿瘤,在技术可行的前提下,最大化的行减瘤手术。
对于直肠NEN,不适宜内镜治疗的患者(侵及肌层、区域淋巴结转移)可行传统开腹或腹腔镜手术治疗。对于肿瘤直径>2cm,或直径为1~2cm但肌层受侵的患者,需行根治性切除。对于T3、T4的肿瘤,如果没有远处转移,也应行根治切除。但是根治手术是否可以推迟或减少远处转移的发生目前尚无相关研究。对于局部复发而无远处转移的患者,推荐再次手术治疗。但局部复发合并远处转移的患者,由于其预后不佳,不常规推荐手术,但对于有梗阻或出血的患者,可考虑行姑息性直肠切除术或减瘤术。在NEN G1、G2级有局限于肝脏的移的患者,可行根治性肿瘤切除联合肝转移灶切除或肝移植。
内镜下手术主要适用于直肠NEN患者,这是由于结肠NEN常发生区域淋巴结转移而需经腹手术治疗。报道显示在病灶≤1cm且局限于黏膜层的结肠NEN,有4%患者发生淋巴结转移;而其他患者发生淋巴结转移的比例达14%。约80%直肠NEN的病灶≤1cm,常侵及黏膜下并无转移,对这部分患者可考虑内镜下手术治疗。病灶较大的患者(>1cm,但≤2cm)也可以行内镜手术。
(二)生物治疗
目前结直肠NEN的生物治疗主要包括生长抑素类似物如长效奥曲肽和干扰素治疗等。对功能性NEN患者,不管肿瘤大小,生长抑素类似物是标准的一线治疗方案。而干扰素-α由于其不良反应小,常在某些患者中作为二线治疗用于症状控制,也可叠加治疗用于生长抑素类似物无法控制临床症状的患者。对于非功能性的NEN患者,生长抑素类似物是否具有抗肿瘤效应仍缺少确凿的证据。但根据CLARINET和RADIANT-2研究以及波兰的研究结果,生长抑素类似物对这部分患者可能具有一定疗效。
长效奥曲肽:PROMID试验证实,每4周30mg长效奥曲肽具有显著抗增殖作用,中位TTP是14.3个月,显著优于安慰剂组的6.0个月。基于这个结果,长效奥曲肽被推荐为功能性和非功能性侵袭性G1/G2级NET的一线治疗。与此相反,在转移性低分化的NEC G3级患者不管其肿瘤大小和来源,生长抑素类似物均不做推荐。
(三)靶向治疗
目前最受关注的是mTOR受体信号通路和血管内皮生长因子(VEGF)受体信号通路。如mTOR抑制剂依维莫司和RTKs抑制剂舒尼替尼等。
依维莫司:虽然RADIANT-2试验结果表明,依维莫司联合长效奥曲肽治疗胰腺外NETs的中位PFS为16.4个月,安慰剂联合长效奥曲肽组为11.3个月,两组间无统计学差异。但亚组分析显示,对于结直肠NEN G1和G2进展的患者接受依维莫司联合长效奥曲肽治疗的PFS(29.9个月)显著优于安慰剂联合长效奥曲肽组(6.6个月)。接受依维莫司联合长效奥曲肽治疗的患者的进展风险降低了66%。联合治疗组67%患者治疗后肿块缩小。
虽如此,由于对于转移性NET的治疗缺少其他药物的循证医学证据,在生长抑素类似物、干扰素及手术治疗失败后,依然可以选择依维莫司进行治疗。
TKI抑制剂舒尼替尼、帕唑帕尼在胰腺NET中显示了良好的抗肿瘤效果,但在结直肠NEN的治疗中尚缺少相应的循证医学证据。
多肽受体靶向放疗:有证据显示,用90铱和177镥标记的DOTATOC或DOTATATE在治疗功能性和非功能性NET肝转移患者中可起到很好的治疗效果。在转移性直肠NET患者中,可得到更高的客观反应率。
(四)化学药物治疗
分化良好的结直肠NET对传统的细胞毒化疗药物如多柔比星、5-氟尿嘧啶、链佐星等不敏感,反应率低于15%。对于低分化或有转移的G3级NEC患者,全身化疗可起到一定的效果。顺铂+依托泊苷联合的EP方案可作为一线治疗方案。如Patta等报道,EP方案对结直肠NECs患者具有较好的反应率,中位PFS 4.5个月,中位OS 9.5月。如发生进展,需考虑行二线治疗。目前尚缺少成熟的二线治疗方案。
目前认为替莫唑胺单药或联合贝伐单抗±卡培他滨、伊立替康联合5-Fu可能有一定的效果,另外5-氟尿嘧啶静脉点滴或卡培他滨口服联合奥沙利铂也可作为未来研究的方向。
(五)放射性核素治疗
对于结直肠NEN患者,目前尚没有独立的数据观察生长抑素受体介导的放射性核素治疗 (peptide receptor radionuclide therapy,PRRT)的疗效。根据PRRT在其他NEN中的效果,对于广泛期及非手术的G1、G2级NEN,如SRS检测确定生长抑素高表达,且其他治疗无效,可考虑行PRRT治疗。
对于病灶<1cm的G1及G2无淋巴结转移及无肌层侵犯的患者不需要常规随访。对于G3病灶<1cm以及G1~G3病灶1~2cm的患者,每年行肠镜检查。
对于病灶>2cm的患者,需行随访。随访需包括病史、体格检查、生化指标(CgA、5-HIAA水平)以及影像学评估(CT、MRI)等。
对于G1/G2患者:第一年行结肠镜检、影像学检查及CgA检查;G3患者,第一年每4~6月行上述检查一次,以后每年行影像学检查一次。对于直肠NEN患者,推荐行结肠镜、磁共振检查;对于结肠NEN患者,行结肠镜、CT检查;对于肝脏评估,行增强磁共振及多层螺旋CT检查;CgA检查可持续10年。对18~24个月后生长抑素受体2表达阳性的患者行奥曲肽扫描或PET/CT检查。对快速进展或影像学信息缺乏的患者,需重新取得肝脏转移灶活检评估增殖活性。













