英文名称 :intracranial aneurysms
脑动脉瘤是指颅内动脉管壁上的异常膨出,是引起自发性蛛网膜下腔出血的首位病因(约占75%~80%)。造成脑动脉瘤的病因尚不明确,多数学者认为是在颅内动脉管壁局部先天性缺陷的基础上,合并腔内压力增高引起,高血压、脑动脉硬化与动脉瘤的发生发展有关。另外,感染、外伤等也可以导致动脉瘤的发生。
常见病因是:①先天性动脉瘤最多见(80%~90%),多为囊性,多见于脑底动脉环之动脉分叉处,此处动脉中层最薄弱,承受血流冲击力最大;②动脉粥样硬化性动脉瘤:动脉壁薄弱或形成动脉夹层(arterial dissection),因动脉内压或动脉壁间剥离形成夹层动脉瘤或梭形动脉瘤;占10~18%;③感染性动脉瘤:真菌性或细菌性,占0.5~2.0%,炎症破坏动脉壁形成,如海绵窦炎损伤颈内动脉,细菌栓子停留在动脉内,脑部炎症破坏动脉壁后形成动脉瘤;④外伤性动脉瘤:又称假性动脉瘤,约占0.5%,头部外伤时脑血管随脑组织大块移动,撞击颅内边缘锐利结构,如胼周动脉撞击于大脑镰下缘,MCA撞击于蝶骨嵴造成动脉壁损伤,颅脑火器伤直接损伤动脉壁后形成动脉瘤等;⑤胚胎血管残留:胚胎原始血管在发育过程中保留下来,有的退化消失,如消失不完全在残株处形成动脉瘤。
颅内动脉瘤世界范围内的患病率约为0.2%~9%,多为单发,约20%~30%为多发,可发生于任何年龄,发病高峰在40~60岁,女性稍多。颅内动脉瘤在我国具有患病率高、破裂风险不明、破裂后致死率和致残率高等特点。
脑血流动力学因素损伤动脉壁,特别是耐受冲击力最强的内弹力膜,导致动脉壁软弱,膨出形成动脉瘤。最承受血流冲击的部位是动脉分叉隆突部和分支远侧角(图1)。动脉血流可引起动脉壁震荡(vibration)和湍流(turbulence),引起动脉瘤壁损伤,导致动脉瘤扩大和破裂。正常动脉壁结构内弹力膜和肌层在动脉瘤颈部突然中断,动脉瘤囊内只有内膜覆盖于瘤壁,瘤壁薄弱,只有断裂的内弹力膜,有的瘤壁内有层状附壁血栓和纤维素沉积使瘤壁增厚,有的瘤壁发生钙化(图2)。
美国SAH与动脉瘤协作研究组(1966)认为,动脉瘤临界最大径是7mm。McCormick(1970)认为,动脉瘤最大径>3mm即可能破裂。Kassell等(1990)报告,动脉瘤性SAH国际协作研究3521例,结果,78%的患者动脉瘤破裂时最大径<12mm,20%的患者为12~24mm,2%的患者>24mm。事实上,动脉瘤破裂并不完全取决于动脉瘤大小,有些大型或巨大动脉瘤,由于瘤内血流迂缓,瘤壁上有机化的附壁血栓使之加固,破裂风险反而减少。美国协作研究组调查动脉瘤破裂的诱因,1/3的患者在睡眠中发生破裂,1/3的患者在起身或弯腰、情绪激动、排便、负重、咳嗽、分娩、创伤、手术或性生活等,另1/3患者找不到诱因。三个因素与动脉瘤破裂有关:动脉压升高、闭气引起瓦萨瓦效应(Valsava effect),脑与脑底动脉环(Willis circle)在颅腔内机械性运动。血压是作用于动脉瘤壁上的持续性因素,任何原因导致血压剧烈波动都会引起动脉瘤破裂。
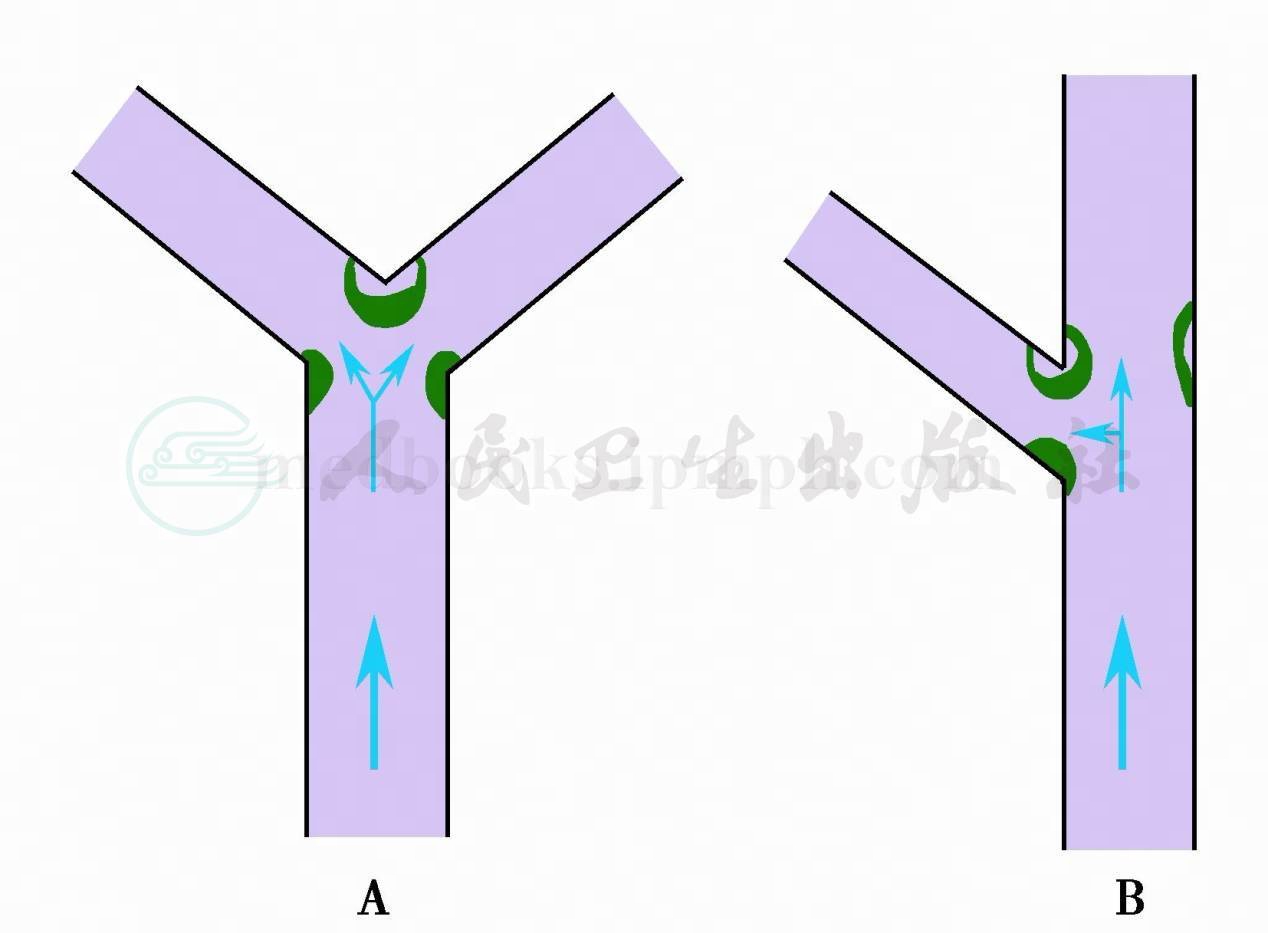
图1 动脉分叉或分支处血流冲击的剪应力
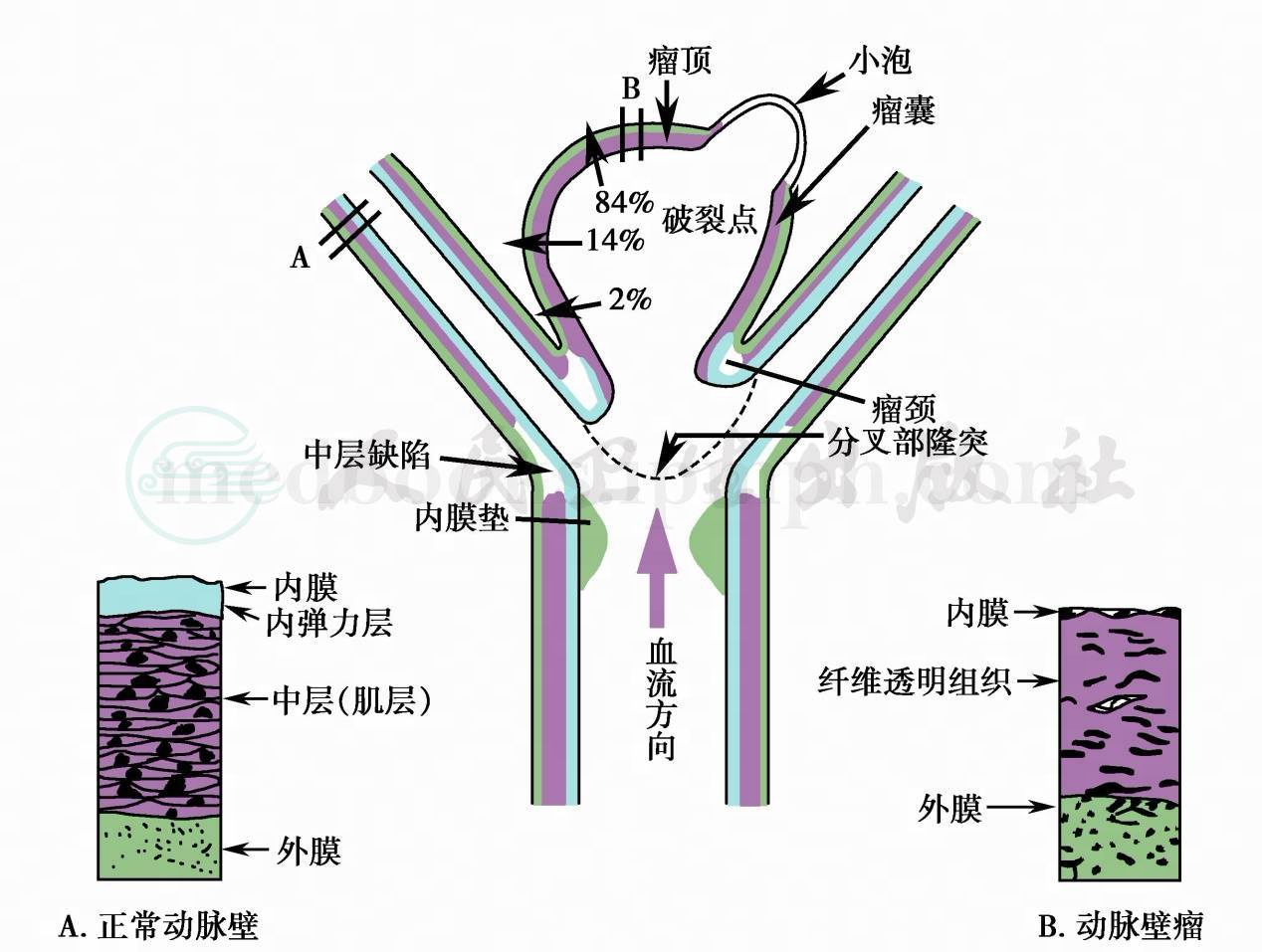
图2 颅内动脉瘤形成的部位和动脉壁的改变
A.正常动脉壁;B.动脉瘤壁
颅内动脉瘤好发于Willis环及其主要分支血管,尤其是动脉分叉处或血流动力学改变的部位。其中,80%~90%位于前循环,10%~20%位于后循环。根据动脉瘤形态,可以分为囊性动脉瘤、梭形动脉瘤和夹层动脉瘤。根据载瘤动脉不同可分为前交通动脉瘤、颈内动脉-后交通动脉瘤、大脑中动脉瘤和基底动脉瘤等。根据动脉瘤大小可分为小型动脉瘤(<5mm)、中型动脉瘤(5~10mm)、大型动脉瘤(11~25mm)和巨大动脉瘤(>25mm)。
动脉瘤根据形态可分为囊状(球形、葫芦形、漏斗形),梭形及壁间动脉瘤;根据直径分为:小动脉瘤(<0.5cm)、一般动脉瘤(>0.5cm;<1.5cm)、大型动脉瘤(>1.5cm;<2.5cm)及巨大动脉瘤(>2.5cm)。Crawford解剖163个破裂的颅内动脉瘤,将瘤分为远侧1/3(瘤顶)、中部1/3(瘤体)及近侧1/3(瘤颈)三部分。瘤顶破裂占64%,体部10%,颈部2%,另24%不能确定部位。Crompton检查289例死于动脉瘤破裂患者脑标本,发现86%为动脉瘤顶部破裂,11.8%在体部,1.8%在颈部。57%的破裂动脉瘤呈分叶状,未破裂动脉瘤仅16%呈分叶状。
Noren连续监测颅内压发现,当动脉瘤破裂出血时颅内压可急剧升高60~160mmHg,可持续8~20分钟。颅内压升至舒张压时,只在收缩压时有脑血流,导致载瘤动脉痉挛,破口处血小板凝块可在1~2分钟形成,使出血停止。出血量大可迅速死亡。SAH后数小时内引起蛛网膜下腔急性炎性反应,48小时后逐渐消退,出血后4小时内红细胞开始溶解,至第7日达高峰,80%的患者出血后10~20日脑脊液转清,如出血后2~3周仍有大量红细胞应考虑再出血。约半数颅内动脉瘤破裂后发生颅内血肿,可位于脑池内、脑实质内、脑室内或硬脑膜下腔,多见于动脉瘤附近;如前交通动脉瘤破裂,血肿多位于终板池或前额叶内侧;MCA动脉瘤血肿多位于外侧裂、额叶或颞叶,可破入邻近的脑室。血肿有助于判断动脉瘤部位,对多发性动脉瘤有助于判断出血的动脉瘤。脑内血肿是动脉瘤破裂后昏迷的主要原因之一,单纯SAH仅半数患者昏迷,2/3合并脑内血肿的患者发生昏迷。血肿破入脑室者症状严重,死亡率高达64%~100%,出血量大几乎均死亡。硬脑膜下血肿多因出血凶猛,撕破蛛网膜进入硬脑膜下间隙。约1/3动脉瘤破裂的患者发生脑积水,3日内为急性脑积水,3日~4周为亚急性脑积水。Graff‐Radford报道3521例SAH后3日内入院患者,CT检查15%发生急性脑积水,血流堵塞脑室系统或脑池使颅内压急骤升高,严重者昏迷或死亡。慢性脑积水约10%,是蛛网膜下腔粘连阻碍脑脊液吸收,约1/5的慢性脑积水患者需行脑脊液分流术。
动脉瘤性SAH后2~3日内DSA很少发现血管痉挛,4~12日DSA可见30%~70%患者发生不同程度与范围的脑血管痉挛,其中20%~30%发生脑缺血症状。SAH后红细胞溶解释放出大量血管活性物质可引起脑血管痉挛,急性期血管痉挛较轻,时间较短。慢性血管痉挛始于SAH后72小时,第7日达高峰,持续2~3周;SAH后血液发生纤溶,释放出5‐HT、血管紧张素(angiotonin)、儿茶酚胺、前列腺素和钾离子等多种血管收缩物质,红细胞溶解后释出氧合血红蛋白(oxyhemoglobin,oxyHb)是慢性血管痉挛的启动因素,血管内皮细胞释放内皮素(endothe‐lin),是一种21个氨基酸组成的多肽,有强力缩血管作用。血管平滑肌细胞膜钙离子通道受损,细胞外钙离子内流,细胞内细胞器中钙离子释放,使细胞质中钙离子浓度增高,达到一定阈值后在一系列酶作用下引起平滑肌细胞收缩或血管痉挛。
Weir报告100例动脉瘤性SAH的并发症,肺部、心血管系统及泌尿系统26%较多。如血中儿茶酚胺升高导致心律不齐(20%~40%),严重者引起心肌梗死;电解质紊乱10%~30%,如抗利尿激素分泌失调综合征(syndrome of inappropriate secretion of antidiuretic hormone,SIADH)或脑性盐耗损综合征(cerebral salt wasting syndrome)导致低钠血症;胃酸及促胃液素(gastrin)分泌增加,3%~4%的患者发生胃肠道应激性溃疡出血。
1.CT检查
临床疑诊SAH首选CT检查,CT诊断SAH与出血量及出血时间有关,出血量少可能漏诊。Kassell等报道1553例SAH患者,CT检查在出血后24小时内发现92%的病例为SAH,20%脑室内出血,19%脑内血肿,2%硬脑膜下积血,3%阴性,8%有占位效应,16%有脑积水,5%发现动脉瘤。随着时间推移,出血检出率降低,出现低密度区增多,SAH后第5日仅58%显示SAH,脑内血肿吸收较慢,18%仍见脑内积血。VanGijn观察100例SAH患者,出血5日内85%的患者可见积血,1周后降为50%,2周后降为30%,后期所见者多为脑内积血,如2周后仍有较多蛛网膜下腔积血,可能为再出血。蛛网膜下腔积血分布可判断动脉瘤部位,依据多发性动脉瘤中出血的动脉瘤。颅骨X线平片可发现瘤壁钙化的动脉瘤,颈动脉床突旁动脉瘤可侵蚀前床突。
蛛网膜下腔积血溶解后可引起血管痉挛,严重程度与出血量有关。Fisher根据CT影像将SAH分为4级:
Ⅰ级 蛛网膜下腔无明显积血;
Ⅱ级 蛛网膜下腔有弥散的薄层积血,厚度<1mm;
Ⅲ级 蛛网膜下腔有弥散性厚层积血,厚度>1mm;
Ⅳ级 蛛网膜下腔有弥散性厚层积血或有脑内和(或)脑室内血肿。
如CT显示蛛网膜下腔无明显积血或仅有薄层积血,出现严重血管痉挛仅12.5%;如厚层积血发生血管痉挛为96%。根据颅内动脉瘤与SAH协作研究(ICSTAS)统计3521例动脉瘤破裂患者,其中2940例(85.2%)发现蛛网膜下腔积血,49%为弥散性积血,其中30%为厚层积血,19%为薄层积血。高分辨率薄层CT扫描造影剂增强可发现直径>5mm的动脉瘤及载瘤动脉。Newell等在CT扫描同时快速连续输注造影剂进行灌注CT扫描(infusion CT scanning),检查29例动脉瘤>5mm患者,检出28例(95.6%);13例2~5mm动脉瘤查出9例(69%),不能发现直径<2mm的动脉瘤。Taipieri等用三维螺旋CT即CT血管造影(CTA)检查颅内动脉瘤,并可发现多发性动脉瘤。一项179例SAH合并动脉瘤患者的前瞻性研究发现,CTA诊断动脉瘤灵敏度为96%,特异度97%,可发现直径1~2mm动脉瘤(Kangasniemi 2004)。与DSA相比,CTA为无创性,成像快,可通过三维重建从不同角度显示动脉瘤。瘤壁或血栓钙化可显示密度不同的同心圆影像,称为靶环征(target sign)。
2.MRI和MRA检查
SAH后1周内MRI诊断不及CT敏感,因蛛网膜下腔新鲜血液与脑信号相等,1周后血中氧合血红蛋白转变为正铁血红蛋白,T1W I和T2W I均呈高信号,此时MRI检查敏感。在T2W I动脉瘤和大血管均呈低信号流空现象(flow void phenomenon),与高信号脑脊液对比明显,MRI可显示巨大动脉瘤呈流空现象或靶环征等不同表现。MRA可发现直径>3mm的动脉瘤。
3.DSA
是诊断颅内动脉瘤的金指标。三维DSA可呈现脑血管的立体影像,观察动脉瘤与邻近血管的空间定位,对手术处理动脉瘤有帮助。全脑血管造影及重复造影可最大限度增加动脉瘤检出率。是否常规行双侧椎动脉造影视具体情况而定,因椎动脉造影反应较大,当一侧椎动脉造影时造影剂可逆流到对侧椎动脉或小脑后下动脉。美国颅内动脉瘤与SAH协作研究报告显示,动脉瘤患者仅作单侧动脉造影,动脉瘤发现率为45%,双侧颈动脉造影检出率67%,造影阴性患者经一段时间重复双侧造影有23%患者可发现遗漏的动脉瘤。双侧颈动脉造影阴性的死亡病例,尸检发现60%存在椎基底动脉系统动脉瘤。Iwanaga发现前交通动脉瘤最易被遗漏,假阴性可因载瘤动脉痉挛或瘤腔内血栓形成使造影不能进入瘤囊内,造影技术不佳,动脉瘤太小或未能识别,造影范围不充分而遗漏等。以往认为SAH后早期脑血管造影会引起动脉瘤破裂,主张出血3周后造影,目前主张早期造影。据美国颅内动脉瘤与SAH协作研究统计,SAH后3日内脑血管造影并发症最少,4日后逐渐增加,2~3周是再出血高峰期,3周后又减少,造影很少导致动脉瘤破裂,但应避免在SAH后6小时内进行。动脉瘤破裂患者应有序进行检查,CT检查初步定位,首先选择最可能发现动脉瘤的血管造影。有时需做交叉充盈试验(cross filling test),了解两侧颈动脉系统间侧支供血情况,做一侧颈动脉造影时可压迫对侧颈动脉,观察对侧颈动脉使同侧颈动脉各分支充盈情况。
4.脑脊液检查
可提供SAH的直接证据,目前仅用于疑诊而CT检查阴性患者。腰穿放液宜少宜慢,以免导致脑疝,避免放液过多使压力差增大,可能引发再出血。
主要包括显微手术夹闭和介入治疗。应根据不同病情选择个体化的治疗方案。
介入治疗包括多种方法,其中,颅内动脉瘤弹簧圈栓塞术是目前首选的介入治疗方式(图3、图4)。在DSA的监视下,经微导管向动脉瘤腔内送入弹簧圈后解脱留置,通过弹簧圈的机械闭塞及继发的腔内血栓形成,将动脉瘤隔绝于载瘤动脉的血液循环之外,从而达到防止动脉瘤破裂的目的。
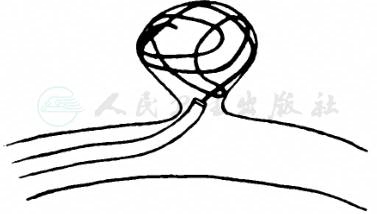
图3 颅内动脉瘤弹簧圈栓塞术示意图
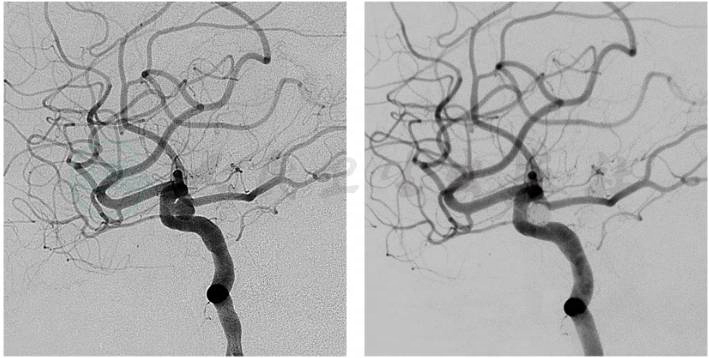
图4 颅内动脉瘤弹簧圈栓塞术
在单纯弹簧圈栓塞技术的基础上,根据动脉瘤大小、部位、瘤颈宽度等不同又发展出球囊辅助栓塞、支架辅助栓塞、弹簧圈联合液体栓塞剂栓塞等技术。近年来应用血流导向装置(如密网支架等)治疗颅内大型宽颈动脉瘤取得了满意的效果,但长期疗效仍需进一步观察。













