英文名称 :middle cerebral artery aneurysm
大脑中动脉是颅内动脉瘤好发部位之一。由于大脑中动脉供应脑组织面积较大,分支数量众多,多数分支缺乏充足的侧支循环,因此,大脑中动脉瘤的诊断治疗具有一定的特点和挑战性。早期探索中,Dandy曾经认为大脑中动脉瘤的手术风险太大,不提倡采用手术治疗。目前,尽管一部分研究者仍在探索血管内技术对于治疗大脑中动脉的价值和意义,但大多数学者都认为显微手术是大脑中动脉瘤的首选治疗方案。除了解剖的因素,大脑中动脉瘤常伴发其他部位脑动脉瘤,较易发生脑内血肿,也是颅内大型甚至巨型动脉瘤的好发部位之一,其治疗策略较之其他前循环动脉瘤,仍存在很多问题有待解决。
大脑中动脉瘤是常见的脑动脉瘤,占全部脑动脉瘤的7.6%~20.8%不等,在芬兰等北欧国家发病率更高,据大宗病例研究报道可达48%。患者发病年龄集中在40~50岁以上,与其他部位颅内动脉瘤相仿。在多数研究报道中,患者性别比例总体以女性居多,而在赫尔辛基大学中心医院Juha教授的研究中发现男性患者居多。
大脑中动脉瘤常常伴发其他部位颅内动脉瘤,Yasargil报道32.1%大脑中动脉瘤患者伴发颅内多发动脉瘤。近端动脉瘤发生多发动脉瘤的几率是分叉部或远端动脉瘤的3倍。大脑中动脉也是镜像动脉瘤最常发生的部位,大脑中动脉瘤伴发的颅内多发动脉瘤约三分之二为镜像动脉瘤。Juha的大样本研究结果提示在所有大脑中动脉瘤中,大型及巨大动脉瘤的比例高达13.7%。由于解剖部位的特殊性,大脑中动脉瘤破裂出血后脑内血肿的发生率可高达34.1%~40%,明显高于其他部位脑动脉瘤。
相关应用解剖:颈内动脉(internal carotid artery,ICA)入颅后在其终点分为大脑前动脉(anterior cerebral artery)和大脑中动脉(middle cerebral artery,MCA)两根终支,通常大脑中动脉直径明显粗于大脑前动脉,因而常被看做颈内动脉的直接延续。大脑中动脉通常被人为划分为M1~M4四段。M1段,也称为蝶骨嵴段,是指颈内动脉分叉部与膝部之间的中动脉节段,多平行走行于蝶骨嵴后方1cm左右的侧裂池内。M1段,即大脑中动脉主干,多在岛阈的最高点分叉,并有双分叉、三分叉及多分叉等三种方式,而以双分叉最为常见。双分叉后的中动脉分支呈“Ω”样,分为上干和下干,分别供应额叶和颞叶。M2段,指膝部与岛阈环沟之间位于岛叶表面的中动脉节段,也称作岛段。M3段即起自岛阈环沟止于侧裂表面的紧贴脑叶岛盖表面行走的众多中动脉分支节段,岛盖段血管在岛叶环沟和侧裂外表面处有两个180°的U形转折。M4段包括所有走行出侧裂后覆盖大脑半球凸面的中动脉分支节段。
大脑中动脉的分支动脉分为两类:一类是起自主干后发出的分支,主要供应大脑半球皮层的动脉,称作干动脉(stem arteries);另一类是指从大脑中动脉发出后进入前穿质供应大脑深部结构的穿支动脉,即豆纹动脉(lenticulostriate arteries)。干动脉变异较大,最常见的每侧半球平均八支干动脉,干动脉及其分支彼此间侧支吻合较少。大脑半球表面只接受一支干动脉供血的区域有颞顶区、角回区和中央区。需要注意的是,有时从大脑中动脉主干分叉部近端直接发出皮层动脉分布于颞叶或额叶,多为一支,直径较粗,被称作早期分支(early branch)。在DSA上容易将粗大的早期分支从M1主干分出的部位误认为大脑中动脉分叉部,读片时应注意辨认鉴别。豆纹动脉常被分为内侧组(medial group)、中间组(intermediate group)和外侧组(lateral group)。内侧组变异较大,出现率仅有50%左右,大多起自M1段靠近颈内动脉分叉处(多在10mm内)后方或上方;中间组多起自M1段主干(距颈内动脉分叉部10~20mm)、分叉前段或早期分支的后、后上或上壁,较少的分支(一般平均为3支)中至少有一支较粗大动脉,进一步分叉形成多达30个树枝状分支;外侧豆纹动脉主要起自M1外侧节段分叉前后、早期分叉血管(下干为主)或M2段的后、上或后上壁,以S形进入前穿质的后外侧分。外侧和中间组豆纹动脉穿经壳核后供应几乎全部内囊上部和尾状核头及体部。内侧豆纹动脉供应外侧及中间豆纹动脉供血区的内侧及下方,主要包括苍白球外侧部、内囊前肢上部和尾状核头的前上部。
随着动脉搭桥手术技术的不断推广,在讨论大脑中动脉结构以及颅内动脉瘤(尤其是复杂动脉瘤)手术治疗时,如何选择颅内外动脉搭桥术的受体动脉是一个值得专门探讨的问题。Rohton指出选择受体血管时需要考虑的最主要因素应该是:皮层表面可选用血管的直径和长度。最大的皮层动脉为颞枕动脉,在约三分之二的半球其直径可达1.5mm;最细的是眶额动脉。搭桥手术所需皮层动脉的最小长度约为4mm,几乎每一条皮层表面的动脉平均长度为11.8mm以上,角回、顶后和颞枕动脉在皮层表面最长。Chater发现所有大脑半球的角回区都有一支直径超过1.4mm的皮层动脉。角回区皮层动脉的位置不仅适合于颞浅动脉,也适合于枕动脉进行血管吻合。所以我们认为在进行颅内外动脉血管搭桥术时,可以以外耳道上方6cm为中心,作直径4cm大小的骨瓣开颅,可以较好地显露适合作为搭桥术受体动脉的大脑中动脉皮层支。
典型的大脑中动脉瘤破裂出血的影像学表现为CT平扫发现以单侧侧裂为主的局限性蛛网膜下腔出血。由于分叉部及其以远的大脑中动脉走行于相对狭窄的侧裂内,蛛网膜及小梁结构紧密,动脉瘤体可能部分突入额叶或颞叶表面,MCA动脉瘤一旦破裂出血,还可能在侧裂、额叶及颞叶内形成血肿(图1)。个别患者在影像学特别是CT上甚至可表现为单纯额叶和(或)颞叶自发性血肿而不伴有明显的蛛网膜下腔出血,很容易误诊为高血压性脑出血,应提高警惕,注意鉴别诊断。还有少数患者因破裂出血极其凶猛,CT平扫表现为自发性急性硬膜下血肿形成,伴或不伴有脑内血肿形成,在诊断时应考虑到大脑中动脉瘤的可能性,若疑为MCA动脉瘤,应尽早行3D-CTA,明确诊断,以免带来灾难性后果。
全脑血管DSA造影检查,尤其是3D-DSA,目前仍是大脑中动脉瘤诊断的“金标准”。尽管近年来,随着CT技术的不断进步,CTA越来越广泛地被应用于颅内动脉瘤的诊断。由于其具备无微创、快速、敏感性与DSA接近、可以帮助判断动脉瘤及载瘤动脉钙化斑块情况、并可显示血管与骨性结构之间解剖关系等优点,一些医院已将CTA作为主要的诊断手段。但是,CTA不能提供血流动力学信息以及细小穿支血管等解剖细节,且作为CTA成像关键的容积重建(即VR,volume reconstruction)易受骨质伪影影响,导致漏诊,所以本中心仍然主要选用全脑血管3D-DSA作为大脑中动脉瘤的主要诊断手段。
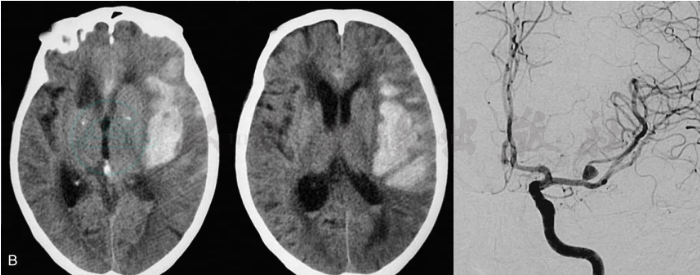
图1 大脑中动脉瘤破裂不同出血方式的CT表现
一、手术入路及技巧
对于大脑中动脉瘤,通常选用标准翼点入路即可满足大部分手术情况的需要。有时遇到巨大动脉瘤或脑内血肿,或者患者临床分级较差、颅内压力很高时,可酌情扩大骨瓣,以利术后可能采用的内外减压。开颅时,强调对蝶骨嵴和所有纵向的骨嵴均应充分磨除,以获得更大暴露,减少强行牵拉,减少动脉瘤提前破裂几率,并可在遇到动脉瘤提前破裂等突发情况时尽快实现血管近心端控制。一些大脑中动脉分叉部大型动脉瘤或远端分支动脉瘤瘤体指向外侧时可能与硬膜粘连,因此,在切开并牵开硬膜时应该格外小心。
前循环颅内动脉瘤手术过程中,如何安全地解剖显露动脉瘤及载瘤动脉是手术成功完成的关键。由浅入深,从侧裂外侧向侧裂池深部、视神经及颈动脉池逐渐解剖、松解、离断蛛网膜及小梁结构,清除蛛网膜下腔积血,耐心释放脑脊液,降低颅内压,获得手术空间是一种暴露动脉瘤常见的手术策略。另外,开颅后抬起额叶,从额叶底部直接到达并打开颈动脉池、视交叉池,迅速释放脑脊液,降低颅压,实现血管近心段控制,根据动脉瘤所在部位再确定蛛网膜与脑池解剖范围,是另一种快速高效的手术方法。两种方法各有优点,手术医师可以根据自己经验选择。
对于大型脑血管病中心少数经验十分丰富的手术医师而言,解剖显露的顺序并不十分重要,他们有足够的信心和技术能力确保手术安全顺利地完成。但是,对于病例积累较为有限的大多数神经外科医师而言,在进行手术夹闭大脑中动脉瘤时,笔者建议根据动脉瘤的部位、指向、大脑中动脉走行以及术中具体情况仔细选择侧裂解剖的部位和顺序。基本原则是:先解剖侧裂浅部动脉瘤颈以远的中动脉周围支以及侧裂底部颈动脉池、视交叉池、鞍上池等,待顺利获得近心端血管控制并降低脑压后,再逐渐沿M1段顺行解剖显露动脉瘤颈及瘤体。
侧裂解剖过程中往往只需要轻柔的牵拉,此时可以使用棉片,或者加上吸引器、双极电凝的轻微拨动就可以满足解剖显露的需要。如果遇到脑水肿或脑肿胀明显等特殊情况,需要使用自动牵开器固定小号脑压板牵拉脑组织,必须注意尽量避免强行牵拉动脉瘤体指向的脑叶。否则可能造成动脉瘤提前破裂。在解剖侧裂的过程中,应注意尽力保持解剖分离界面,避免进入软膜下方。尤其是急性期脑组织水肿明显的情况下,这对于手术顺利进行十分重要。锐性解剖离断和在牵拉时对称地轻柔用力是减少动脉瘤提前破裂的关键。尤其是M1段近端蛛网膜及小梁结构厚实坚韧,数量众多,常常增加解剖的难度,为避免损伤邻近薄壁脆弱的重要动脉分支,细致精确的锐性解剖十分重要,对于辨认困难者,可使用显微剥离子轻柔分离后锐性剪开。当侧裂及颅底脑池满意解剖后,颅压常常明显下降,脑组织整体自然塌陷,只需局部轻柔牵拉,即可进行动脉瘤颈、瘤体及周围相关血管结构的解剖显露,为安全、满意夹闭提供足够空间。尽管根据术者手术能力及熟练程度的不同,夹闭前是否需要完全解剖游离动脉瘤体还存在不同的观点。但总的来看,我们认为完全游离瘤体并不是夹闭动脉瘤所必须之前提,而锐性解剖动脉瘤体基底部粘连或紧邻的动脉分支对于动脉瘤的满意夹闭,减少术后并发症具有更为重要的意义。临时阻断夹的反复使用有利于这一锐性解剖分离过程安全地进行。撤除临时阻断夹之前,应先小心地原位松开阻断夹,观察有无出血后,再决定是否取出。否则,如动脉瘤夹闭不当,则可能发生凶猛出血,严重时甚至难以重新置回临时阻断夹,造成灾难性后果。在瘤颈夹闭后,可解剖游离动脉瘤体,检查瘤夹叶片位置是否满意。应穿刺抽吸或电凝塑形使动脉瘤体塌陷,证实瘤颈夹闭完全,同时要观察确定没有主干或分支动脉被误夹。
大脑中动脉瘤破裂出血,常常伴发脑内血肿形成。若血肿量大,可根据血肿部位在侧裂额侧或颞侧切开皮层清除血肿,如病变在优势半球,需避开Broca区。仅限于部分清除血肿,达到降低颅压、获得操作空间的目的即可。切忌此时试图完全清除血肿,直接从血肿腔暴露并夹闭动脉瘤,否则可能造成难以控制的动脉瘤提前破裂出血。
二、MCA动脉瘤的手术时机
目前,对于颅内动脉瘤的手术时机,一直存在争议,但随着显微技术的日臻完善,防止动脉瘤再次出血已成为治疗的根本目标,因此,大多数研究者认为应尽早(72小时以内)行手术治疗。根据华西医院血管病中心的研究资料,等待手术过程中的动脉瘤再出血造成的患者死亡、残疾成为了影响预后的最主要因素。我们对于接诊的所有颅内动脉瘤患者均在最短时间内行全脑血管造影或CTA,明确诊断后即安排手术治疗。
由于大脑中动脉瘤患者伴发颅内血肿的几率更高,对于颅内血肿造成颅内压显著增高,甚至形成脑疝的患者,应行急诊开颅手术,如此可以在夹闭动脉瘤的同时有效地缓解脑疝危象。
三、手术并发症及应对策略
除与其他部位颅内动脉瘤共有的常见并发症外,大脑中动脉瘤手术后特征性的并发症包括:
1.癫痫
大脑中动脉瘤患者发生癫痫或痫样发作的风险高于其他部位颅内动脉瘤患者。这是通常考虑常规进行术前、术中及术后3~6个月内进行抗癫痫药物治疗的颅内动脉瘤类型。根据本组未发表的资料,大脑中动脉瘤患者癫痫发作的主要危险因素包括:脑梗死、电解质紊乱、术后再出血。
2.由于动脉瘤及出血位置常常不在脑脊液主要循环的区域,故患者脑积水发生的风险并不高。术中反复冲洗置换血性脑脊液,充分清除血肿,终板切开均有利于减少分流术依赖性脑积水的发生率。
3.肢体瘫痪
多与脑内血肿形成、重要穿支血管-豆纹动脉受损缺血有关。
四、血管内治疗
大脑中动脉动脉瘤(middle cerebral artery aneurysms,MCAA)约占全部颅内动脉瘤的20%,动脉瘤破裂后易形成颅内血肿,对患者的预后有较大的影响。国内外很多学者认为MCAA不适合介入治疗是由于其解剖特性决定的,因为MCAA多为宽颈,与重要穿支血管关系紧密。既往在行血管内治疗时,术后并发症较多,另外由于MCAA位于外侧裂内,显微手术入路近,直接手术较容易。但近年来,随着神经介入技术及材料的迅猛发展,特别是支架或者球囊辅助技术的应用,血管内治疗已逐步成为MCAA的重要治疗方法。
1.血管内治疗MCAA的适应证
①动脉瘤体无重要的分支动脉发出;②血管痉挛不严重,微导管能够到位;③动脉瘤腔内无血栓;④若为宽颈动脉瘤,应有安放球囊或支架的条件;⑤微小宽颈动脉瘤,手术无法夹闭者。
2.血管内治疗MCAA的方法与策略
MCA往往以双干或三干的形式分布,解剖复杂,功能重要。因此,血管内治疗大脑中动脉动脉瘤的目的不仅仅是追求致密填塞动脉瘤,还应注意载瘤动脉的重建和分支血管血流的通畅。在进行血管内治疗前,所有患者均需要通过3D-DSA了解动脉瘤的形态、朝向及与载瘤动脉的关系,还应了解动脉瘤体与瘤颈的比值、瘤体是否有重要分支动脉发出,尤其应仔细分析M2段的上干或下干发出早期分支是否累及瘤颈部位。选择最佳的工作角度,制订相应的治疗策略。常用的血管内治疗大脑中动脉动脉瘤的方法如下:
(1)单纯弹簧圈栓塞:主要适用于大脑中动脉非宽颈动脉瘤及瘤体与瘤颈之比大于1的宽颈动脉瘤。仅使用微弹簧圈栓塞动脉瘤,治疗栓塞过程中采用横向成篮、双弯塑形、分部填塞及篮外填塞等技术。首先选用相应直径大小的3D成篮微弹簧圈进行栓塞,然后按由大到小顺序植入弹簧圈,直至动脉瘤致密填塞且不影响大脑中动脉的血供。
(2)球囊辅助技术:对于宽颈囊性MCAA,若为MCA发出M2段分叉部动脉瘤,选用Hyperform球囊,其余则选用Hyperglide球囊。8F指引导管尾端连接2个Y形阀(或四通),先将微导管超选动脉瘤,将球囊导管经另1个Y形阀送入并放置到跨越动脉瘤瘤颈,充盈球囊后从微导管内填塞微弹簧圈,然后抽空球囊,造影证实微弹簧圈稳定后再解脱微弹簧圈,再次充盈球囊继续填塞微弹簧圈直至致密填塞。每次充盈球囊的时间应控制在5分钟内。
球囊辅助技术的优势在于球囊充盈后能很好地勾画出大脑中动脉的管腔,高顺应性球囊可以很好地适应动脉形态,有效保护大脑中动脉的分叉部,辅助弹簧圈充填,使载瘤动脉得以有效的重建。动脉瘤致密栓塞后,球囊撤出,没有异体物质存留,减少了再狭窄的风险。但其不足之处在于球囊充盈后会暂时阻断载瘤动脉的血液供应,时间过长可造成脑缺血性损害,同时可能存在撤出球囊后微弹簧圈移位进入载瘤动脉,导致其闭塞的风险。
(3)支架辅助技术:对于瘤体/瘤颈小于1的宽颈动脉瘤、夹层动脉瘤及梭形动脉瘤需要采用支架辅助弹簧圈栓塞动脉瘤技术。根据动脉瘤颈宽及载瘤动脉的直径选择合适规格的支架,目前主要有三种支架适用于MCA宽颈动脉瘤的治疗,它们分别是Neuroform支架、LEO支架和 Enterprise支架。对于Neuroform支架,将300cm(0.014英寸)的微导丝在路途下超选至大脑中动脉的M2~M3段,在微导丝导引下,将Neuroform支架送至动脉瘤段,造影证实支架远端和近端各超过动脉瘤颈3~5mm,释放支架。按规范将LEO支架或Enterprise支架系统自输送导管尾端推送至输送导管前端,调整好支架位置后,固定输送导丝并缓慢回撤输送导管,使支架释放。
栓塞MCAA的支架植入策略:①“微导管穿越支架(Mesh)”技术:先行支架植入,再通过支架网眼置入微导管入动脉瘤内,根据动脉瘤的大小选择合适弹簧圈进行栓塞,置入微导管时动作必须轻柔,避免支架移位;②“支架稳定微导管(Jailing)”技术:是指在支架输送到位,将微导管超选进入动脉瘤,在应用弹簧圈填塞动脉瘤前将支架释放;③“Y形支架(Y-configuration)”技术:若MCA分叉部的宽颈动脉瘤均等地累及两个分支血管,且位于每一支血管上的部分瘤颈相对动脉瘤体均为宽颈时,单支架往往难以起到充分的保护作用。该技术通过先后释放两枚支架分别保护宽颈动脉瘤累及的两个分支,支架的近端均释放于分叉前且相互重叠,两枚支架在形态上呈“Y形”;④“挽救性支架植入(salvaging stent)”技术:应用单纯弹簧圈栓塞动脉瘤时,发生弹簧圈部分突入载瘤动脉后,应用支架将突出的弹簧圈压入动脉瘤囊内;⑤“单纯支架(alone)”技术:若为微小宽颈动脉瘤,支架植入后无法填入弹簧圈。虽然未能填入弹簧圈,但支架能改变动脉瘤处的血流动力学,有效地减少了动脉瘤出血的机会。
3.常见并发症及处理
(1)动脉瘤破裂出血:常常表现为术中患者血压突然升高,心率加快,造影显示有造影剂外漏。术中需要继续填入弹簧圈,直至造影剂不再外漏。由于大脑中动脉动脉瘤破裂后发生脑实质内血肿比例较高,对患者预后影响较大,常常需要介入栓塞术后清除血肿。
(2)脑血管痉挛:血管内治疗中发生血管痉挛,主要与蛛网膜下腔出血分解产物及术中微导管、微导丝及弹簧圈对血管壁的机械刺激有关。对于脑血管痉挛的预防,术中需要持续输注尼膜同,同时术者轻柔操作可以有效减少对血管的机械刺激。
(3)脑梗死:主要由于微弹簧圈突出或者移位至载瘤动脉、动脉瘤腔内血栓脱落、支架处血栓形成及动脉瘤周围重要穿支的闭塞。因此,栓塞前必须详细了解瘤腔有无血栓、瘤周重要的血管结构及瘤体/瘤颈的比值,严格掌握适应证。球囊暂时阻断载瘤动脉的时间不宜超过5分钟。栓塞术中应全身肝素化,支架植入术后严格抗血小板治疗。
4.大脑中动脉动脉瘤的残留和复发
部分患者未能完全栓塞动脉瘤,其原因多为保留动脉瘤周围分支的需要或者单纯弹簧圈栓塞时为防止微弹簧圈突入载瘤动脉,致动脉瘤闭塞不全球囊或支架辅助技术能大大提高动脉瘤的有效填塞率。动脉瘤致密填塞后,仍有部分患者可能复发,多由于大脑中动脉是颈内动脉的直接延续,血流量大,血流的长期冲击可能导致微弹簧圈压缩。动脉瘤复发后需要再次血管内治疗或手术处理。













