卵巢浆液性肿瘤(serous tumors of ovary)在卵巢上皮性肿瘤中最为常见,构成比约占全部卵巢肿瘤的25%。其特点为可见囊性肿物,直径1~20cm;单房性多见,也可多房。囊液多清晰、草黄色、浆液性,偶可混浊,甚至带有血性。生长方式和形态变化较多,特别是乳头状生长较多,且方式多样化。双侧性较其他类型上皮性肿瘤多见,肿瘤内镜下常可找到砂粒体(psammoma mies)。组织类型在良性及交界性肿瘤中可分为浆液性囊腺瘤(serous cystadenoma)、乳头状囊腺瘤(papillary cystadenoma)、表层乳头状瘤(surface papilloma)、腺纤维瘤(adenofibroma)及囊性腺纤维瘤(cystadenofibroma)。恶性肿瘤中可分为腺癌(adenocarcinoma)、乳头状腺癌(papillary adenocarcinoma)、表层乳头状腺癌(surface papillary adenocarcinoma)、腺癌纤维瘤(adenocarcino fibroma)及囊腺癌纤维瘤(cyst adenocarcinofibroma)。
1.直接扩散
浆液性乳头状囊腺癌直接蔓延扩散的机会较多,如腹膜、腹腔壁腹膜及腹腔脏器的腹膜,包括横膈、大网膜、小肠、直肠、直肠子宫陷凹、结肠、膀胱反折腹膜,以及输卵管和子宫的浆膜层等。约有2/3的患者合并腹水,因而引起的症状已如前述,有的患者可能无任何不适,仅仅感觉腹围增大。有无合并腹水与预后非常相关,近期报道Ⅲ及Ⅳ期卵巢癌无腹水的5年生存率较有腹水者可高出5倍。腹水的形成与淋巴管阻塞(主要是右侧横膈淋巴管)、腹膜受刺激,以及腹腔内液体流动不平衡等有关。癌细胞不仅可随液体流动而种植,而且腹壁穿刺放腹水的部位可出现穿刺部位癌瘤生长,形成皮下小结节或团块。有的患者因腹水误诊为结核性腹膜炎和肝硬化,在穿刺部位发生癌种植包块尚未能引起警惕。
2.淋巴转移
淋巴转移以卵巢浆液性乳头状癌发生率最高,较黏液性癌高。病理分级似影响不大,而临床分期有腹膜后淋巴结转移者即属ⅢC期。盆腔淋巴结与腹主动脉旁淋巴结的转移率相似,Di Re等报道分别为29.0%及22.5%。横膈转移除直接种植外,也受淋巴引流阻塞的影响,局限于盆腔的卵巢癌横膈转移率为57%,超出盆腔时则达77%;有横膈转移者84.4%有盆腔淋巴结转移,而腹膜后淋巴结转移者55.9%有横膈转移。Petru进行37例左锁骨上淋巴结活检,仅1例临床可触及,其中32例为Ⅲ及Ⅳ期,Ⅲ期阳性率12%,Ⅳ期57%。
3.血行扩散
血行扩散过去认为肺及肝实质转移不多,但近期报道也非罕见,甚至手术、化疗至一定时间也有又出现转移者。1995年Geisler报道脑转移的发生率为3.3%。阴道转移发生较少。北京大学人民医院妇科肿瘤中心曾收治过卵巢浆液性乳头状癌患者,由外院转来时已行子宫及附件切除,入院后发现阴道断端有菜花状组织,病理证实为卵巢浆液性乳头状腺癌转移,也有可能系手术时癌细胞脱落种植形成。
浆液性癌为米勒管型上皮的恶性肿瘤,其癌细胞常以形成囊腔和乳头为特征,但或多或少仍保留原来的组织形态。有的肿瘤形成大且不规则的小囊腔,有时上皮突入腔内形成上皮簇或乳头(图9-19-8)。
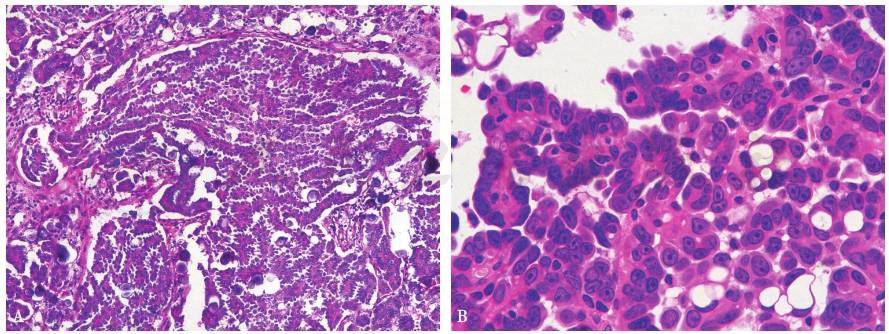
图1 卵巢浆液性癌
A.低级别浆液性癌;B.高级别浆液性癌。
根据患者的临床特征、肿瘤生物学行为以及分子通路的不同,2014年WHO将SOC分为Ⅰ型和Ⅱ型:Ⅰ型即低级别浆液性卵巢癌(low-grade serous ovarian carcinoma,LGSOC),Ⅱ型为高级别浆液性卵巢癌(high-grade serous ovarian carcinoma,HGSOC)。LGSOC和HGSOC具有不同的形态学类型,分级主要是基于核异型性和核分裂指数:轻到中度异型性,每10个高倍镜下≤12个核分裂,诊断为LGSOC;具有明显核异型性,每10个HPF>12个核分裂,诊断为HGSOC。
LGSOC占浆液性卵巢癌的6%~10%,其发病通常比HGSOC年轻10岁左右,中位年龄为43~55岁,常继发于浆液性交界性肿瘤,临床预后较好,5年生存率高于HGSOC,但往往对初始化疗耐药。LGSOC其存在较高的BRAF(0~33%,平均5%)和KRAS(19%~55%)基因突变,很少TP53突变。免疫组织化学显示较高的雌、孕激素受体表达,推测其发病机制与女性激素有关。
HGSOC则在浆液性卵巢癌中的占比接近90%,肿瘤生物学行为多具侵袭性,预后明显差于LGSOC,导致的死亡则占到所有卵巢癌相关死亡的2/ 3。分子生物学研究显示其多TP53突变,很少Ras基因突变。在所有亚型当中,高级别内膜样癌和高级别浆液性癌分子改变相似。
手术治疗是上皮性卵巢癌最主要的治疗手段,治疗原则遵循早期患者的全面分期手术和晚期患者的减瘤术。根据FIGO的手术病理分期,结合患者的年龄和对生育要求来决定手术方式。早期患者,即FIGO Ⅰ期患者建议行全面分期手术,包括:子宫全切、双侧附件切除术+大网膜切除术+阑尾切除术+盆腔及腹主动脉旁淋巴结切除术+腹膜活检及腹腔冲洗液的细胞学检查。由于LGSOC发病具有年轻化倾向,对于希望保留生育功能的女性可以考虑保留生育功能,通常适用于年龄<40岁、手术病理证实为早期(ⅠA期G1/G2和ⅠC期G1)的患者。标准的手术包括单侧输卵管卵巢切除术,腹腔冲洗液细胞学检查,切除所有可疑或粘连的腹膜病变,腹膜多点活检,大网膜切除术和盆腔及腹主动脉旁淋巴结切除术。在卵巢癌的分期手术中,应合理运用微创治疗,警惕医源性囊肿破裂风险,需要在具有一定技术条件的医疗机构由妇科肿瘤专业医师实施。
减瘤术适用于广泛扩散的晚期肿瘤患者,可根据患者病变累及范围及患者一般情况进行个体化治疗,并可结合辅助化疗灵活采用:初始减瘤术、间歇性减瘤术、再次减瘤术。初治的Ⅱ~Ⅳ期患者应最大限度地实现肿瘤细胞减灭,即初次肿瘤细胞减灭术(primary cytoreductive surgery),术后残留病灶大小是影响患者生存的最重要因素,最理想的结果是达到无肉眼残留病灶(R0)。对于Ⅲ期和Ⅳ期的患者不需要细胞学的评估,但所有腹膜表面,包括膈面、盆腹腔器官的浆膜面、整个胃肠道的系膜均应当仔细检查有无种植病灶,并应仔细检查大网膜并切除大网膜。一部分晚期患者会有上腹部大块的肿瘤转移灶,如果需要,可进行脾切除、胰尾切除、肝切除及门静脉部位的病灶切除、胆囊切除、全结肠切除、盆腔腹膜切除及膈面病灶去除,以获得满意的肿瘤细胞减灭术。最近有研究显示,手术技术改善对于Ⅳ期患者进行上腹部根治性手术并达到满意的肿瘤细胞减灭术后可以提高患者的生存率。在卵巢癌几项预后因素中,残存病灶大小是唯一可以通过医者的能力而改善争取的。但值得注意的是,应尽量避免手术并发症,以免影响患者的术后化疗,因为手术后化疗的敏感与否是最重要的预后因素。
初次手术后的辅助治疗取决于手术病理分期,组织学分级。ⅠA~ⅠB期LGSOC可术后观察。ⅠC期患者根据其术中情况和病理类型个体化治疗,酌情给予辅助治疗,Ⅱ期及以上患者术后采用6个周期的卡铂/紫杉醇辅助化疗。目前,铂类药物+紫杉醇(如:紫杉醇/卡铂,TC方案)的联合应用是临床治疗EOC的标准化疗方案。经过满意的肿瘤细胞减灭术和6~8个疗程的一线化疗,许多晚期患者能达到完全缓解,但其中仍会有3/4的患者复发。
复发患者可采用再次肿瘤细胞减灭术(secondary cytoreductive surgery,SCRS)。孤立的肝转移、腹腔外转移(包括肺转移、脑转移)也可以通过再次手术获益。对于一些复发或晚期不能通过手术达到减瘤术效果的患者,必要时可采用辅助性姑息手术治疗,包括一些辅助性手术,如缓解大量胸腹水的胸、腹腔穿刺术/置管术,缓解泌尿系统梗阻的输尿管支架放置或肾造瘘术,缓解肠梗阻的胃、肠造瘘术等。
对于部分晚期卵巢EOC,在术前评估时考虑手术难以切除,或难以达到满意的肿瘤细胞减灭术后,可以考虑新辅助化疗(neoadjuvant chemotherapy,NACT)。NACT指在经细胞学或组织学诊断后,对于难以完成满意的肿瘤细胞减灭术的患者应用化疗。这一过程最早在1979年应用于耶鲁大学。在Bristow等的荟萃分析中包括了6885例晚期卵巢癌患者,仅42%达到了满意的肿瘤细胞减灭术,仅有少数患者达到肉眼无残留。一项GOG试验也显示在Ⅲ期患者中只有23%的患者和Ⅳ期患者中只有8%的患者能达到肉眼无残留。NACT能显著提高肿瘤切除率,降低手术并发症。Kang和Nam荟萃21项研究,得出NACT更能获得满意的肿瘤细胞减灭术率,似乎增加中位生存时间,但差异并不显著的结论。为降低初治患者的复发,或治疗反复复发的患者,维持治疗一直在探索中,近年来靶向治疗与抗血管治疗取得的进展使其成为EOC治疗的重要一环。聚腺苷酸二磷酸核糖基聚合酶(PARP)主要通过碱基切除修复途径在DNA单链断裂修复中发挥作用,同时BRCA1/2在DNA修复双链断裂中起重要作用,BRCA1/2和其他同源重组HRR(homologous recombination,HRR)相关基因突变或失活会引起同源重组缺陷(homologous recombination deficiency,HRD),导致DNA双链断裂无法修复,这类患者应用PARP抑制剂(PARPi)可致DNA单链断裂、双链断裂均无法修复,存在“合成致死”效应。多项大型研究,包括一线维持治疗:SOLO-1、PRIMA、PAOLA-1、VELLA和复发患者治疗:SOLO-2、NOVA、ARIEL-3,其结果均表明晚期EOC患者采用PARPi可明显获益。目前中国抗癌协会妇科肿瘤专业委员会制订的中国卵巢上皮性癌维持治疗专家共识(2020版)对EOC患者临床推荐初治手术后即取肿瘤组织进行胚系和体细胞BRCA1/2检测,有条件进行HRD检测,根据检测结果,选择PARP抑制剂(PARPi)用于晚期EOC的初始治疗后和铂化疗敏感患者复发后的维持治疗。
此外,抗血管生成药物贝伐珠单抗用于复发性LGSOC显示有一定疗效。但其有效性尚缺乏临床获益证据;仅MEKi(曲美替尼)推荐用于复发性LGSOC的治疗。在允许的情况下应进行分子测序获得体细胞突变谱,以便能确定最佳治疗靶点。
初治及复发LGSOC对化疗反应率低,ⅠC期和Ⅱ~Ⅲ期LGSOC患者术后均可选择内分泌治疗,包括阿那曲唑、来曲唑、依西美坦、亮丙瑞林和他莫昔芬等维持激素治疗(maintenance hormonal therapy,MHT),但其疗效尚期待大规模研究。
此外,EOC患者应进行严密的术后随访,尤其动态监测血清CA125水平可作为病情监测的肿瘤标志物。并鼓励患者积极参与临床试验。













