英文名称 :carcinoma of cardia;cardiac cancer
贲门癌的发生发展过程涉及多种等位基因的获得或缺失、抑癌基因甲基化以及许多基因和蛋白表达的改变,但其发病机制仍不清楚。病因可能与下列因素相关:幽门螺杆菌感染;亚硝基化合物盐硝酸盐的摄入;二羰基化合物;真菌;遗传性。
在日本,有文献认为其食管-胃结合部癌呈下降趋势,也有文献报道其食管腺癌发病率稳定,但贲门癌发病率上升。在我国林县食管癌和贲门癌患者中,60%为食管鳞癌,40%为食管腺癌和贲门癌。中国、日本、伊朗,其食管癌病理类型以鳞癌为主,在这些地区,食管-胃结合部腺癌的发病率并不像西方国家那样呈现明显上升趋势,这也说明在贲门癌的发病因素中除环境因素外,遗传因素也起着重要作用。
贲门癌的发病因素至今尚不十分明确,甚至不同学者得出相反的结论,其危险因素有Barrett食管和食管反流性疾病。目前,人们普遍接受的观点是食管-胃反流性疾病引起Barrett食管,而大多数食管腺癌由Barrett食管发展而来,其机制为正常黏膜的肠上皮化生,发展为低度的发育不良,再到高度的发育不良,最后发展为癌。食管-胃结合部腺癌发生率的提高同食管-胃反流性疾病的发生率增加相平行。反复发生胃-食管反流症状(每次至少1次)者其发生贲门癌的机会是无反流症状人群的2倍,如果发生持续严重反流症状,则此机会增加到4.4倍。肥胖和食管裂孔疝常伴有食管-胃反流,这可能与食管-胃结合部癌相关联。
1.肠上皮化生
尽管有许多证据表明Barrett食管和Ⅰ型贲门癌之间有明确的因果关系,肠上皮化生是食管腺癌的癌前病变,但其在Ⅱ型、Ⅲ型贲门癌发生、发展中的作用尚无明确定论。有限的资料表明,贲门黏膜由肠上皮化生发展为腺癌,有不少证据表明在贲门癌或食管-胃结合部腺癌附近黏膜有肠上皮化生。
2.幽门螺杆菌
与幽门螺杆菌有关的胃炎是远端胃癌的重要危险因素,幽门螺杆菌感染能引起慢性胃炎,慢性胃炎可引起萎缩性胃炎、肠上皮化生,进而引起腺癌。但幽门螺杆菌在食管-胃结合部腺癌发生、发展中的作用不是很明确,Chow报告幽门螺杆菌感染能使贲门腺癌发生的危险性降低60%,但也有相反结论的报道。Goldblum通过活检及血清学检测证实贲门肠上皮化生和幽门螺杆菌引起的贲门癌之间有重要联系。
3.食管下段括约肌松弛剂
1957~1986年,在美国随着食管下段括约肌松弛剂购买及使用的增多,食管胸下段及食管-胃结合部腺癌的发生率也相应增加。这些药物包括硝酸甘油、抗胆碱能药、β肾上腺素能激动剂、氨茶碱、苯二氮卓类药药、钙拮抗剂等,这些药物均能加重胃-食管反流。
4.吸烟
大样本的病例对照研究表明,吸食烟草能增加食管及贲门癌的发生率,此风险性能增加1倍以上并且呈剂量效应关系。在停止吸食烟草后30年此危险性仍然存在,可能是在贲门癌早期诱导阶段起作用。
5.肥胖
肥胖不仅增加贲门癌的死亡率,且能增加贲门发生癌变的概率,这可能是由于肥胖能增加胃-食管反流及食管裂孔疝的机会所致,也有可能是肥胖是贲门癌的危险因素且与反流无关。
6.饮食
碳水化合物和脂肪进食过多以及蔬菜、水果进食过少均能增加贲门癌的发病率,膳食纤维、叶黄素、维生素B6、铁、锌的较多摄入有助于降低贲门癌的发病率。抗氧化剂,如维生素C、β胡萝卜素、α-生育酚能中和自由基的DNA损伤作用,减少贲门癌的患病机会。从饮食中摄取的硝酸盐形成的亚硝酸化合物β-氢化氮在贲门处聚集最多,这提示硝酸盐在食管癌和贲门癌中的发病危险性,后者更大。膳食纤维可能是通过清除贲门处的硝酸盐而发挥降低贲门癌发生的作用。
自20世纪中期以来,贲门癌的发病率在美国和绝大多数西方国家快速上升。在美国,胃癌的50%发生于贲门,即贲门癌发病已占胃癌发病的一半,贲门癌发病率的上升主要是由于中年白人男性的发病率上升所致。贲门癌主要发生在50岁以上人群,低于65岁人群贲门癌发病率增加了20%,在65岁以上人群中贲门癌提高了1/4~1/3。男性贲门癌发病率由1955~1959年的0.6例/100 000人,上升至1985~1989年的3例/100 000人,男女发病率比为2.5∶1~8∶1。女性及非洲裔美国人(无论性别)患贲门癌的危险性低于白人男性,黑人贲门癌的发病率只有白人发病率的30%。在欧洲,如丹麦、英国、瑞士、瑞典、挪威,贲门癌的发病率在最近几十年也呈上升趋势。
1.贲门癌的分型
(1)食管胃连接部腺癌:
穿过食管胃连接部的腺癌,不管肿瘤主体在何处。
(2)食管腺癌:
全部位于食管胃交界上方并局限在其上方的腺癌。
(3)胃腺癌:
全部位于食管胃交界下方的腺癌。
2.贲门癌TNM分期中T、N、M的定义(AJCC 2002)
(1)T分期标准—原发肿瘤。
Tx:原发肿瘤不能确定。
To:无原发肿瘤证据。
Tis:原位癌。
T1:肿瘤侵犯黏膜固有层、黏膜肌层或黏膜下层。
T2:肿瘤侵犯肌层。
T2a:肿瘤侵犯肌肉层。
T2b:肿瘤侵犯浆膜下层。
T3:肿瘤侵犯出浆膜层未侵犯其他结构。
T4:肿瘤侵犯周围结构及邻近脏器。
(2)N分期标准—区域淋巴结。
Nx:区域淋巴结转移不能确定。
NO:无区域淋巴结转移。
N1:l~6枚区域淋巴结转移。
N2:7~15枚区域淋巴结转移。
N3:≥15枚区域淋巴结转移。
注:必须将转移淋巴结数目与清扫淋巴结总数一并记录。
(3)M分期标准—远处转移。
M0:无远处转移。
M1:有远处转移。
(4)G分期标准—肿瘤分化程度。
Gx:分化程度不能确定。
Gl:高分化癌。
G2:中分化癌。
G3:低分化癌。
G4:未分化癌。
3.贲门癌的国际TNM分期(AJCC 2002)
见表1。
表1 贲门腺癌TNM分期
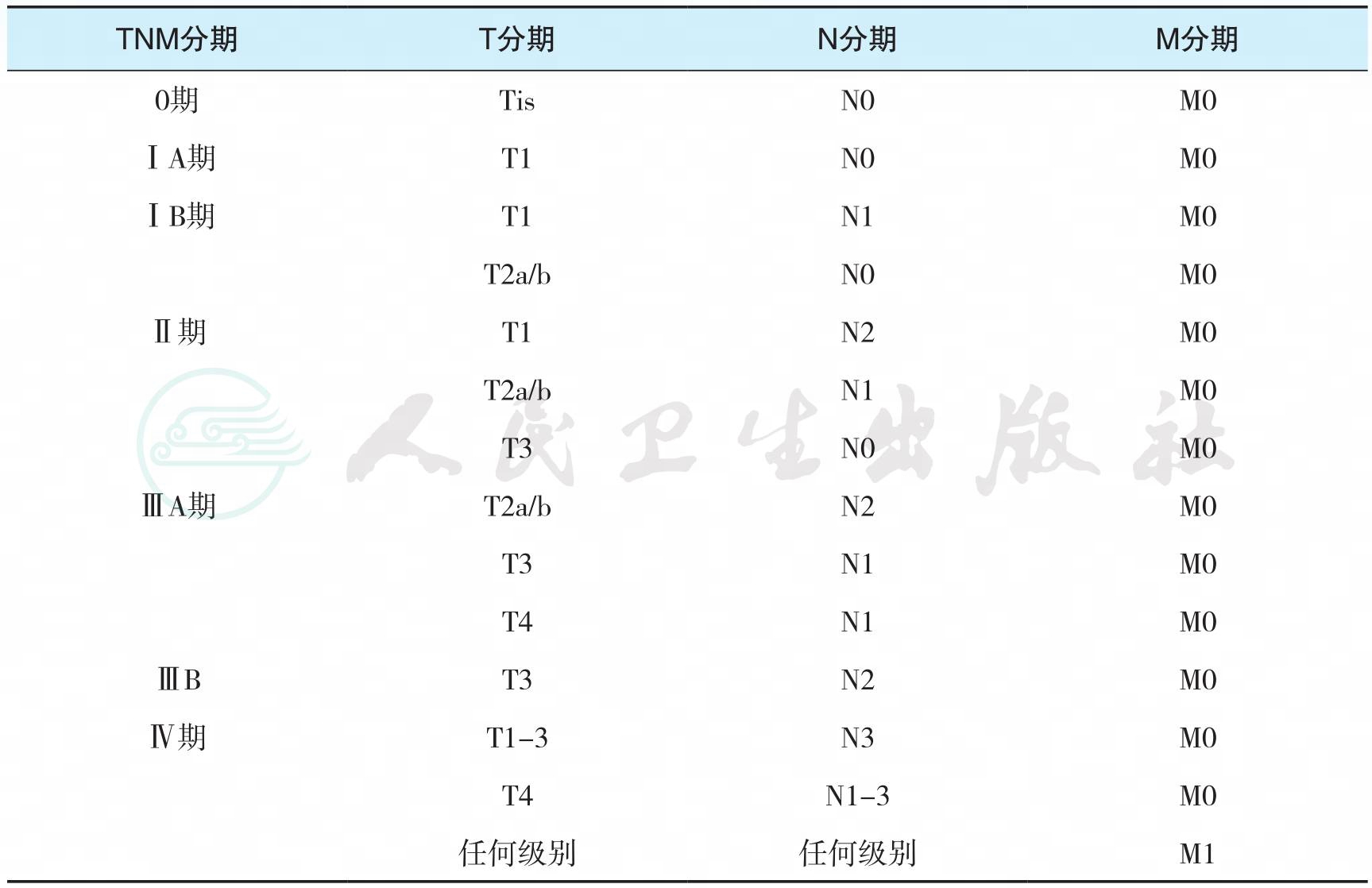
注:肿瘤部位按肿瘤上缘在食管的位置界定;X指未记载肿瘤部位
贲门癌好发于贲门部小弯侧,约占全部病例的3/4,其次是贲门后壁和前壁,大弯侧较小,由于早期贲门癌症状较轻,缺乏特征性,因此贲门癌发现时往往为中晚期。早期贲门癌和进展期贲门癌的肉眼形态和组织学类型各有不同。
一、早期贲门癌
早期贲门癌是指癌组织未侵及肌层且无淋巴结转移的早期病变。其大体形态表现为:①病变处黏膜呈现糜烂状改变,表面粗糙;②病变处黏膜表现为不规则形的粗糙增厚,失去正常光泽;③病变处黏膜外观基本正常,仅表现为轻度充血,表面略粗糙;④病变已形成圆丘状或乳头状肿块。根据早期贲门癌的大体形态表现及特点,我国病理学家将其分为3种类型:①隆起型:癌变处的贲门黏膜呈不规则增厚,表面粗糙,轻微隆起;②凹陷型:病变处贲门黏膜不规则,轻微凹陷,犹如糜烂或浅溃疡;③隐伏型:病变处黏膜无明显变化或仅表现略微粗糙,颜色略深。日本则按胃癌分型方法,将早期贲门癌分为:Ⅰ型(隆起型):病变形成丘形或乳头状隆起。Ⅱ型(浅表型):病变比较平坦,不形成明显的隆起或凹陷。此型又分为3个亚型:a,浅表隆起型;b,浅表平坦型;c,浅表凹陷型。Ⅲ型(凹陷型):病变较周围黏膜明显凹陷。
早期贲门癌组织学分为腺癌和黏液腺癌两大类,按照病变进展程度,分为3类:
1. 原位腺癌 理论上讲,贲门癌有原位癌变,但因发病早,很少能作出诊断,是指贲门黏膜上皮及贲门腺已显示了明显的恶性改变,但仍限于腺上皮基底膜上方,为早期贲门癌的最早阶段。
2. 黏膜内癌 癌组织仅限于黏膜肌层。
3. 黏膜下癌 癌组织发生于贲门黏膜层并累及黏膜下层,但未累及肌层。
二、进展期贲门癌
(一)大体分型
国际上多数学者采用胃癌的Borrmana分型,将贲门癌分为:
Ⅰ型(隆起型):肿瘤主要向腔内生长,形成凸起的肿物,肿瘤的边缘均比较规则,瘤体一般较大,表面有深浅不等的溃疡。
Ⅱ型(局限溃疡型):肿瘤形成较深的溃疡,边界清楚,溃疡与周围组织之间的界限较为局限。溃疡边缘癌组织向上隆起,有的呈“围堤”状。
Ⅲ型(浸润溃疡型):肿瘤向贲门上、下方呈浸润性生长,与周围组织界限不清楚。肿瘤表面形成深浅不等的溃疡,而溃疡边缘肿瘤组织隆起往往不明显,周围黏膜呈放射状收缩。
Ⅳ型(弥漫浸润型):癌组织在贲门壁内呈浸润性生长,浸润部贲门壁增厚变硬,皱襞消失,黏膜变平,有时伴浅溃疡。
我国学者李凌等将进展期贲门癌分为隆起型、局限溃疡型、浸润溃疡型、浸润型,并认为其分型与贲门癌组织学类型及患者预后有一定关系。隆起型和局限溃疡型中,组织学类型多为高分化腺癌和高分化黏液腺癌;浸润溃疡型贲门癌中,低分化腺癌和低分化黏液腺癌所占比例增加;而在浸润型中这两种组织类型比例更大。
(二)贲门癌组织学类型
目前临床上常将贲门癌分为以下几种组织学类型:管状腺癌、黏液腺癌、乳头状癌、印戒细胞癌、腺鳞癌、鳞癌、未分化癌、类癌及癌肉瘤。其中管状腺癌最常见,贲门鳞癌及癌肉瘤罕见。
进展期贲门腺癌的组织学分级:
Ⅰ级:癌细胞分化很好。
Ⅱ级:癌细胞呈中度分化。
Ⅲ级:癌细胞分化程度差。
Ⅳ级:癌细胞未分化。
(三)贲门癌扩散和转移途径
1. 直接侵犯
贲门癌直接向上可侵及食管下段达食管中段,向下沿胃底及胃小弯侧呈浸润性生长,可累及超过胃小弯1/2以上,其全胃呈“皮革胃”,向管腔外生长可累及膈食管裂孔区、肝胃韧带、肝左叶、胰脾、脾门以及其他腹膜后结构。
2. 种植性转移
贲门癌侵透浆膜可伴癌细胞脱落而出现腹腔种植,导致腹膜、胃网膜、肠壁及盆腔等部位的种植性转移,严重时可出现癌性腹腔积液。
3. 淋巴道转移
贲门壁各层均有丰富的淋巴引流网,并与食管的淋巴网交通,这些淋巴管网汇集成许多贲门壁外淋巴管,向下引流至腹腔丛或向上进入纵隔。有学者通过淋巴造影技术发现贲门存在3条淋巴引流系统:①升干:沿食管壁上行至纵隔淋巴管(结)。②右干:从胃小弯沿胃左动脉和贲门食管支到腹腔动脉旁淋巴管(结)。③左干:从胃后壁沿胃大弯和胰腺上缘到后腹膜淋巴管(结),左干又分为3条径路:a,从大弯沿胃短动脉、脾门和脾动脉到腹腔动脉旁淋巴结;b,后胃支:从胃后壁沿食管-胃后升支在胰腺上缘加入脾动脉系统淋巴管(结);c,膈支:从贲门左沿左膈下动脉贲门食管支直接注入主动脉旁淋巴管(结)。
以上淋巴管沿途有许多淋巴结,在临床上贲门癌淋巴结转移的常见部位是:第一站淋巴结:贲门旁淋巴结、食管下段旁淋巴结及胃小弯淋巴结;第二站淋巴结:胃左动脉旁淋巴结、脾门淋巴结和胃网膜淋巴结。后期可发生远处淋巴结转移,例如腹主动脉旁淋巴结、肝门区淋巴结、上纵隔淋巴结及锁骨上淋巴结。
(四)血行转移
贲门癌血行转移多发生于肝、肺、脑、肾、肾上腺、子宫、卵巢、骨及皮肤等器官。往往通过以下两种途径:①癌细胞通过胃的静脉到门静脉入肝,再经肝静脉、下腔静脉、右心入肺,然后进入体循环,此为贲门癌血行转移的主要途径;②癌细胞不经过肝而通过器官之间的静脉短路直接进入肺循环或体循环,例如贲门的癌细胞通过胃左静脉的贲门食管支进入食管下段静脉丛,可与奇静脉、半奇静脉交通,经上腔静脉进入心脏,也可经左下肺韧带与左下肺静脉交通入肺,但贲门癌通过此途径发生血行转移的机会远低于第一种途径。
1.常规检查
(1)血液检查:
贫血常见,约50%有缺铁性贫血,是长期失血所致;或由营养缺乏造成如合并有恶性贫血,则见巨幼细胞贫血;血沉增快。
(2)胃液检查:
约有40%~60%患者胃内无游离酸,乳酸试验阳性;癌组织有溃烂坏死时,胃液可找到癌细胞。
(3)粪便隐血试验:
粪便隐血试验常呈持续阳性。可作为胃癌筛检的首选方法。
2.肿瘤标志物检测
目前临床所用胃癌标志物主要有CEA、CA19-9等,但特异性均不强,联合检测可增加其灵敏性及特异性。
(1)CEA:
癌胚抗原,是一种富含多糖的蛋白复合物,是胚胎和胎儿期产生的癌胚抗原,对胃癌的预后具有意义,与进展低分化腺癌相关,亦与肿瘤大小、浆膜面浸润、淋巴结转移相关,可与其他指标联合应用以评价的化疗疗效,如CEA水平下降范围>50%或降至正常范围并持续4周以上,可作为治疗有效指标,如治疗后持续增高,提示预后不良。
(2)CA19-9(可选择):
是一类含黏液成分的大分子糖蛋白,与肿瘤大小、淋巴结转移及浸润深度相关,是胃癌患者独立判定预后的指标,血清中高水平的CA19-9提示胃癌患者生存期缩短,可与其他指标联合应用提示胃癌的腹膜复发、腹腔种植,是比CEA更为敏感的指标。
3.影像学检查
基本检查技术及诊断。
(1)胸部X线检查:
目的是除外肺部转移,依患者经济条件可行胸部及上腹部CT检查。
(2)上消化道造影检查:
可作为胃癌诊断首选常规检查,有助于观察肿瘤在胃腔内浸润范围、肿块部位及胃腔狭窄程度、有无幽门梗阻等,并可通过观察胃黏膜的形态、胃壁的柔软程度等,有助于与胃炎性病变、胃壁良性病变及胃淋巴瘤等相鉴别。
(3)超声检查:
可作为贲门癌患者的常规检查,主要用于发现腹盆腔重要器官及淋巴结有无转移,也可用于锁骨上、颈部淋巴结检查。
(4)CT检查:
CT检查已广泛应用于临床,有助于观察贲门肿瘤对胃壁的浸润深度、与周围脏器的关系、有无淋巴结转移和远处转移(如肝脏、卵巢、腹膜、网膜等)。对于贲门肿瘤较大者,建议行腹部、盆腔CT检查,以了解盆腔有无转移,特别是对于女性患者,观察有无卵巢转移。对于无CT造影剂过敏的患者,原则上均应行增强CT扫描,有助于检出微小转移灶。
(5)MRI检查:
对于超声或CT检查怀疑肝脏转移的患者,MRI有助于明确诊断。
(6)骨扫描:
有助于骨转移诊断,依据临床需求合理选择。
4.腔镜检查
内镜检查:是胃癌诊断中最重要的手段之一,对于胃癌的定性定位诊断和手术方案的选择有重要的作用。对拟行手术治疗的患者为必需的常规检查项目。提高胃癌的发现率,是现阶段降低胃癌死亡率的重要手段之一。
5.细胞学检查
(1)内镜细胞学检查:
在纤维镜直视下,用冲洗,擦刷及印片3种方法取细胞,其阳性率较高,或插入胃管用缓冲液反复冲洗胃壁,再收集缓冲液,沉渣后作涂片进行细胞学检查。
(2)腹水细胞学或术中腹腔冲洗或灌洗细胞学:
可明确是否存在腹腔游离癌细胞(FCC),对指导临床分期具有重要意义。
(3)穿刺细胞学检查:
对锁骨上淋巴结转移明确诊断。
(一)外科手术治疗
1.手术适应证
0、Ⅰ、Ⅱ期和部分Ⅲ期中的T3N1M0和部分T4N1M0;放疗后复发的贲门癌无远处转移或无局部明显外侵,一般情况能耐受手术者;全身情况良好,有较好的心、肺功能储备;对估计切除可能性不大而患者全身情况好,可先采用术前放、化疗,待瘤体缩小后再作手术。
2.外科手术禁忌证
Ⅳ期及部分Ⅲ期贲门癌(侵及主动脉的T4病变);心肺功能差或合并其他重要器官系统严重疾病,不能耐受手术者。
3.术前检查
食管钡餐造影,胸部CT,电子胃镜及病理确诊报告,腹部脏器B超,肺功能,心电图,心脏超声,血常规,尿常规,便常规,肝功能,生化,术前八项,血凝分析,血型。
4.术前准备
术前禁食水8小时,术日晨下胃管温盐水冲洗食管并保留胃管,术前30分钟抗生素应用。
5.手术原则
彻底切除肿瘤和所属周围淋巴结。断端应至少在肿瘤上、下5~8cm。要求最大限度的保留消化功能。
6.手术方法
(1)经腹贲门癌切除胃食管吻合术。
(2)经胸贲门癌切除胃食管吻合术。
(3)全胃切除术。
(4)姑息减状手术,适用于晚期肿瘤不宜手术切除者,主要解决患者进食、再化疗或放疗。主要术式有食管-胃侧侧转流吻合术、食管腔内支架术、胃或空肠造瘘术。
(二)放射治疗
单纯放疗法用于手术治疗难度大或患者不愿手术治疗可选择放疗;术前放疗可增加贲门癌切除率;术后放疗主要针对手术未能切除干净原发灶或癌组织已侵犯邻近器官不能彻底切除。一般术后3-6周开始进行三维适形放疗技术。
(三)化学治疗
分为姑息性化疗;新辅助化疗(术前);辅助化疗(术后)。治疗方案规范化和个体化,化疗和手术治疗相结合或与放疗相结合。
(四)放化疗相结合
局部晚期贲门癌患者联合放化疗。
(一)术前沟通
1.在术前已完成贲门癌患者与诊断相关以及术前所需各项化验、检查后,要向患者本人或患者直系亲属说明所获得的诊断结果以及疾病分期。
2.介绍关于贲门癌目前国内外的治疗方式,对本例患者拟采用的手术方案(微创手术或开胸手术)具体名称及理由。
(二)关于手术的沟通
1.说明诊断和病理分期后,说明要实施的手术名称,这种术式的优缺点。
2.要具体说明手术风险:①麻醉意外;②神经血管损伤;③周围脏器损伤;④术中出血;⑤肿物无法彻底切除或切除范围扩大;⑥使用特殊器械及材料;⑦呼吸功能、循环功能及肾衰竭转至重症监护病房抢救治疗;⑧出现其他意外情况。
术后可能出现的风险:①术后出血需二次手术;②肺部感染及肺不张;③气胸、血胸及脓胸;④吻合口瘘或胃肠排空功能障碍;⑤肺功能衰竭;⑥切口不愈合或难以愈合;⑦呼吸功能、循环功能及肾衰竭转至重症监护病房抢救治疗;⑧肿瘤复发及转移;⑨出现其他意外情况。
(三)关于治疗过程的沟通
1.基本明确贲门癌诊断及分期后,说明因术式不同,所使用的特殊器械及材料也不相同,费用也部分差距,应根据患者的实际情况及负担能力,在术前明确说明。
2.术后禁食水期间需要肠外营养,花费较高,如出现消化道排空障碍甚至吻合口瘘则禁食水时间相应延长,做好心理准备。
3.术后可能出现反流等情况,如必要可给予半卧位睡眠。
4.对出院时胸腔有少量积液的患者要酌情缩短复诊间隔时间,及时掌握胸腔积液的变化情况。
(四)关于术者及麻醉配合的沟通
1.明确告知担当本次手术的术者及助手姓名、职称,以取得患者或其直系亲属的认可。
2.原则性说明因疾病的特殊性与麻醉相关药物(吗啡、镇静剂及肌肉松弛剂等)限制在手术中被加大的麻醉风险。
3.手术创伤较大术后心肺功能欠佳转入重症监护室可能。













