英文名称 :systemic vasculitis
血管炎 (vasculitis)是以血管的炎症与破坏为主要病理改变的一组异质性疾病,其临床表现因受累血管的类型、大小、部位及病理特点不同而表现各异。由于常见的血管炎多引起系统损害,故又称为系统性血管炎 (systemic vasculitis)。由于任何形状、任何大小、任何部位的血管均可受累,这就出现了广泛而又异质性强的临床综合征。血管炎及其后继的改变可以是疾病的主要或唯一表现,也可是另外一种疾病的继发表现。血管炎可以仅局限在一个器官如皮肤,但也可能同时累及多个脏器和系统。
系统性血管炎目前病因不明,研究认为主要为感染原对血管的直接损害和免疫异常介导的炎症反应所致。例如病原微生物对血管的直接损伤、病理性免疫复合物形成、补体激活与炎症反应、抗体的直接致病作用、肿瘤细胞介导的免疫损伤等,均参与了该类疾病的发生发展。
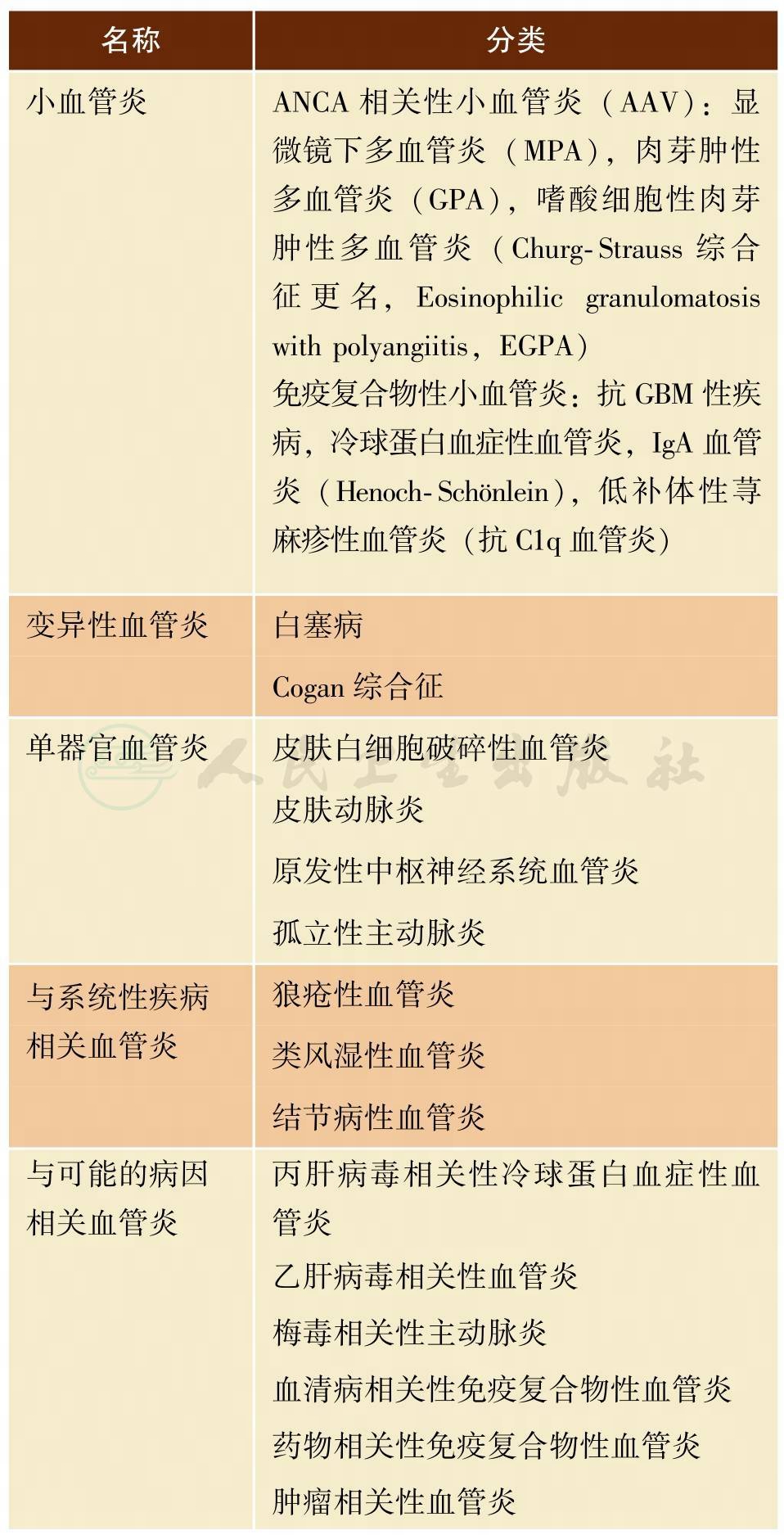
血管炎综合征作为一个症候群,它的主要特征是很强的异质性和互相之间的重叠。这种异质性和重叠性以及人们对这些综合征发病机制认识不足使得对这些疾病进行统一的分类非常困难。但随着对血管炎认识的提高,其分类方法也逐渐科学化,目前比较公认的是表1所列出的2012年Chapel Hill系统性血管炎命名共识研讨会(Chapel Hill Consensus Conference on the Nomenclature of Systemic Vasculitis)分类。
表1 2012年Chapel Hill系统性血管炎分类

续表
大多数血管炎综合征被认为至少部分是由对特定抗原刺激产生的免疫机制所介导的。但是,目前尚不清楚为什么某些个体对于特定抗原刺激可能会出现血管炎反应,而其他个体却不会。可能在血管炎综合征最终表达的过程中,涉及许多因素。这些因素包括遗传易感性、环境暴露情况、特定抗原免疫反应相关的调节机制等。
(一)致病性免疫复合物的形成
尽管免疫复合物在血管壁上的沉积是血管炎最广为接受的发病机制,但对于大部分血管炎综合征来说,免疫复合物与血管炎发病的因果关系还没有得到确定。循环免疫复合物并不一定会导致免疫复合物在血管内的沉积继而引起血管炎,而且在许多活动性血管炎患者体内也并没有发现循环或沉积的免疫复合物。但在部分系统性血管炎患者中证实由免疫复合物介导参与发病,如结节性多动脉炎中发现乙肝抗体循环及沉积免疫复合物,冷球蛋白血症血管炎中已证实了丙型肝炎病毒和丙型肝炎病毒抗原-抗体复合物的存在。
免疫复合物介导的血管炎中组织损伤的机制与血清病中描述的类似。在该模型中,抗原-抗体复合物在抗原过剩的条件下形成,并沉积于通透性已经增加的血管壁上。这些血管壁通透性增加是由于IgE触发机制的作用,使血小板或肥大细胞产生血管活性物质如组胺、缓激肽和白三烯,这些物质会增加血管壁的通透性。免疫复合物的沉积会导致补体成分的激活,尤其是C5a,这是一种很强的中性粒细胞化学趋化因子。之后,这些 (中性粒)细胞会浸润血管壁,吞噬免疫复合物,并释放其胞内酶来破坏血管壁。当该过程转为亚急性或慢性后,单核细胞开始浸润血管壁。因此而发生的综合征的共同特征是血管腔受损以及受累血管供血组织的缺血性改变。
(二)抗中性粒细胞胞浆抗体 (ANCA)
ANCA是针对中性粒细胞和单核细胞胞浆颗粒内特定蛋白组分的抗体。这些自身抗体在活动性肉芽肿性多血管炎韦格纳肉芽肿和显微镜下多血管炎患者中比例较高,在嗜酸性肉芽肿性血管炎患者中比例较低。由于此三种疾病均有出现ANCA和小血管受累的特性,因此,一些学者倾向于将其统称为 “ANCA相关性血管炎”。但是,由于这些疾病中存在一些特殊ANCA阴性的亚型,因此,我们仍认为肉芽肿性多血管炎、嗜酸性肉芽肿性多血管炎及显微镜下多血管应被看作不同的疾病类型。
根据ANCA抗体的靶点不同,主要分为两类ANCA。胞浆型ANCA(c-ANCA)指的是当血清中的该类抗体与中性粒细胞结合后,在荧光显微镜下会观察到其胞浆染色呈弥漫性、颗粒状分布。蛋白酶-3是主要的c-ANCA抗原,它是一种分子量29kDa的中性丝氨酸蛋白酶,存在于中性粒细胞的嗜天青颗粒中。90%以上典型活动期的肉芽肿性多血管炎患者体内能够检测出抗蛋白酶-3的抗体。核周型ANCA(p-ANCA)指的是将其染色后可见在中性粒细胞中的分布较局限于核周或细胞核。p-ANCA的主要靶点是髓过氧化酶;其他能够产生p-ANCA染色核型的靶蛋白包括弹力酶、组织蛋白酶G、乳铁蛋白、溶菌酶和杀菌/膜通透性增加蛋白。然而,仅有髓过氧化酶的抗体与血管炎肯定相关。已经报道不同比例的显微镜下多血管炎、嗜酸性肉芽肿性多血管炎、新月体肾小球肾炎、肉芽肿性血管炎患者中均可检出抗髓过氧化酶抗体。与抗髓过氧化酶抗体无关的p-ANCA染色核型则与非血管炎性疾病相关,例如风湿性或非风湿性自身免疫性疾病、炎性肠病、某些药物、感染(如心内膜炎,以及囊性纤维化患者呼吸道细菌感染)。
此类血管炎综合征患者会产生针对髓过氧化酶抗体或蛋白酶-3的抗体,而这些抗体在其他炎性疾病和自身免疫性疾病中却很罕见的原因尚不清楚。这些抗体在此类疾病的发病过程中所起的作用也不甚明确。有许多体外观察揭示了这些抗体会与血管炎综合征有关的可能发病机制。蛋白酶-3和髓过氧化酶存在于静止中性粒细胞和单核细胞的嗜天青颗粒和溶酶体内,它们显然难以接近血清抗体。然而,当中性粒细胞或单核细胞受到肿瘤坏死因子α(TNF)或白细胞介素 (IL)1诱导后,蛋白酶-3和髓过氧化酶易位至细胞膜,在这里它们便可以和胞外ANCA作用。之后中性粒细胞脱颗粒,并产生活性氧,从而导致组织损伤。此外,离体条件下,ANCA-激活的中性粒细胞能够黏附并杀伤内皮细胞。ANCA激活的中性粒细胞和单核细胞还会诱发促炎症细胞因子如IL-1和IL-8的释放。近来在基因工程小鼠中进行的过继转移试验为ANCA在体内的直接发病机制作用提供了进一步的证据。与此相反,许多临床和实验室观察不支持ANCA的主要致病作用。患者在没有ANCA存在时仍可能有活动期肉芽肿性多血管炎;抗体滴度的绝对高低与疾病活动的相关性并不很高;缓解期的肉芽肿性多血管炎患者可能持续数年保持高滴度的抗蛋白酶-3(c-ANCA)。因此,这些自身抗体在系统性血管炎中的发病机制仍然不甚明了。
(三)致病性T淋巴细胞反应和肉芽肿形成
除了经典的免疫复合物介导的血管炎机制和ANCA相关机制外,还可能有其他的免疫发病机制参与血管破坏。正如从肉芽肿性血管炎的组织病理学特征中所反映的,这些机制中最典型的为迟发型超敏反应和细胞介导的免疫损伤。然而,免疫复合物本身可能也会诱发肉芽肿性反应。血管内皮细胞能够经细胞因子如干扰素 (IFN)γ活化,表达HLA-Ⅱ分子。这就使得这些细胞能够参与免疫反应,例如采用与抗原提呈巨噬细胞类似的方法与CD4+T淋巴细胞相互作用。内皮细胞可以分泌IL-1,该因子可以活化T淋巴细胞并启动或放大血管内原位免疫反应。此外,IL-1和TNF-α是内皮-白细胞黏附分子1(ELAM-1)和血管细胞黏附分子1(VCAM-1)很强的诱导物,这两种黏附分子可以促进白细胞对血管壁内皮细胞的黏附作用。在某些类型的血管损伤中,还存在其他机制如直接细胞毒反应、直接抗血管壁成分的抗体、或抗体-依赖的细胞毒反应。然而,还没有令人信服的证据来支持它们与任何已知血管炎综合征发病机制的因果联系。
系统性血管炎的检查主要包括一般实验室检查、血清炎症指标检测、血清自身抗体检测、脏器功能检查、影像学检查(包括血管造影)及活体组织检查等方面。
1.一般实验室检查
血常规检查中白细胞及血小板正常或轻度增高,根据病程及病情不同,可有不同程度的贫血。尿常规检查因不同类型血管炎中肾脏受累的程度和类型而不同,ANCA相关性血管炎往往出现肾脏受累,尿常规提示蛋白尿、血尿和(或)白细胞尿,肾功能受累时也可出现不同类型的蛋白管型或细胞管型。便常规检测无特异性,便潜血提示继发性消化道出血、消化道黏膜病变或肠系膜血管病变可能。
2.血清炎症指标检测
炎症指标的增高见于多数血管炎病情活动期,包括血沉、C-反应蛋白等,也可见到血清纤维蛋白原、补体等炎症分子非特异性增高。
3.血清自身抗体检测
已成为部分原发性系统性血管炎的血清特征,有利于疾病诊断、病情活动度判断及估计预后,且不同抗体型别对不同类型血管炎也有一定的提示作用。其中抗中性粒细胞胞浆抗体(anti-neutrophilcytoplasmicantibodies,ANCA)及抗内皮细胞抗体(antiendothelialcellantibodies,AECA)是近年研究中被认为是最重要的血管炎相关自身抗体。前者多见于韦格纳肉芽肿、显微镜下多血管炎、变应性肉芽肿性血管炎,故这三类小血管受累为主的血管炎目前又通称为ANCA相关性血管炎。后者可见于大、中、小血管受累的各类血管炎,其中以川崎病阳性率最高。
(1)抗中性粒细胞胞浆抗体
目前ANCA已成为系统性血管炎的敏感血清学诊断工具,是研究系统性血管炎的热门课题。1985年发现ANCA为诊断部分原发性系统性血管炎的敏感且特异的指标。以乙醇固定的中性粒细胞为底物的间接免疫荧光法(IIF)检测发现,其胞浆内特异性荧光着染,称为胞浆性ANCA(cANCA),其靶抗原主要为丝氨酸蛋白酶3(PR3),同时发现与cANCA胞浆着染型别不同的荧光染色图形,主要表现为环绕于中性粒细胞核周的着染图形,被称为核周型ANCA(pANCA),主要靶抗原为髓过氧化物酶(MPO)。目前对ANCA的研究日益增多,证实ANCA为一个包含众多靶抗原的自身抗体谱,除PR3及MPO外,弹性蛋白、乳铁蛋白、组织蛋白酶G、杀菌/通透性增高蛋白(BPI)、天杀青素、溶酶体、β-葡萄糖醛酸酶、α-烯醇化酶、防御素,以及人溶酶体相关膜蛋白等,它们生理功能各异,且不同靶抗原荧光着染型别也不同,目前将不同于cANCA及pANCA型别的ANCA称为不典型ANCA(xANCA)。
目前临床上用于检测ANCA的方法主要有2种,间接免疫荧光法(IIF)是最原始也是最常用的方法,但是不能区分上述各种特异性抗原,临床上常作为筛选检测。酶联免疫吸附试验(ELISA)作为确证试验进一步区分ANCA不同特异性靶抗原,常用直接法或夹心法检测。ANCA不同型别在疾病诊治中的临床意义一直都是研究的热点。不同疾病中ANCA抗体谱见表37-10。
(2)抗内皮细胞抗体
AECA有IgG、IgM及IgA多种亚型,目前临床上多以检测IgM型为主。AECA有多种检测方法,采用人脐内皮细胞(HU-VEC)作为底物,可用ELISA法、免疫荧光法、流式细胞仪、免疫印迹法及补体介导的细胞毒试验等检测,目前常用ELISA法。但是由于其疾病特异性较差,对于血管炎诊治的临床意义稍逊于ANCA检测。
(3)其他自身抗体
另外系统性血管炎还可在血清中出现其他类型自身抗体,但较少见,如抗核抗体、抗心磷脂抗体,后者提示可能合并抗磷脂综合征,近期报道系统性血管炎合并抗磷脂抗体的患者出现多发性单神经炎的病例报告。
4.影像学检查
血管造影检测异常是大中血管受累性血管炎的重要诊断依据之一。根据受累血管大小及位置不同,可行不同部位血管造影检测。受累血管出现管腔闭塞、狭窄、串珠样改变等。
5.组织活检
组织活检是确诊各种类型血管炎最确切及重要的依据。常根据受累血管及脏器不同行不同部位的组织活检。
血管炎的诊断是临床工作中的难点,如对其了解不足,则既易漏诊,又易误诊,故掌握诊疗的基本原则非常重要。首先,任何患有无法解释的系统性疾病的患者都需考虑到血管炎的可能;但是,当某些临床异常情况单独出现或合并存在时,则对血管炎有重要提示意义。这些异常情况包括:突出皮面的可触性紫癜、肺部浸润影和显微镜下血尿、慢性鼻炎、鼻窦炎、多发性单神经炎、无法解释的缺血事件,以及有多系统疾病证据的肾小球肾炎。当然,许多非炎性疾病可能也会出现上述一部分或全部的异常表现。因此,建立血管炎诊断的第一步就是要排除可能产生类似血管炎临床表现的其他疾病。尤其重要的是要除外有血管炎某些表现的感染性疾病,特别是当患者的临床状况迅速恶化而计划加用免疫抑制治疗时。
一旦排除了类似血管炎的疾病后,则需要进一步遵循一系列的流程,以确立血管炎的诊断;如果可能的话,还需确定其类型 (图1)。临床上可利用活组织检查或血管造影来协助诊断。活检有助于确诊血管炎,而当怀疑血管炎综合征如结节性多动脉炎、大动脉炎或孤立性中枢神经系统血管炎时,对受累脏器进行血管造影常有异常发现。
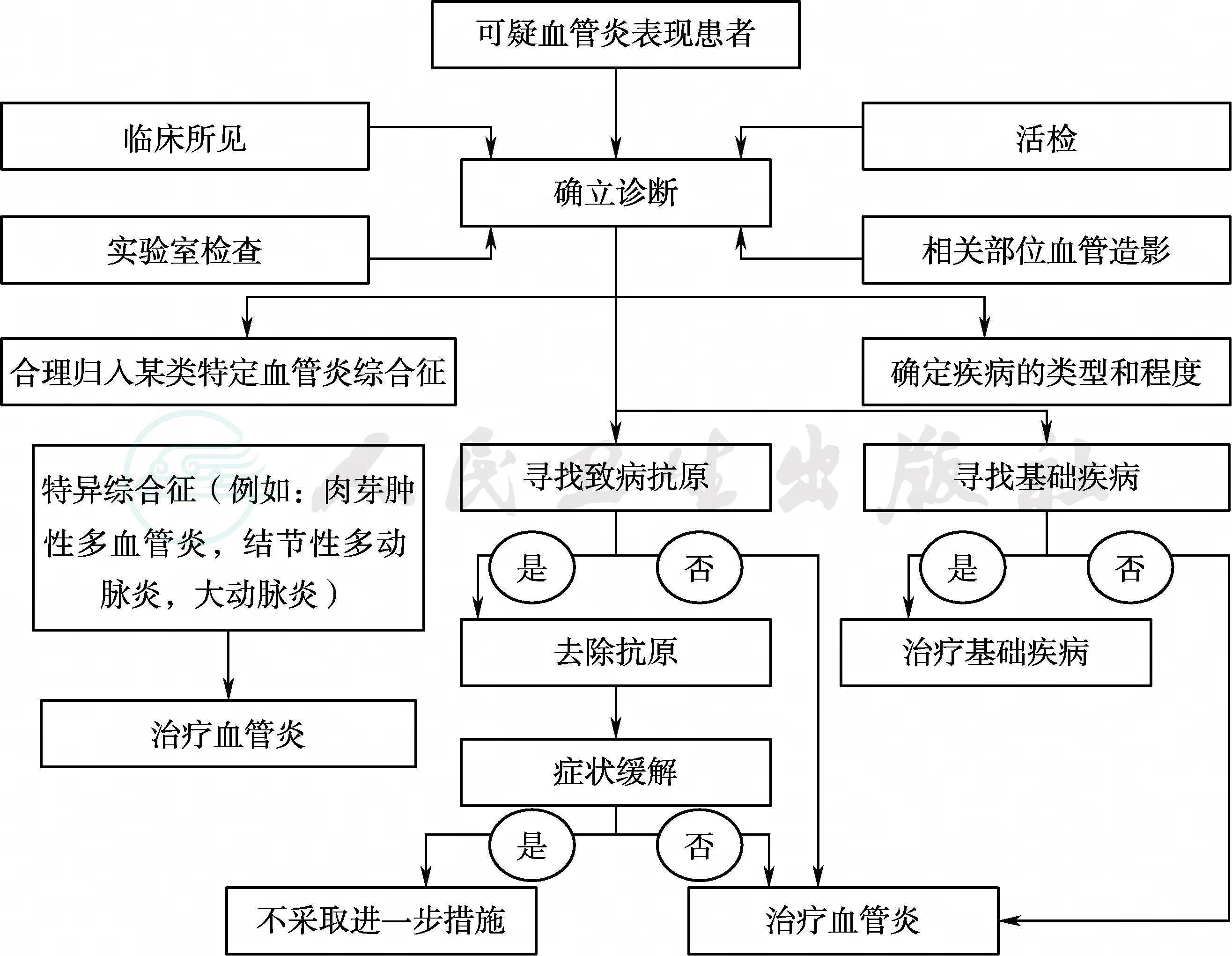
图1 疑诊血管炎患者的诊疗流程图
综合临床、实验室、活检和影像学检查结果常常可以对某种综合征进行合理分类,根据这些信息开始治疗。一旦发现了血管炎的诱发抗原,应尽可能地将其去除。如果血管炎和其他基础疾病有关,例如感染、肿瘤或结缔组织病,则应该治疗基础疾病。如果在去除诱发抗原或治疗基础疾病后血管炎症综合征没有好转,或没有发现基础疾病,则应该根据血管炎综合征的类型开始治疗。根据不同的血管炎类型选择不同的治疗方案。由于血管炎综合征的临床病情轻重不同,而很多药物都会引起毒副作用,因此我们需要仔细权衡每种治疗方案的风险-收益比。故需遵循以下治疗总原则:①当发生不可逆的器官功能衰竭以及明确疾病病残率很高时,就应立即开始应用糖皮质激素和/或细胞毒素进行治疗;②当疾病基本不会造成不可逆的器官功能衰竭以及对治疗反应不佳时,应该避免使用过强的治疗;③对于不能被明确分类的,或者尚无明确标准治疗方案的系统性血管炎,治疗中应该首先应用糖皮质激素;只有当疾病对治疗反应不佳,或必须应用超大剂量的糖皮质激素才能使疾病缓解并维持缓解状态时,才应添加细胞毒药物进行治疗。④如果必须使用细胞毒药物治疗,应该根据疾病累及器官的部位和严重程度以及药物的疗效和毒性,选择适当的细胞毒药物;⑤一旦病情达到缓解,就应在病情允许的情况下将药物尽量减量,甚至停药;⑥做决策时应遵循个体化原则,为取得最佳疗效,并将作用毒副作用减少到最低程度,对每位患者的治疗都应该灵活把握。













