英文名称 :metastatic tumor involving bone
转移性骨肿瘤(metastatic tumors involving bone)是指原发骨外器官、组织的恶性肿瘤(癌或肉瘤)通过血液或淋巴系统转移到骨骼,所产生的继发肿瘤。骨转移瘤的发生率占全身转移性肿瘤的15%~20%,仅次于肺转移和肝转移,发病率占恶性骨肿瘤的第1位。好发年龄40~60岁,男性多于女性,约为3∶1。骨转移瘤多发生于中轴骨,特别是胸椎、腰椎、骨盆,以及四肢的近心端。原发病灶以乳腺、肺、前列腺、肾及甲状腺等恶性肿瘤最为常见,约占所有病例的80%。骨转移瘤的治疗以综合性治疗为主,预后与肿瘤来源和转移灶部位、数量有一定关系。
骨外恶性肿瘤转移至骨的主要途径为血液循环系统,少数经淋巴系统,如乳腺癌可沿腋窝淋巴管浸润至肱骨近端。
一般来说转移过程可分为5个阶段:
1.肿瘤细胞从原发肿瘤脱落;
2.肿瘤细胞对周围毛细血管的浸润;
3.肿瘤细胞进入血液循环肿瘤细胞栓子的形成和滞留;
4.肿瘤细胞穿出血管;
5.肿瘤细胞在滞留骨上生长并形成转移灶。
肿瘤转移是一个十分复杂既包括肿瘤因素也包括宿主因素的多步骤的连续过程。一方面是通过恶性因子的表达促使肿瘤转移到骨骼上,如趋化因子受体CXCR4、CX3CR1以及整联蛋白αvβ3等;另一方面,是由于肿瘤细胞适合于在骨微环境中生长。骨有其独特的富饶的微环境,其正常代谢取决于破骨细胞对骨的吸收以及成骨细胞对于骨的形成和改建两者之间的动态平衡。而肿瘤细胞转移到骨后,与骨细胞发生相互作用,从而破坏了这种动态平衡,导致了过度的成骨形成或者骨破坏,表现出成骨或者溶骨。
1.X线平片
骨转移瘤的X线表现可分溶骨型、成骨型和混合型,以溶骨型常见。
(1)溶骨型:大部分恶性肿瘤骨转移都以溶骨性破坏为主要表现。溶骨性转移灶只有当直径大于1cm、骨密度破坏达30%~50%方能被X线检查发现。溶骨型转移瘤发生在长骨,多在骨干或邻近的干骺端。病变首先破坏松质骨,最终侵犯骨皮质,表现为松质骨中多发或单发、小的虫蚀状骨质破坏,边缘不规则,无硬化边。病变发展,破坏融合扩大,形成片状溶骨性骨质破坏,骨皮质也受累,常引起病理性骨折,但一般无骨膜反应和软组织侵犯。
(2)成骨型:成骨型转移瘤少见,多系生长缓慢的肿瘤所引起,见于前列腺癌、鼻咽癌、膀胱癌和少数乳腺癌的转移。多出现在骨盆及腰椎松质骨内,一般多发,呈边界不很清楚的结节状、片状或索状致密影,密度均匀一致,骨皮质多完整,椎体不压缩变扁。个别可表现为骨质均匀一致的硬化似象牙样。
(3)混合型:兼有溶骨型和成骨型的改变。反应性新生骨与溶骨性破坏同时存在是混合型转移性骨肿瘤的X线典型表现。
2.CT、MRI检查
可较X线检查早期发现微小病灶,还可发现临床或其他方法不能显示的单个病变及其与周围组织的关系。
3.核素骨扫描(ECT)
是检测转移性骨肿瘤敏感的方法,在有5%~15%的局部骨代谢变化时即可以显示出来,检出时间比X线检查早3~6个月,且可发现多处病灶。
4.PET
其诊断转移性骨肿瘤的阳性率高,是目前最敏感的一种检查方法。PET-CT诊断骨转移瘤的敏感性为91.2%,特异性81.0%,准确性为88.8%,能在早期发现病灶并明确原发病灶。
5.实验室检查
常规血、尿、粪、生化全套、血沉、C反应蛋白等检查能为鉴别诊断提供帮助。碱性磷酸酶的变化是脊柱转移瘤的一个重要化验指标,对于成骨型骨转移患者几乎均有明显升高。骨转移瘤的晚期,还可出现血钙的异常。多种肿瘤标记物的检查(如CEA、PSA、CA199、CA125等)可为查找原发肿瘤提供有益的信息。
治疗方式选择:脊柱转移瘤的治疗应在准确术前评估的基础上,结合患者的具体情况,制订个体化的治疗方案。
1.手术治疗
恶性肿瘤患者一旦出现脊柱转移,即为肿瘤中晚期,其生存期有限。脊柱转移瘤患者的生存期受多种因素的影响,如原发肿瘤的病理类型、转移情况、脊髓压迫情况、患者一般状况及基础疾病等。相对而言,骨髓瘤、淋巴瘤和部分软组织肉瘤转移生存期较长。腺癌转移中,以乳腺癌、肾透明细胞癌、前列腺癌生存期相对较长,肺癌和肝癌生存期则较短。一般认为拟行手术治疗的患者预期生存期一般不应短于半年。
目前大多数学者认为脊柱转移瘤患者外科手术治疗的目的是:①尽可能恢复或保留神经功能;②缓解疼痛;③切除肿瘤或肿瘤减压;④获得即时或永久的脊柱稳定性。
一般认为,脊柱转移瘤手术适应证为:①肿瘤导致脊柱不稳与畸形和(或)压迫脊髓、神经根引起进行性神经功能损害;②顽固性疼痛经非手术治疗无效;③转移灶对放、化疗不敏感或经放、化疗后复发引起脊髓压迫;④明确病变性质。
脊柱转移瘤的主要手术方式包括:
(1)姑息性减压手术
主要为椎板切除减压,可同时行后路稳定性重建。
(2)肿瘤切除术
①囊内切除术或病灶内切除:指在肿瘤的包膜或反应区内行肿瘤切除术,肿瘤切除不彻底;配合瘤体射频消融等技术,可能获得更好的效果;②整块切除术包括:广泛切除:一般指在肿瘤包膜或反应区以外切除肿瘤。脊柱肿瘤由于毗邻大血管、重要脏器和脊髓等重要结构,常常难以实现;边缘切除:沿肿瘤包膜或反应区的切除;③全脊椎切除:完整切除一个或多个受累脊椎。多项研究表明,对于合适的患者行全脊椎切除有助于延长患者的生存期。近年来,经后路一期全脊椎切除术(图1),取得较好的效果。
Tomita的脊柱转移瘤分型,并提出了一种更积极的手术方式,单一后路的全脊椎整块切除(total en bloc spondylectomy,简称TES)。为此而将脊柱解剖学分为五区:椎体区(1区),椎弓根区(2区),椎板、横突和棘突区(3区),椎管内硬膜外区(4区),椎旁区(5区);进而按照病灶受累的顺序及范围进行外科分类为三类七型(根据Enneking外科分期系统改进):Ⅰ~Ⅲ型属间室内,Ⅳ~Ⅵ型属间室外,Ⅶ型为多发或跳跃性病灶。即:

图1 一期后路全脊柱整块切除术
A.病变局限在椎骨内
Ⅰ型:单纯前部或后部的原位病灶(1或2或3)
Ⅱ型:前部或后部病灶累及椎弓根(1+2或3+2)
Ⅲ型:前部、后部及椎弓根均受累(1+2+3)
B.病变累及椎骨外
Ⅳ型:累及蛛网膜下腔(任何部位+4)
Ⅴ型:累及椎旁(任何部位+5)
Ⅵ型:累及相邻脊椎
Ⅶ型:多发或跳跃性病灶
Tomita分型图示,见图2。
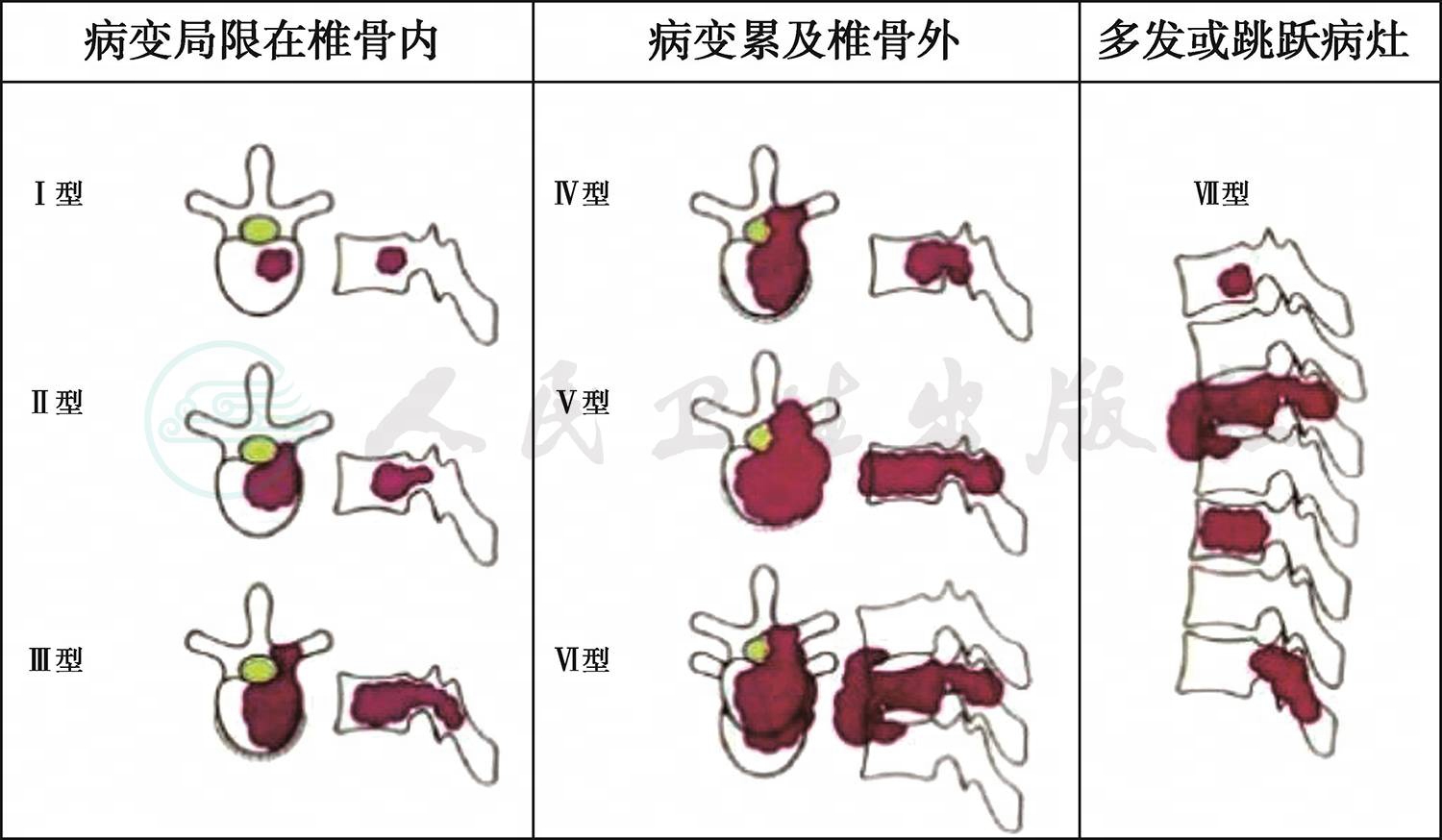
图2 Tomita分型示意图
(3)经皮椎体成形术(percutaneous vertebroplasty,PVP)
经过椎弓根向椎体内注入骨水泥的方法,达到增强椎体强度和稳定性,对防止塌陷和缓解转移瘤疼痛等有较好的疗效,同时PMMA的热作用和毒性作用还有一定的抗肿瘤作用。
对于脊椎转移瘤而言,由于其解剖结构复杂,部位深在,不易显露。同时许多脊椎转移瘤早期症状、体征多不明显,一旦出现脊髓、神经根压迫症状,肿瘤多已广泛浸润。因此选择手术治疗,术中既要避免损伤脊髓又要做到广泛切除肿瘤是非常困难的,边缘切除或肿瘤刮除术辅以术后合适的放化疗,常常是一种较实际的选择。
2.非手术治疗
(1)化学治疗
对于脊柱转移瘤而言,单纯手术治疗的效果是有限的,而微转移灶的存在是肿瘤复发和转移的主要原因,也是影响存活的主要因素。全身化疗既可以对原发瘤本身进行治疗,同时又能有效地消灭亚临床病灶,减少肿瘤复发和转移。化疗主要依据原发肿瘤的生物学特性及敏感性选择药物。
(2)激素治疗
乳腺癌、前列腺癌、子宫癌和卵巢癌可以选择激素治疗。
(3)放射治疗
由于脊柱肿瘤所处解剖位置的特殊性,手术常难以实现完整的病灶切除,因此放射治疗是脊柱转移瘤的一种重要辅助方法。尤其是特殊部位的转移瘤,如上颈椎,由于部位较深,手术切除困难,放疗成为重要治疗方法。根据放疗的方式可以分为外放射和内放射,根据放疗的时机可分为术前放疗和术后放疗。一些研究表明术前放疗增加了术后并发症的发生率,主要为感染、切口不愈合等。Tomita等认为放疗对于椎体肿瘤软组织侵犯有效,但一旦病理性骨折发生,放疗对于预防椎体进行性塌陷是无效的。三维适形放疗和调强放疗的出现使得能够在计算机和CT辅助条件下,将放射线大剂量集中于脊柱肿瘤区,改善靶区的剂量分布。
(4)放射性核素内照射治疗
89SrCl2具有强烈亲骨性,静脉注射后可浓聚于骨转移灶,释放高能β射线,抑制肿瘤细胞,有明显的止痛作用。
(5)二磷酸盐类药物治疗
能够选择性抑制破骨细胞,从而减轻骨质破坏,并降低血钙。
(6)免疫治疗
近年来由于分子生物学技术的进步,肿瘤疫苗、单克隆抗体、细胞因子、免疫活性细胞输注以及基因治疗技术等在临床上的应用逐渐成为现实。目前肿瘤免疫治疗尚未取得令人满意的疗效,主要与肿瘤患者突变的基因并没有成为有效的免疫靶、患者的免疫状况的个体差异及各自的特异性免疫的病理生理变化不尽相同有关













