英文名称 :macular edema
黄斑水肿(macular edema)是一种严重威胁视功能的常见眼底表现,而非一种独立的眼病。它是液体在黄斑区视网膜内异常聚集,即黄斑区的视网膜水肿。当液体积聚在外丛状层和内核层之间的蜂房样空隙时,呈放射状排列的黄斑区外丛状层Henle纤维将积液分隔成多个特征性的囊样小腔,称为黄斑囊样水肿(cystoid macular edema,CME)。黄斑水肿主要表现为中心视力下降、黄斑区视网膜神经上皮层增厚,长期不愈可以造成光感受器的凋亡、视力不可逆的丧失。
多种原因可以导致黄斑水肿,如视网膜血管病变、眼内炎症、眼内手术、视网膜变性、外伤、药物、黄斑前膜等(表1)。不同病因所致的黄斑水肿的发病机制各有不同,目前尚无定论。黄斑水肿的病因与发病机制如下。
表1 黄斑水肿的病因分类

(一)血-视网膜屏障破坏
视网膜和血液循环系统之间有两种屏障:外屏障(视网膜与脉络膜之间,由RPE细胞间的紧密连接构成)和内屏障(由视网膜毛细血管壁内皮细胞间的闭锁小带构成)。正常时内、外屏障可以通过主动转运和被动转运过程阻止血浆成分自由进入视网膜。当缺血、缺氧、炎症、变性、外伤、手术等原因损伤血-视网膜屏障时,VEGF和炎症相关因子生成增多,致使血管通透性改变,大分子物质及大量水分子从血管内渗出到管外,最终导致黄斑水肿,如糖尿病性视网膜病变黄斑水肿、视网膜静脉阻塞引起黄斑水肿等。
(二)Starling组织水肿理论
Starling理论是指静水压和渗透压共同作用下液体流动方向发生改变而导致组织水肿形成的理论。血管阻塞引起血管内压力增高,加上视网膜组织处于缺血状态,血管发生自身调节性扩张。根据Poiseuille理论,动脉扩张,动脉压下降使静脉和毛细血管内静水压增加,从而导致血液成分渗漏到血管外。
(三)Müller细胞活性改变
Müller细胞是视网膜的主要胶质细胞,其突起包绕毛细血管周围,可以将血液中的营养物质传递到神经元,排出代谢废物,维持包括离子渗透压、pH值等细胞外微环境的稳定。在缺氧、炎症、高血糖等病理情况下Müller细胞活性改变,VEGF、基质金属蛋白酶合成增加,使紧密连接蛋白降解,血-视网膜屏障通透性增加,视网膜内液体清除减少,导致黄斑水肿。
(四)机械牵拉作用
黄斑前膜或玻璃体对黄斑及其周围视网膜血管的牵拉可导致视网膜毛细血管扭曲、血视网膜屏障受损,从而引起黄斑水肿。
(五)内界膜增厚
内界膜(internal limiting membrane,ILM)是Müller细胞的基底膜,是视网膜与玻璃体之间的屏障。而内界膜的增厚之所以能参与黄斑水肿的形成,是因为多种原因引起的内界膜增厚可以阻止视网膜内的大分子物质从视网膜进入到玻璃体腔,造成视网膜内高渗透压,从而减缓黄斑水肿的消退。
1.FFA
可以很好的评估难治性黄斑水肿的渗漏程度,作为诊断的金标准广泛运用于临床。不同病因导致的黄斑水肿,除各自相应体征外,还可见黄斑部弥漫性的深层荧光渗漏或呈花瓣样强荧光(图2、3)。如糖尿病黄斑水肿(DME)中可见由微血管瘤、小血管及毛细血管异常导致与病变部位及疾病进展有关的弥漫性深层荧光渗漏;视网膜静脉阻塞(RVO)引起的黄斑水肿则为静脉扩张迂曲,晚期静脉管壁着染;葡萄膜炎表现为后极部静脉广泛渗漏如圣诞树状,伴有视乳头渗漏。
2.ICGA
单纯黄斑水肿只影响视网膜层,除了黄斑水肿增厚的遮蔽荧光斑外,一般脉络膜血管造影为正常表现(图3)。在葡萄膜炎患者,可出现脉络膜低荧光和高荧光等改变。
3.OCT
黄斑水肿表现中心凹消失,严重可隆起,神经上皮层较正常明显增厚,节细胞层、内外丛状层以及光感受细胞层的光反射下降(图4)。CME可见有数个反射均匀的囊样暗区(图2~5)。
4.视野检查
中心相对或绝对暗点,Amsler表中心暗点和变形更明显。
5.多焦ERG(mfERG)
在黄斑水肿时可以发现波幅下降及变宽,显示潜伏期延长的电生理反应刺激。
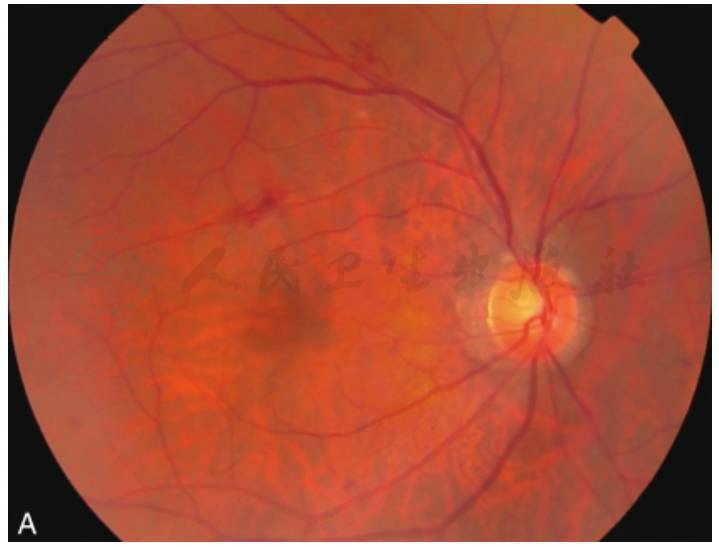
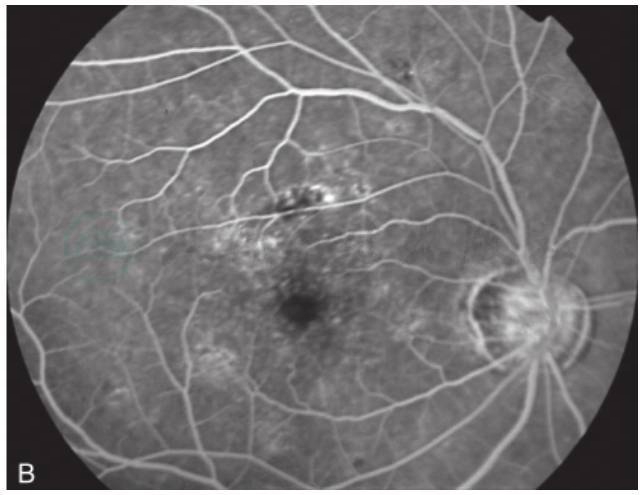
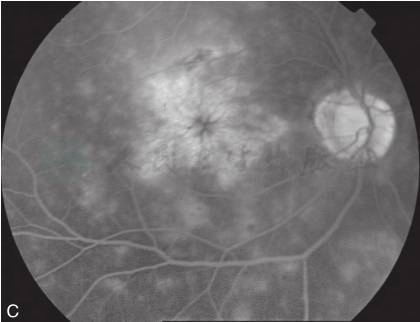
图2 黄斑囊样水肿荧光素眼底血管造影
A.人工晶状体植入术后,黄斑上方有片状出血;B.FFA38秒,黄斑区点状高荧光渗漏;C.FFA11分钟,黄斑区花瓣状荧光渗漏(刘文提供)
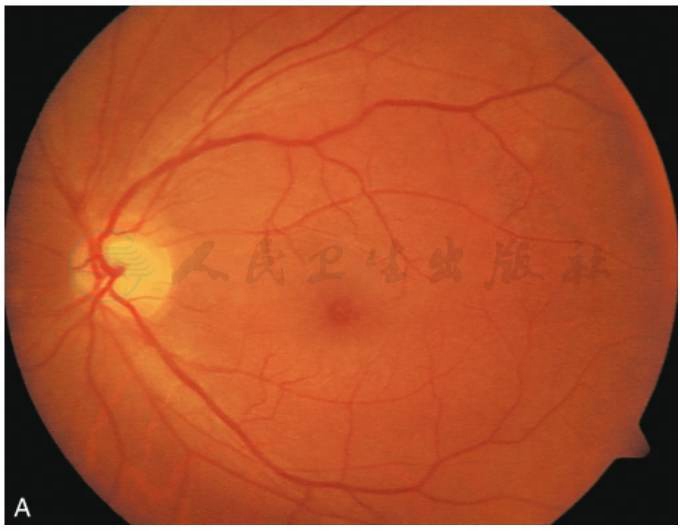
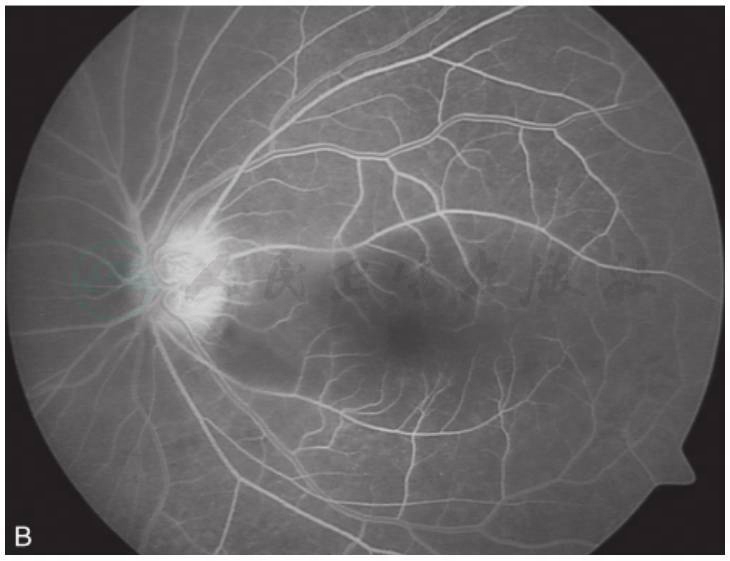
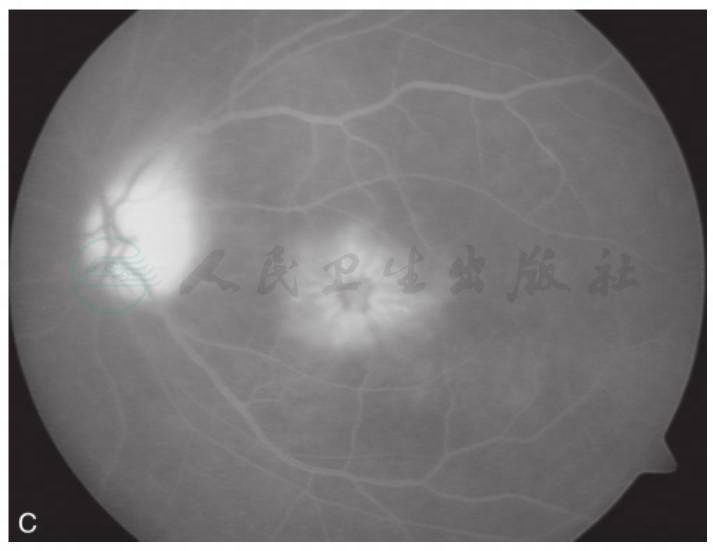
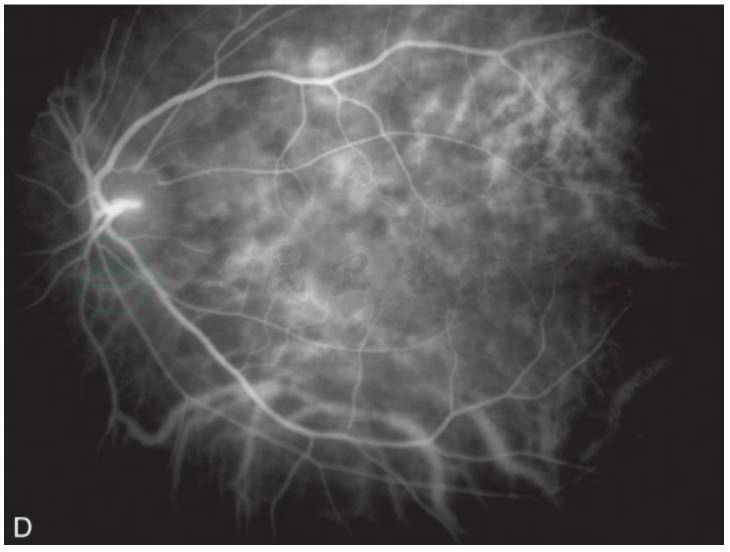
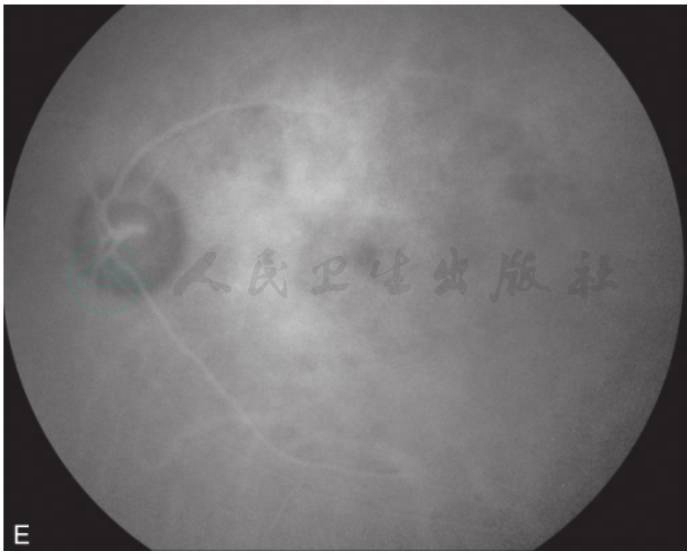
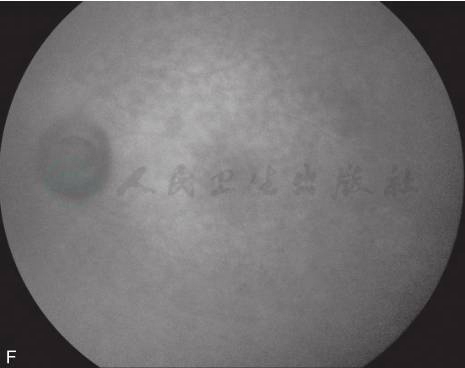
图3 黄斑囊样水肿吲哚青绿脉络膜血管造影
A.眼底彩照见视乳头颜色正常,边界清;黄斑区反光消失,中心凹呈蜂窝状;B.FFA早期,视乳头高荧光,血管行径正常,无渗漏,黄斑周围视网膜点状高荧光;C.FFA晚期,视乳头呈高荧光,边界不清,黄斑区染料沉积成花瓣状高荧光;D.ICGA造影早期,黄斑区显示遮蔽低荧光;E.ICGA造影中期,视乳头低荧光,黄斑区盘状遮蔽低荧光;F.ICGA晚期,黄斑区持续盘状遮蔽低荧光(刘文提供)
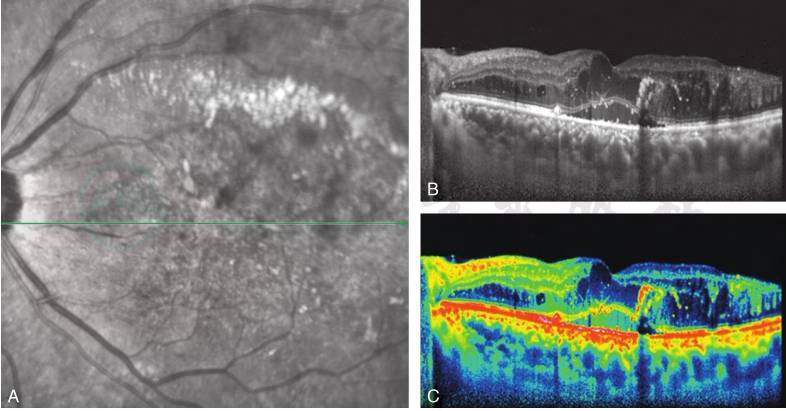
图4 黄斑弥漫性水肿
A.左眼糖尿病性视网膜病变,后极部较密点状硬性渗出;B.OCT图显示后极部视网膜弥漫性水肿、增厚伴斑点状高反射(硬性渗出),中心凹下神经上皮渗出性脱离;C.B图彩色OCT图
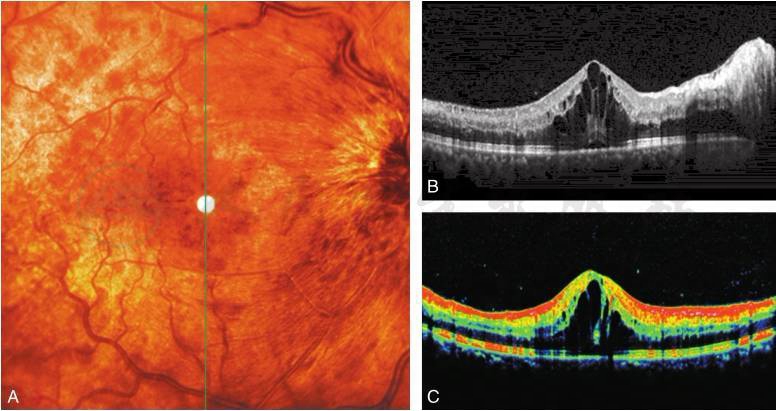
图5 黄斑囊样水肿
A.右眼视网膜中央静脉阻塞,血管迂曲,乳头周大量片状视网膜内出血;B.OCT水平切面灰度图,黄斑区视网膜增厚,中心凹囊样水肿;C.OCT垂直切面彩色图,黄斑囊样水肿隆起(刘文提供)
一、治疗
黄斑水肿分为病因治疗和对症治疗两个方面,后者是通过药物、激光和手术来减轻黄斑水肿或促进黄斑水肿消失。病因治疗请参照各个疾病章节,这里主要介绍治疗黄斑水肿新进展。
(一)曲安奈德
曲安奈德(TA)能显著减低细胞间的通透性,同时下调细胞间黏附分子-1的表达,还可以抑制花生四烯酸和前列腺素的生成,减少血管内皮生长因子基因的表达,并且通过稳定细胞膜和增强紧密连接,从而加强血-视网膜屏障功能。
1.适应证
用于治疗糖尿病性视网膜病变(DR)、RVO、葡萄膜炎或内眼手术引起的黄斑水肿。
2.方法
在无菌条件下表面麻醉后进行,向玻璃体腔中央注入TA2~4mg,必要时3~6个月之后重复一次。
(二)地塞米松缓释植入物
近年研制的一种可降解的地塞米松缓释植入物(Ozurdex,0.7mg)植入玻璃体腔内,可长时间保持玻璃体腔内地塞米松的有效浓度,有效提高了继发于DR、RVO、非感染性葡萄膜炎和放射性黄斑水肿的治疗水平,改善视力。Ahmad研究表明,对继发于RVO的黄斑水肿患者,地塞米松缓释剂的剂量对视力提高无明显差异,最好矫正视力(BCVA)提高大于15个字母。植入后随访6个月发现,植入缓释剂的BCVA提高速度在30天到90天时明显快于对照组,但无论是0.35mg还是0.7mg,BCVA很难维持到180天。而且反复植入地塞米松缓释物是否对水肿的消退更加有效,还有赖于进一步长期随访。在国内目前还处于Ⅲ期临床试验阶段。
1.适应证
用于治疗DR、RVO、葡萄膜炎、放射性治疗后或内眼手术引起的黄斑水肿。
2.注入方法
结膜表面麻醉后,注入物通过一个特制的仪器连接22G注射管将其注入玻璃体中。
3.并发症
与TA类似,但青光眼、白内障的发生率较TA低。有极少数的病例报道称注入植入物后眼压降低。
4.禁忌证
眼部或邻近部位有感染灶(如疱疹病毒、水痘、牛痘或真菌),进展性青光眼,对类固醇或植入物上的载体过敏的患者禁用。
(三)碳酸酐酶抑制剂
碳酸酐酶Ⅱ在睫状体和视网膜分布较多,调控水电平衡。各种病因导致血-视网膜屏障破坏,水电平衡紊乱,内皮细胞受损,VEGF表达增加,视网膜血管通透性改变,最终引起黄斑水肿。通过抑制碳酸酐酶活性除改善细胞内外的离子分布以外,还可以减低激肽系统活性,导致细胞外基质的pH值恢复,改变视网膜血管通透性,促使液体从视网膜主动转运到脉络膜血管。
1.适应证
可用于DR、RVO、视网膜色素变性、内眼手术等引起的非难治性黄斑水肿。
2.方法
可口服用药醋甲唑胺,50mg/次,2次/天,通常连续使用不超过3天。也有眼部局部滴用多佐胺滴眼液,一次1~2滴,每日2次,持续用药1月,后根据病情需要调整用药时间。
3.并发症
长期口服使用可引起水、电解质紊乱,对肝肾功能有所损害。
4.副作用
滴眼剂最常见的报道为雾视和味觉异常,少部分患者称使用后可出现视物模糊、异物感、眼干燥等不适。
(四)VEGF抑制剂
VEGF能通过促进细胞紧密连接中角蛋白磷酸化,破坏毛细血管内皮细胞的转运功能,从而增加视网膜血管的通透性,引起黄斑水肿。基于此机制,VEGF抑制剂越来越广泛的应用于临床。VEGF抑制剂与VEGF分子结合后能够阻断VEGF与受体结合,使VEGF的作用下降,从而降低视网膜血管通透性,改善血-视网膜屏障功能。
1.适应证
临床上多用于治疗由DR和视网膜静脉阻塞引起的黄斑水肿及其他眼部疾病引起的黄斑水肿。
2.方法
玻璃体腔内注射方法同TA注入法,所用注射剂量根据具体药物不同而异,如贝伐单抗为1.5mg,雷珠单抗为0.5mg。
(五)激光治疗
通过激光直接封闭渗漏的视网膜血管和脉络膜毛细血管,封闭渗漏点。在血管闭塞和新生血管性疾病,通过光凝这些部位,减少视网膜的耗氧量和促进组织修复,从而减轻渗漏。常用氩绿激光(514.5nm),近年也有提倡采用黄色激光。适应证:目前主要用于治疗DR及RVO引起的黄斑水肿。
(六)手术治疗
是通过手术解除玻璃体对黄斑的机械性牵拉,还有去除了原玻璃体腔内积聚的一些促进视网膜微血管渗漏的相关因子(如VEGF等)及术中使用的富含氧的灌注液提高了眼内视网膜面的氧含量,促进微血管收缩,缓解了渗漏的发生,并且增加了黄斑旁毛细血管的血流量。玻璃体切除联合视网膜内界膜剥除,不但消除了内界膜对黄斑部的机械性牵引,还去除了作为Müller细胞基底膜的内界膜,理论上可导致视网膜原生质构架改变,进而加快弥漫性黄斑水肿的吸收。最近有文献提出,弥漫性DME的内界膜增厚并与大量炎性细胞黏附,如VEGF,剥除内界膜可以缓解血-视网膜屏障的炎症反应。有研究证明玻璃体切割联合内界膜剥除术后,黄斑水肿明显减退,视力提高,但长期随访发现,进行内界膜剥除的疗效与单纯玻璃体切除的疗效相似。
1.适应证
由玻璃体或前膜牵拉引起的黄斑水肿和一些药物治疗经久不愈或对激光光凝等非手术治疗无反应的黄斑水肿。
2.手术时机
对于手术时机的选择,目前尚无定论,但需符合以下特点:①美国糖尿病视网膜病变早期治疗研究组(ETDRS)定义的有临床意义的黄斑水肿(clinical significant macular edema,CSME);②对光凝治疗没有反应的弥漫性黄斑水肿;③OCT检查无玻璃体后脱离,有后部玻璃体皮质增厚并对黄斑区产生牵拉。
3.手术方式的选择
①静脉分叉处鞘膜切开术适应分支静脉阻塞引起的黄斑水肿;②视乳头放射状切开术适应视网膜中央静脉阻塞引起的黄斑水肿,其实际效果需要进一步证实;③玻璃体切除联合眼内光凝和TA玻璃体腔注入适应血管性疾病和视网膜血管炎性疾病;④联合内界膜剥除适应弥漫性DME患者对光凝没有反应的黄斑水肿;⑤单纯玻璃体切除适应黄斑前膜、玻璃体黄斑牵拉综合征和格栅样光凝治疗无效的DME。
4.手术步骤
参考临床眼底病的相关词条。
二、治疗效果
无论是玻璃体腔内还是球周注入TA,对于糖尿病性黄斑水肿或视网膜静脉阻塞患者的疗效均较明显;而对葡萄膜炎的患者,则有文献报道注入VEGF抑制剂比TA的疗效好。近几年国内有学者提出将玻璃体切除与玻璃体腔内注入TA联合,发现相比单纯切除玻璃体而言,该法更能缓解黄斑水肿、提高视力。
Ahmad的研究表明对视网膜中央静脉阻塞患者注入0.5mg的雷珠单抗后,视力提高多于15个ETDRS字母(早期糖尿病视网膜病变治疗研究组制定的视力表),中心凹水肿消退明显。Arevalo等报道白内障术后的病人在注入贝伐单抗后中心凹厚度499.9µm降至286.1µm。
根据ETDRSR报道,DR早期局部激光可降低治疗组中心凹厚度,随访三年发现,治疗组发生中心视力丧失的危险是13%,而未治疗组则为33%。
Ahmad的报道视网膜静脉阻塞患者行玻璃体切除术后中心凹厚度降低明显。Pendergast等报道白内障术后黄斑水肿的病人在玻璃体切除术后视力可以较术前提高3.3行Snellen视力。有国外学者发现对葡萄膜炎性黄斑水肿行玻璃体切除术可以有效控制炎症反应,术后辅以葡萄膜炎的常规治疗疗效更佳。玻璃体切除联合视网膜内界膜剥离组患者的短期疗效较单纯玻璃体切除组好,而长期随访未发现差异,表明联合内界膜剥除的疗效可能并不明显。













