英文名称 :latent autoimmune diabetes in adults
在1997年美国糖尿病学会(ADA)和1999年世界卫生组织(WHO)提出的糖尿病分型新建议中,成人隐匿性自身免疫糖尿病(latent autoimmune diabetes in adults,LADA)归属为免疫介导性T1DM的亚型。
1977年,英国Irvine观察到非胰岛素依赖型糖尿病(NIDDM)患者中,部分人胰岛细胞抗体(ICA)呈阳性,多无肥胖,血浆C肽低,易出现继发口服降糖药失效且伴有较高比例的自身免疫病病史。1986年,芬兰Groop等报道ICA阳性的NIDDM患者C肽低,但最初不需胰岛素治疗,人HLA-DR3和DR4频率增加,随访观察其β细胞功能持续下降,称之为隐匿性(latent)或迟发性(late-onset)T1DM。1987年,日本Kobayashi将其命名为“缓慢进展性胰岛素依赖型糖尿病”(slowly progressive IDDM)。还有学者认为此类糖尿病为T1DM和T2DM间的过渡类型,其患者兼有T1DM(胰岛素缺乏和胰岛自身抗体)和T2DM(胰岛素抵抗和肥胖)的特点,故称其为“1.5型糖尿病”。1990年,美国Baekkeskov等首次证明胰岛素依赖型糖尿病(IDDM)患者体内胰岛64kD抗原的本质是谷氨酸脱羧酶(GAD),并建立了GAD抗体(GADAb)的免疫沉淀酶活性分析法。1993年,澳大利亚Tuomi等对1组成年发病的NIDDM患者检测GADAb,发现有较高阳性率,并将此类糖尿病命名为“LADA”。
目前“LADA”这一命名最为常用。最近,有学者建议在临床工作中以“AIDA”(成人自身免疫性糖尿病,autoimmune diabetes in adult)来替代“LADA”这一简称,而LADA仅在科研中使用,以避免临床医师对“latent(隐匿性)”一词产生误解。
随着近年对LADA研究的深入,人们发现其作为一种特殊类型的糖尿病,患者的临床表型具有明显的异质性:既有类似于经典T1DM、胰岛功能快速衰竭的患者,又有十几年病程都无明显进展的患者;既有特别消瘦的患者,又有肥胖或伴有代谢综合征的患者。学者们在研究中发现这种异质性可通过抗体滴度的水平予以解释。2001年,Lohmann等观察到ICA和GADAb均阳性和携高滴度GADAb的LADA患者的临床特征更接近于T1DM,而单一抗体阳性或携低滴度抗体的LADA患者则更类似于T2DM,并将它们分别命名为“LADA-type 1”和“LADA-type 2”即LADA-1型和LADA-2型。相关研究亦发现以GADAb滴度指数0.3为界划分的2个LADA亚型患者的临床特征存在显著的不同,结果与Lohmann相似。这表明糖尿病是一个连续的疾病谱,LADA处于自身免疫机制介导的经典T1DM和以胰岛素抵抗为主的T2DM之间,是既存在胰岛素分泌缺陷又存在胰岛素抵抗的过渡类型——1.5型糖尿病。
1.胰岛自身抗体数目/滴度/GADAb表达频率存在差异
LADA的T细胞免疫功能及胰岛免疫病理观察甚少。Brooks-Worrell等观察了LADA患者外周血单个核细胞(PBMC)对人胰岛蛋白的增殖反应。Shimada等报告了1例日本女性LADA患者T细胞浸润胰岛的活检情况。上述有限的资料均支持LADA是一种T细胞介导的自身免疫性疾病。然而,如能针对ICA阳性而GADAb、IA-2Ab及IAA均阴性的LADA患者探讨新的胰岛自身抗原,如能细致检测其胰岛自身抗原(GAD、IA-2和胰岛素原等)特异性T细胞功能,如能对其胰腺进行活检或尸检,定性或定量地揭示LADA胰岛炎与经典T1DM的异同,这些研究无疑将有助于进一步阐明LADA的发病机制。
2.LADA具有较高的T1DM易感基因频率
LADA的上述免疫反应与临床进程是否存在相应的遗传学基础?Tuomi等研究表明,与经典T1DM关联的HLA-Ⅱ类等位基因如DR3、DR4、DQ2和DQ8的频率由高到低的顺序为经典T1DM、LADA和健康对照。但UKPDS显示,HLA-DR3、HLA-DR4及HLA-DR3/4频率在LADA与经典T1DM中相似,且随LADA诊断年龄的增加而降低;HLA基因型与诊断后6年使用胰岛素治疗的概率无关,而HLA-DQ易感基因型与<55岁组LADA的胰岛自身抗体滴度相关。LADA的易感基因研究有待深入,开展中国人群的大样本研究,包括HLA单体型、胰岛素启动子串联重复序列数目(INS-VNTR)、细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte associated antigen,CTLA-4)和主要组织相容复合物Ⅰ类链相关基因A(MHC class I chain-related gene A,MICA)等候选基因筛查以及其他经典T1DM和/或T2DM相关基因的比较研究均有待进行。给LADA患者的无糖尿病的后代静脉注射葡萄糖刺激后,胰岛素的释放水平降低,提示其后代胰岛分泌功能受损与遗传因素的影响有关。
Vauhkonen等给LADA患者的无糖尿病的后代静脉注射葡萄糖,刺激的胰岛素释放水平降低,提示其胰岛分泌功能受损。进一步研究显示,GADAb阳性LADA患者的子女还存在胰岛素原及胰岛素原/C肽比值的升高,而ICA阳性LADA患者的子女则无胰岛素原分泌的异常,而以胰岛最大储备功能受损为主,提示其与遗传因素的影响有关,且具有一定的异质性。
3.LADA易患性和保护性基因与经典T1DM不同
LADA具有较高的T1DM易感基因频率,如HLA-DR3/ DR4、HLA-BW54、HLA-DQB1*0201/0302和HLA-DRB1*03-DQA1*0501-DQB1*0201等。LADA的HLA表型与经典T1DM并不完全相同,且具有种族特异性,在正常人群亦有一定分布。T1DM高危基因HLA-DQB1*0201/0302的频率在携带高滴度GADAb的经典T1DM患者中最高,在GADAb阳性的LADA中次之,T2DM中最低,提示该基因频率与GADAb滴度呈正相关;而保护型基因HLA-DQB1*0602(3)的频率在3组中的分布恰与易感基因相反,提示LADA易患性和保护性基因与经典T1DM存在差异,这种差异与缓慢进展的胰岛自身免疫破坏有关。
比较LADA(根据GADAb滴度分为LADA-1型和LADA-2型组,即GADAb≥0.3者为LADA-1型,GADAb<0.3 为LADA-2型)和经典T1DM患者(分为青少年急性起病和成人急性起病组)的T1DM的HLA-DQ易感基因和易感单体型,发现HLA-DQ易感或保护性基因频率在青少年T1DM、成人T1DM、LADA-1型和LADA-2型呈现为一个连续的谱,LADA-1型与经典T1DM患者的易感基因和易感单体型频率相似,且均高于正常对照,而保护性等位基因和单体型频率较正常人下降,而LADA-2型与正常组无差异。说明HLA-DQ介导的胰岛β细胞自身免疫损害在LADA-1型的发病中起重要作用,而在LADA-2型的发病中可能仅起次要作用。
除HLA外,尚有胰岛素基因的Ⅰ类数目可变的串联重复序列(VNTR)位点、CTLA-4基因外显子1G等位基因和MICA5等位基因多态性与LADA存在关联。总的来说,由于目前对LADA易感基因的研究多局限于T1DM的相关基因,且与正常人部分重叠,故不能作为LADA诊断的独立指标,仅起辅助作用。
一、各种诊断标准强调的侧重面不同
潘孝仁等的诊断标准将抗体类型、发病年龄、BMI、胰岛功能和基因表型等限制在较窄的范围内,虽然诊断的特异性较高,但在一定程度可能漏诊部分患者(如LADA-2型患者和处于非胰岛素依赖阶段的患者)。池莲祥等增加了诊断的抗体数目,可提高LADA诊断的敏感性。线粒体基因突变糖尿病的临床特征类似LADA,且ICA或GADAb亦可阳性,故提出要加以鉴别和排除。但该诊断标准将患者BMI和胰岛功能等定义在较低水平,故诊断效率偏低。我们将起病年龄划为≥15岁,是基于国际上有分别将<15岁及≥15岁起病的T1DM称为儿童起病型及成年起病型T1DM的惯例,且利于早期发现更多的病例;提出发病后至少6个月内无酮症发生,是为了与成年急性起病的经典T1DM区别。本标准未将BMI、临床症状及胰岛β细胞功能纳入,适于LADA的非胰岛素依赖性阶段及胰岛素依赖阶段的诊断,避免遗漏。原则上建议对所有糖尿病患者均应行胰岛自身抗体的检测,以便早期正确分型。
1.潘孝仁诊断标准
1997年,潘孝仁首先提出的LADA诊断要点:①20~45岁发病,BMI≤25kg/m2,空腹血糖≥16.5mmol/L;②空腹血C肽≤0.4nmol/L,早晨空腹100g馒头餐后1小时或2小时C肽≤0.8nmol/L;③GADAb阳性;④HLA-DQβ1链第57位点为非天门冬氨酸纯合子(易感基因)。其中①是诊断基本点,加上②、③或④任何1点就可考虑诊断LADA。
2.湘雅代谢内分泌研究所诊断标准
1998年,我们综合文献及自己的研究结果,提出LADA早期诊断依据:①发病年龄>15岁而发病6个月内无酮症发生;②发病时非肥胖;③伴甲状腺或胃壁细胞等器官特异性自身抗体;④具有T1DM易感基因;⑤胰岛β细胞自身抗体[GADAb、ICA和/或IAA等]阳性;⑥排除线粒体基因突变糖尿病及青少年起病型的成人型糖尿病(MODY)。具备第①点加上②、③或④点中任何1点则疑诊,具备①、⑤和⑥3点可确诊。
3.池莲祥诊断标准
2001年,池莲祥等提出的诊断标准为:①胰岛β细胞自身抗体(ICA/IAA/GADAb和IA-2A)1种或以上阳性;②胰高血糖素刺激后血清C肽<0.6nmol/L;③体型消瘦,BMI<21kg/m2,6个月内非胰岛素治疗无酮症倾向;④伴甲状腺或胃壁细胞等自身抗体;⑤20岁以上,多在35岁以上发病;⑥排除线粒体基因突变糖尿病及MODY。其中①和②项最为重要。具备①、②、④及⑥4项可诊断为LADA。如仅具备第②~⑤项的1项加其他项则可临床拟诊为LADA,可按LADA处理。
二、根据成年起病/短期不依赖胰岛素/胰岛自身抗体阳性确立LADA诊断
胰岛自身抗体作为β细胞自身免疫的标志物,可区分LADA与T2DM;而诊断糖尿病后一段时间内不依赖胰岛素治疗则可与经典T1DM鉴别。最近,国际糖尿病免疫学会(Immunology Diabetes Society,IDS)试图将LADA的诊断标准化,其建议为:①≥30岁起病;②至少一种胰岛自身抗体阳性(ICAs和GADAb、IA-2A和IAA);③诊断糖尿病后至少6个月不需要胰岛素治疗。LADA筛查和诊断流程见图1。
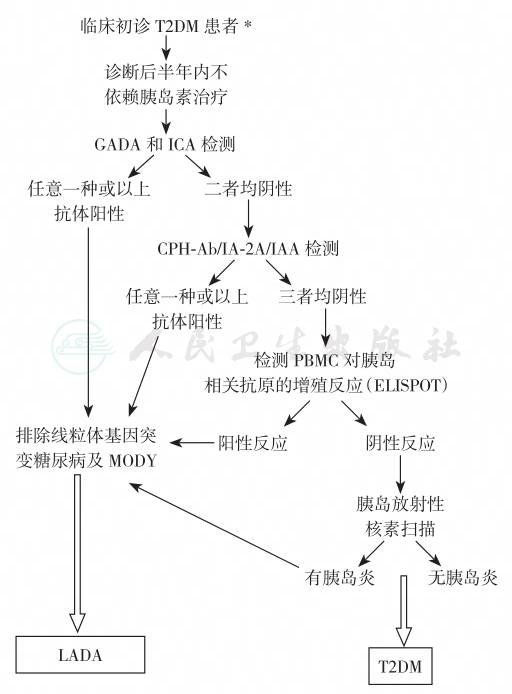
图1 成人隐匿性自身免疫糖尿病的筛查和诊断流程
注:*有条件者,可同时做HLA基因分型和胰岛功能检测,前者有利于进一步诊断LADA,但尚不能作为独立诊断指标;后者可指导临床治疗和估测患者预后。
三、小剂量胰岛素治疗具有合理性
鉴于LADA自身免疫反应可能较弱且其过程较长,其非胰岛素依赖阶段的“治疗窗口”空间较经典T1DM大,为尝试免疫干预措施提供了难得的契机。小剂量胰岛素疗法的合理性和有效性正被进一步证明,其机制与诱导免疫耐受,促使β细胞休息,以减少炎症反应等有关。与之相反,磺脲类药物格列本脲则增加胰岛自身抗原的表达,维持ICA阳性,使LADA患者胰岛β细胞功能减退加速。因此,目前多主张避免使用磺脲类药物治疗LADA。
四、其他药物的疗效有待证实
噻唑烷二酮类药物治疗LADA的潜在优越性受到关注。由于这类药物尚具有抗炎及免疫调节作用,并能降低T1DM动物模型NOD小鼠的发病率及减轻胰岛炎症;初步临床试验提示罗格列酮单用或与胰岛素合用均可保护LADA患者胰岛的β细胞功能。胰岛特异性抗原GAD疫苗为LADA的免疫治疗带来了新的希望。Ⅱ期临床试验表明,皮下注射每次20μg,2次/天,即能保护LADA患者的β细胞功能及改善血糖控制达2年之久。一些资料提示,雷公藤苷可有保留残存胰岛β细胞功能的趋势。维生素D可提高机体免疫力,纠正Th1/Th2失衡,减少胰岛β细胞的炎症损伤,可以抑制NOD鼠T1DM的发生,对使用口服降糖药或使用胰岛素的LADA患者的胰岛β细胞功能均有保护作用。
上述干预措施的机制涉及诱导免疫耐受、免疫抑制及免疫调节等,实验结果尚属初步,亟待大样本和多中心的研究证实。对于新诊断的处于非胰岛素依赖阶段的LADA患者,能否单用生活方式干预,现有口服降糖药中,何类药物(噻唑烷二酮类、双胍类、葡萄糖苷酶抑制剂或非磺脲类胰岛素促泌剂)较好,何种胰岛素给药方案最佳,联合用药是否更好,均有待随机对照研究结果回答。













