英文名称 :esophago-gastric varices
食管-胃底静脉曲张(esophago-gastric varices)是由于门脉高压引起食管和/或胃底静脉血液循环障碍,血流压力增加,导致食管和胃底的静脉扩张、迂回、形成静脉曲张。门静脉既是肝脏血供的重要来源,其本身又是具有相对独立的静脉系统。门静脉两端起始部均是毛细血管:一端是小肠、大肠、胰、脾、胃等脏器的毛细血管网,而另一端为肝小叶内的肝窦(血窦、窦状腺),除胃肠端毛细血管有括约肌以控制逆流外,其余血管和交通支都缺乏瓣膜,因此当门静脉压力超过正常时,门静脉脉血便可逆流而产生门体分流。当门静脉压力超过1.96kPa时,即可形成食管-胃底静脉曲张。曲张的静脉一旦破裂大出血,来势迅猛,病情凶险,病死率高达40%~70%。认识食管-胃底静脉曲张的病因和病理生理,及时作出确切诊断,并积极采取有效的治疗措施,以缓解门脉高压,消除曲张静脉,防止反复出血,改善肝功能和患者预后已成为消化科医生的重要任务。
食管-胃底静脉曲张是由各种原因引起门脉高压所导致。门脉高压现有多种分类方法,或根据发病机制或以疾病的解剖部位进行划分,也有将发病机制和发病部位相结合进行分类,目前多以发病部位分类为主。
(一)发病机制为主要依据的分类
门脉高压症的发病机制包括两个方面:门静脉血流阻力增加和门静脉血流量增加,从而分为二大类:引起门静脉血流阻力增加的疾病或病因,以及引起门静脉血流量增加的疾病或病因见表1。
表1 门脉高压症的发病机制分类(Bass,Von Dyke)

采用这一分类方法的优点是:分类完全,界限清楚。与按解剖部位分类法(如窦前性、窦性、窦后性)相结合,血流动力学测定方法所测得的血流动力学改变在各类门脉高压症具有明显差异,与临床实际联系紧密,有助于临床诊断和鉴别诊断。
(二)以发病部位为主要依据的分类
按发病部位进行病因划分是目前所普遍采用的分类方法(表2)。
表2 门脉高压症的发病部位分类(Groszmann 和Jensen,1996)

1.食管-胃底静脉曲张的解剖学基础
正常情况下,食管-胃底静脉引流较为复杂,而食管本身的黏膜静脉丛交汇就构成门-腔静脉汇合途径之一。当门静脉回流障碍而导致门静脉高压时,胃左、短静脉发生逆流,使门静脉血经胸、腹段食管交通支回流入半奇、奇静脉及上腔静脉,食管静脉由于血流压力增加而扩张、迂曲、形成食管静脉曲张。
门静脉系统无静脉瓣,其血流方向主要依其压力梯度决定。食管静脉及胃底静脉离门静脉梗阻部位最近,因而也最易受其影响。由于食管-胃连接部血管压力最高,故静脉曲张最显著,向上则压力逐渐下降,故曲张静脉呈阶梯状变细。
下列因素对食管-胃底静脉曲张的形成及其破裂出血有重要作用:①食管-胃底黏膜下层结构不甚坚固,支持作用较差;②吸气时胸腔内呈负压,使胃左、短静脉不断被吸入食管静脉,使过度充盈的静脉进一步扩张;③反胃、恶心时胃酸易侵蚀食管下段的曲张静脉,损伤黏膜,发生糜烂,溃疡和破裂。
2.门脉高压的发生机制
门静脉压力(PVP)与门静脉的血流量(Q)和门静脉阻力R 成正比,即PVP =QR,正常情况下,门静脉的血流由肠道静脉血流来决定。
(1)门静脉血流增加和高动力循环:当肝脏正常时,门静脉血流的增加并不能引起门脉高压。但当门脉阻力增加后,门脉血流的少量增加就会引起门脉压力的明显增高。肝硬化病人的门脉血流是增加的,因为肝硬化门脉高压症存在着明显的高动力循环。体液因素在高动力循环中起重要作用,与之相关的体液因子包括一氧化氮、胰高糖素、前列腺素,腺苷等。全身血容量的增加是维持门脉高压高动力循环的重要因素。此外,动物实验显示血容量的增加可以导致侧支循环的形成。
(2)门静脉阻力的增高:血管阻力增加是引起门脉高压最常见的原因。肝硬化时主要通过以下机制引起门脉血管阻力增加:①肝窦毛细血管化;②肝细胞肿胀;③肝纤维化和再生结节破坏肝脏结构,压迫肝静脉和门静脉。除肝内阻力增加外,门脉侧支循环阻力增加也是引起门脉高压的原因之一。肝硬化病人的门脉压力主要由门脉、肝脏和门脉侧支循环的阻力以及内脏血流量之间的相互作用、影响来调节。
总之,门脉高压的起始因素是门脉血流阻力的升高,而内脏高动力循环造成的门脉血流增加是维持和加剧门脉高压的重要因素。
食管-胃底静脉曲张患者多数有慢性肝病、肝硬化的病史和临床表现,或有引起门脉高压的肝前因素或肝后因素,这是诊断的重要依据。应用于诊断食管-胃底静脉曲张的辅助检查方法包括X 线检查、内镜检查、超声检查、放射性核素造影检查、门静脉造影、食管静脉压力测定和超声内镜检查等,其中以内镜检查最有价值。
1.钡餐检查
食管静脉曲张的部分均在主动脉弓以下,钡剂在黏膜上分布不均,呈虫蚀样或串珠样充盈缺损,当食管蠕动时常可以消失。轻度曲张静脉局限于食管下段,表现为黏膜皱襞稍增宽,管腔边缘稍不平整,可呈浅锯齿样表现;中度曲张静脉范围超过下段累及中段,正常平行的皱襞消失,代之以纵行粗大的结节样条状影,进一步表现为串珠状或蚯蚓状充盈缺损;重度静脉曲张扩展到中上段,甚至食管全长,腔内见形态不一的圆形、环状或囊状充盈缺损,缺损相互衔接如虫蚀状。胃底静脉曲张典型表现为皂泡样至葡萄串样充盈缺损,严重时可呈分叶状软组织影。钡剂检查时一般不会出现假阳性,但漏诊及误诊可高达50%,因此必要时须多次拍片或重复检查。部分食管静脉曲张者可同时存在胃底静脉曲张,对无食管静脉曲张者应仔细检查胃底,有时可以根据胃底的静脉曲张作出诊断。
2.内镜检查
内镜检查常可见到食管黏膜下有3~4条粗大、迂曲与食管长轴平行的蓝色血管或可见到有活动性出血点。内镜下可直接观察食管和胃底有无曲张静脉存在,判断静脉曲张的程度和范围,并可同时在内镜直视下进行局部止血、注射硬化剂或套扎术等治疗。文献报道肝硬化患者80%以上有门脉高压,50%确诊时内镜检查有食管静脉曲张,而病史10年以上者,食管静脉曲张发生率高达90%。食管-胃底静脉曲张破裂出血(EGVB)的平均死亡率为30%,2年内再出血率高达70%,再出血平均死亡率也高达30%。EGVB 是引起肝硬化死亡的主要并发症,因此对食管-胃底静脉曲张行分级并预测出血率对防治EGVB 具有重要意义。
门脉高压时食管-胃底静脉曲张的内镜描述尚无统一规定。1991年日本内镜学会加入经硬化剂治疗后曲张静脉的内镜表现:①根据曲张静脉部位(Location,L):Ls-上段,食管起始至25cm;Lm-中段,气管分叉至食管胃交界(25~32cm);Li-下段,食管胃交界即齿状线处(32~40cm);Lg-胃底静脉曲张,根据曲张静脉的部位又可进一步分为Lg-c:曲张静脉位于贲门口附近;Lg-f:胃底穹窿部孤立的静脉瘤;Lg-cf:贲门口附近及穹窿部均有曲张静脉;②根据曲张静脉形态(form,F):F1-曲张静脉呈直线形或蛇行状;F2-静脉呈串珠状;F3-静脉呈结节状。新近有人将经治疗后消失的曲张静脉或内镜下不甚明显的血管称为F0;③根据曲张静脉基本色调(fundamental color,C):白色(Cw)-曲张静脉与周围食管黏膜颜色相同;蓝色(Cb)-呈青蓝色或浅蓝色。经注射治疗后血栓化(thrombosis)的曲张静脉可以Cw-Th或Cb-Th记录;④根据曲张静脉红色征(red color sign,RC):红色征是指曲张静脉表面黏膜的红色征象,有红色条纹(red wale marking,RWM);樱桃红斑(cher y-redspot,CRS);血泡样斑(hematocystic spot,HCS)。RC 可以分级记录,如RC(-):无红色征;RC(+):局限性红色征;RC(+++):弥漫性红色征;RC(++):介于(+)和(+++)之间;⑤根据曲张静脉出血征(bleeding sign):可根据活动性出血的形式分为喷射性出血(spurting bleeding)及渗血(oozing bleeding);出血已停止者可记录为红色血栓(red plug)或白色血栓(white plug);⑥根据曲张静脉周围黏膜所见:E:充血、糜烂;Ul:溃疡形成;S:瘢痕形成,存在或不存在以(+)或(-)记录。
从临床实际出发,国内按Palmer 分级法,依据食管曲张静脉的范围、形态、粗细分成三级:曲张静脉横径<3mm,在贲门附近部分呈囊状(Ⅰ级);曲张静脉横径3~6mm,曲张静脉长度超过气管分叉,呈葡萄状,食管管腔呈部分狭窄(Ⅱ级);曲张静脉横径>6mm则定为Ⅲ级。目前临床上多以曲张静脉的粗细为简易分级方法:轻度为<3mm,中度3~6mm,重度>6mm。
胃底静脉曲张参考Sarin 法分为四型:①胃食管曲张静脉Ⅰ型(GOV-Ⅰ),食管曲张静脉延续至胃底小弯侧,多在近贲门2~5cm范围内,呈轻度曲张;②胃食管曲张静脉Ⅱ型(GOV-Ⅱ),食管曲张静脉延续至胃大弯侧,曲张明显呈结节样,范围较广;③单纯胃静脉曲张Ⅰ型(IGV-Ⅰ),无食管曲张静脉,位于胃底贲门下数厘米,呈迂曲结节样;④单纯胃静脉曲张Ⅱ型(IGV-Ⅱ),无食管曲张静脉,位于胃内任何部位的静脉曲张。胃底静脉曲张伴出血的内镜诊断标准:胃底静脉曲张表面见活动性出血、或出血点或凝血块、或表面局部红肿糜烂而无食管及胃肠其它病变出血征象。
内镜下曲张静脉征象可协助判断破裂出血的危险性:①曲张静脉的宽度与出血的危险性相关,食管静脉直径>5mm者出血的危险性较直径<5mm者显著增加,中、重度曲张者出血发生率达50%~80%以上;②静脉曲张范围越广泛,出血机会越多;③曲张静脉出现红色征,往往预示即将出血。
3.超声诊断
对门脉高压的诊断有重要价值。通过B 超可以发现肝脏形态和大小的异常,肝实质回声不均匀,脾大和腹水等肝硬化表现,并可进行病因诊断。门静脉和脾静脉增宽有诊断意义。彩色多普勒血流显像(CDFI)可以显示门静脉及其主要侧支循环,对其形态及门静脉血流流速、流量和方向进行评价和测定。应用CDFI 还可以方便地初步判断门脉高压的类型,根据其阻塞部位可以分为肝前型、肝内型和肝后型3种类型。日本学者提出,用CDFI 测定冠状静脉的直径和血流量可预测食管静脉曲张破裂出血的可能程度和时间。
4.放射性核素造影诊断
核素扫描的方法很多,用于食管-胃底静脉曲张的主要有门-体侧支分流测定。包括:①99mTc-过锝酸盐直肠-门静脉显像;②201Tl直肠-门静脉显像等。其能定量评价门静脉侧支分流,有助于判断肝硬化门脉高压的病理生理状态和临床严重程度,并预测肝性脑病、曲张静脉破裂出血等并发症的发生。术前为选择分流手术者提供参考,术后提供手术及药物疗效。
5.门静脉造影
分为直接及间接门静脉造影术。直接法包括:经皮经肝穿刺门静脉造影术、经脾穿刺门静脉造影术、经颈静脉肝内门静脉造影术、术中直接测定等。间接法包括经肠系膜上动脉的间接门静脉造影术及经脾动脉的间接门静脉造影术。
门静脉造影可直接显示出食管静脉、胃冠状静脉、胃静脉,肠系膜下静脉等侧支循环的开放,及静脉扩张、迂曲的范围和程度。同时可行门静脉、肝静脉压力测定,门静脉及侧支循环血流测定等。对研究门脉高压的病理生理变化,诊断门脉高压,鉴别门脉高压的类型,估计肝脏血流及门体侧支循环。预测食管静脉曲张出血的危险性及评估药物疗效均有很大帮助。近几年来,随着非创伤性技术的应用,使得创伤性血管造影技术的应用日益减少,现主要用于门脉减压手术患者术前术后的评价,以及需要行门脉压测定的研究中。
6.经内镜食管静脉压力测定(EVP)
包括直接穿刺测压及内镜压力计测压2 种。内镜下穿刺食管曲张静脉可直接测定静脉压,EVP的高低一般与PVP成正比。EVP测定主要用于预测食管静脉曲张出血的危险性(EVP<1.96kPa 时常不发生出血)以及评价药物治疗和硬化治疗的反应。但操作时食管蠕动会影响结果,且穿刺易引起出血,一般仅限于硬化症时。
使用内镜下压力计直接测定EVP,不必穿刺曲张静脉,能准确测定静脉内压,具有非创伤性,不受门脉高压类型影响等优点,且无诱发食管静脉曲张出血的危险。但由于技术本身存在一系列问题,阻碍了EVP测定的广泛临床应用,使得其目前还仅被作为一项研究工具。
7.超声内镜检查
正常食管的超声内镜图像为5层结构:界面反射、黏膜层、黏膜下层、肌层及外膜层。食管静脉曲张时超声内镜探查可见第3层增厚,其中可见到低回声的静脉管腔是呈椭圆形或圆形。有时在第1、2层亦可见到低回声的小圆形影像,多为曲张静脉表面的扩张小血管(可形成红色征)。硬化剂治疗后静脉形态固定、血栓形成,内部回声增强(中低水平)。随时间的推移,硬化后的食管黏膜和黏膜下层纤维化,增厚,可为正常食管厚度的3倍。增厚的食管黏膜可持续较长时间,可防止再出血的发生。
8.其他
磁共振血管显像(MRA)作为无创和精确的血流动力学监测方法,已越来越多的应用于临床,主要用于经颈静脉肝内门体分流术(TIPS)术后疗效监测,以及监测门静脉、肝静脉、腔静脉等的血流状态和血管形态。
(一)食管胃底静脉曲张破裂出血的初级预防
静脉曲张破裂出血的初级预防是针对尚无静脉曲张或有静脉曲张但未发生过出血的患者,目的是抑制曲张静脉的形成和进展,预防首次出血。这部分患者出血及死亡的风险相对较低,因此对应的治疗措施应是最低损害性的。
1.病因处理
引起肝硬化的病因包括病毒性肝炎、酒精性、胆汁淤积性、自身免疫性、遗传代谢及药物性肝病等,应重视对其病因的治疗。病毒感染是我国肝硬化的主要病因,抗病毒治疗可减轻肝纤维化,降低门静脉压力,从而起到预防静脉曲张发生或出血的作用,具体抗病毒方案参考相关指南。其他原因所致肝病也应针对病因进行治疗,以阻止肝硬化的进展,从而延缓门静脉高压等并发症的出现。
2.降低门脉压力的药物
目前治疗静脉曲张性出血的药物大部分是通过收缩内脏血管、减少门静脉血流,从而达到降低门脉压力的作用。这类药物包括:非选择性β受体阻滞剂(NSBB)、血管加压素及其类似物特利加压素、生长抑素及其类似物奥曲肽和伐普肽。除血管收缩剂外,血管扩张剂也能通过扩张肝内血管降低门脉压力。但是,目前大部分血管扩张剂,尤其是硝酸酯类药物(研究最多),不仅仅扩张肝内血管,也潜在有害的全身血管扩张作用。同时,有研究认为全身血管扩张导致的低血压会反射性地引起内脏血管收缩,而这是硝酸酯类药物降低门脉压力的主要原因,而非单纯的肝内血管扩张。一项预防静脉曲张首次出血的随机对照试验表明,硝酸酯类药物比安慰剂有更高的出血率。因此,硝酸酯类药物单独应用不适用于门脉高压的防治,但在某些情况下与非选择性β受体阻滞剂联合应用可发挥一定的作用。
在静脉曲张的初级预防中,药物预防主要是指非选择性β受体阻滞剂的应用。其作用机制包括:①阻断β1受体,使心率减慢、心输出量降低,致内脏循环血容量减少,从而降低门脉血流量和门脉压力;②阻断内脏血管β2受体,使其α受体兴奋性增加,内脏血管收缩占优势,致门静脉和肝动脉血流量减少,从而降低门脉压力;③选择性减少奇静脉血流量,明显减少曲张静脉血流量,从而降低曲张静脉的腔内压和管壁的张力,防止破裂出血。常用的非选择性β受体阻滞剂包括普萘洛尔和纳多洛尔,具体的用药剂量及方案见表3。药物禁忌证包括窦性心动过缓、支气管哮喘、慢性阻塞性肺部疾病、心功能衰竭、低血压、房室传导阻滞、胰岛素依赖性糖尿病、外周血管病变、肝功能Child C级、急性出血期。不良反应包括头晕、乏力、呼吸困难、性功能障碍等。药物应答的标准为HVPG下降至12mmHg以下或较基线水平下降>20%。若不能检测HVPG,则应使静息心率下降到基础心率的75%或静息心率达50~60次/分。
表3 静脉曲张出血的初级预防
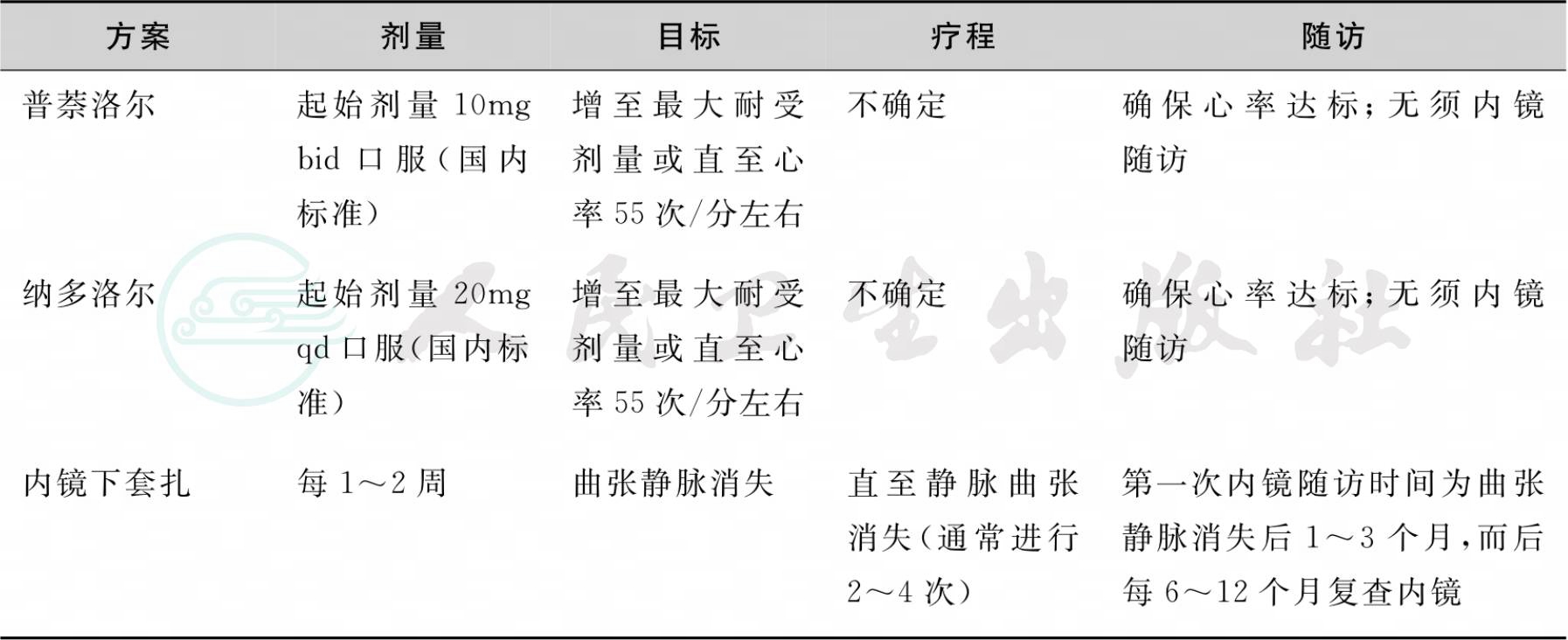
* 注:*初级预防时只能选择其中一种。
非选择性β受体阻滞剂的优点是费用低、无技术要求,而且能预防其他并发症,如门脉高压性胃病、腹水、自发性细菌性腹膜炎等。缺点则是相对普遍的禁忌证和副作用,常导致15%~20%的患者药物治疗无法进行或不能继续。
3.内镜下治疗
在曲张静脉的初级预防中,内镜下治疗主要是指内镜下曲张静脉结扎(EVL)。目前常用的是多环皮圈连续结扎器,从胃食管连接部开始,螺旋向上结扎5~8cm。曲张静脉要达到基本消除一般平均需3次结扎(每隔1~2周一次)。EVL的优点是在内镜筛查或复查时可立即进行,且副作用较少。缺点是对技术要求比较高,也可引起治疗后溃疡,从而存在潜在的出血危险。虽然有几项荟萃分析显示EVL比NSBB有更有效的初级预防疗效,但亦有学者在纳入了随访时间较长、研究样本较多的临床试验后,发现二者在控制首次出血的疗效上并无显著性差异。NSBB不良反应率稍高,而EVL的不良反应较严重。多项荟萃分析表明,两者的死亡率无显著差异。因此,EVL和NSBB都可以作为初级预防的首选方案,具体选择需依据各级医院的医疗资源、专业技术水平、患者的用药情况和个人倾向等因素。
4.不同程度静脉曲张的预防措施
对于无静脉曲张的患者,不推荐使用非选择性β受体阻滞剂预防出血。一项多中心随机对照试验显示,对无静脉曲张的患者使用非选择性β受体阻滞剂,并不能阻止静脉曲张的进展以及曲张静脉破裂出血。
(1)小静脉曲张患者处理
非选择性β受体阻滞剂可能减慢曲张静脉的进展,对有破裂出血史者再出血的预防有一定作用,但长期益处尚未得到证实。出血风险较低(Child A级,而且无红色征)者,β受体阻滞剂应用与否并非强制性。但未使用β受体阻滞剂者,应考虑每1~2年复查胃镜;若有肝脏失代偿的证据,应考虑每年复查胃镜。出血风险较大(Child B/C级或有红色征)者,推荐使用非选择性β受体阻滞剂预防首次静脉曲张出血。
(2)中/大静脉曲张无出血史患者的处理
出血风险较大(Child B/C级或有红色征)者,推荐使用非选择性β受体阻滞剂或内镜下曲张静脉结扎(EVL)预防首次静脉曲张出血。出血风险不大(Child A级,而且无红色征)者,首选β受体阻滞剂。如β受体阻滞剂有禁忌证、不能耐受或治疗依从性差,则应行内镜下曲张静脉结扎。
(二)急性静脉曲张破裂出血的治疗
近年来急性静脉曲张性出血的死亡率逐渐下降,主要归功于治疗措施的改进和发展,如预防性抗生素的使用、内镜下曲张静脉结扎和更有效的血管收缩剂的使用等。标准的治疗方案包括一般处理和特殊处理(药物治疗、内镜下治疗以及介入治疗和手术等),诊治流程见图2-4。目前尚缺乏基于死亡风险程度推荐的不同治疗方案,但有证据显示,对高风险组(Child C或HVPG>20mmHg),需要更强有力的治疗措施。
1.一般处理
静脉曲张出血的一般处理与其他原因所致的上消化道出血相同。中等量及大量出血的患者应尽快恢复血容量,根据出血程度确定扩容量及液体性质,以维持血流动力学稳定,并使血红蛋白水平维持在80g/L左右。需要强调的是,血容量恢复要谨慎,不推荐补足所有丢失的血液,否则会增加门静脉压力,增加再出血和死亡的危险性。应避免过度的氯化钠补充,因其会加重或促成腹水形成和其他血管外液体积聚。要纠正凝血功能异常,包括补充凝血酶原、血小板等。此外,静脉曲张出血患者因大量呕血而存在发生吸入性窒息的危险,应及早做出是否气管插管保护气道的决定,尤其是同时并发肝性脑病的患者。肝硬化患者并发上消化道出血者易并发严重的细菌感染,如自发性细菌性腹膜炎或其他感染。不论是否存在腹水,早期均应短期应用抗生素以预防感染,有助于减少再出血及提高生存率。推荐使用的抗生素包括喹诺酮类或第三代头孢类药物。
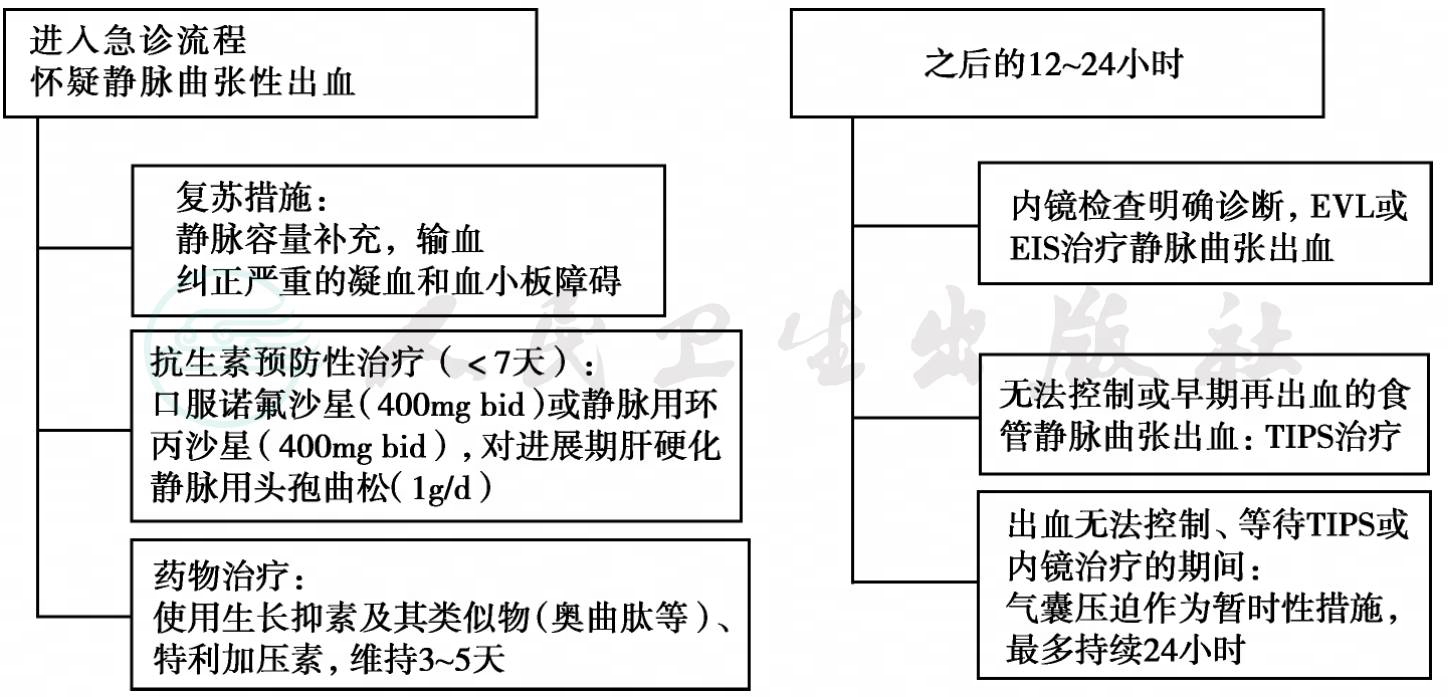
图1 急性静脉曲张性出血处理流程(世界胃肠病组织,2008年)
2.药物治疗
药物治疗是急性静脉曲张性出血的首选治疗手段,主要药物是血管收缩剂,包括血管加压素、特利加压素、生长抑素和奥曲肽等。β受体阻滞剂有降低血压的作用,且会抑制和干扰血容量丢失所致的心率上升,因此在急性出血期不宜使用。一旦怀疑食管胃底静脉曲张性出血,内镜检查证实前就应该应用血管活性药物。2012年发表的包含30项研究3111例患者的荟萃分析结果显示,与其他方法相比,血管活性药物的应用可降低7天内的死亡率,改善止血、降低输血需求(平均差-0.70个单位)和缩短住院时间(平均差-0.70天)。
(1)血管加压素(VP)
是最强有力的内脏血管收缩剂,能收缩所有的内脏动脉血管,减少门脉血流,降低门静脉压力和曲张静脉压力。除直接的血管效应外,VP通过收缩食管平滑肌降低胃食管血流,增加下食管括约肌的张力,压迫黏膜下血管。VP的全身血管效应是其产生副作用的主要原因,副作用包括心脏及外周器官缺血、心律失常、高血压、肠缺血等。合用硝酸酯类药物可降低不良反应和提高疗效,但联合用药的不良反应仍高于特利加压素、生长抑素及类似物。因此,为减少不良反应,静脉持续使用最高剂量血管加压素的时间不应超过24小时。具体用法为0.2~0.4U/min连续静脉泵入,可同时静脉联合应用硝酸酯类药物,并保证收缩压>90mmHg。特利加压素是合成的血管加压素类似物,可较持久有效地减少门静脉血流量、降低门静脉压力,且副作用较小。特利加压素的推荐起始剂量为2mg/ 4h静脉输注,出血控制后可改为1mg/4h静脉输注,一般维持3~5天,以预防早期再出血。
(2)生长抑素及其类似物奥曲肽和伐普肽
也能有效地收缩内脏血管,安全性高。生长抑素的具体用法为:首剂负荷量250μg静注,之后250μg/h持续静脉滴注维持。与硝酸甘油联用不能加强疗效,会增加不良反应。奥曲肽是人工合成的八肽生长抑素类似物,它保留了生长抑素的大多数效应,半衰期更长。其用法为起始剂量50μg,之后50μg/h持续静脉滴注维持。荟萃分析显示,奥曲肽和生长抑素在止血疗效和死亡率上无显著差异。但也有研究表明,生长抑素和奥曲肽虽然在大剂量注射后都能明显降低门脉压力,但奥曲肽在连续静脉应用后容易产生快速“脱敏”,无法有效维持疗效。伐普肽(国内尚未上市)是新近人工合成的生长抑素类似物,用法为起始剂量50μg,之后50μg/h静脉滴注维持。
3.内镜下治疗
疑为曲张静脉性出血者,即使在第一时间采取了安全有效的药物治疗,也应该在入院后尽早安排诊断性EGD检查,并在确诊后采取内镜下治疗。具体治疗手段包括内镜下曲张静脉结扎(EVL)、硬化剂治疗(EIS)以及组织黏合剂(如N-丁基-2-氰基丙烯酸酯)注射治疗,见表4。其目的是控制急性静脉曲张出血,并尽可能使静脉曲张消失或减轻,以防止再出血。药物联合内镜治疗可提高止血成功率,是目前治疗急性静脉曲张出血的最有效手段。
荟萃分析显示,控制急性出血时EVL的疗效显著高于EIS,因此首选EVL治疗。对于胃底静脉曲张出血患者,应使用组织黏合剂进行内镜下闭塞治疗,在某些情况下也可考虑用EVL治疗。与EVL相比,组织黏合剂治疗控制首次出血更有效,且能显著降低再出血的概率。无法进行组织黏合剂治疗、出血控制失败,以及内镜联合药物治疗后再出血时,介入治疗也可作为控制胃静脉出血的治疗措施。
表4 食管胃静脉曲张内镜下治疗

注:EVL:内镜下曲张静脉结扎;EIS:内镜下硬化剂治疗
4.气囊压迫
气囊压迫可使60%~90%的患者出血得到暂时控制。一般先行胃囊充气、牵引压迫,如果出血未止可再行食管囊充气。气囊压迫止血的出血复发率高(可高达50%),并发症率也较高。并发症包括吸入性肺炎、气道阻塞、食管坏死/穿孔等,与此相关的死亡率高达20%。因此,目前气囊压迫限用于出血控制失败、后续治疗(如内镜下治疗、介入治疗)前的过渡疗法,为进一步的内镜止血或介入治疗争取时间。进行胃气囊压迫时,应每6~8小时根据病情放松牵引一次(食管囊未充气);食管囊充气时,食管连续压迫时间不得超过6小时。出血停止后,气囊放气,观察24小时后拔除气囊。
5.介入治疗及手术
急性静脉曲张出血时,尽管采取了及时的内镜-药物联合治疗,仍有10%~20%的患者出血无法控制或发生早期再出血。入院24小时内测得HVPG>20mmHg者,保守治疗失败的概率大大增加。门体静脉分流术(介入治疗或手术)能在短期内明显降低门静脉压,控制急性出血及减少再出血,因此是保守治疗失败者拯救生命的重要手段。
常用的介入治疗为经颈静脉肝内门体分流术(TIPSS),其适应证及禁忌证见表5。与外科门体分流术相比,TIPSS具有创伤小、成功率高、降低门静脉压力效果可靠、可控制分流道直径、能同时行断流术(栓塞静脉曲张)、并发症少等优点。TIPSS对静脉曲张破裂出血的即刻止血成功率超过90%,且对再出血的持久控制效果显著大于内镜下治疗。影响疗效的主要因素是术后分流道狭窄或闭塞,常发生在术后6~12个月。此外,TIPSS治疗后会导致20%~25%的患者肝性脑病加重。
亦有几项随机对照试验表明,对高风险患者,即HVPG>20mmHg或评分介于10~13分的Child C级者,早期(入院24~48小时内)采取TIPSS治疗不仅提高治疗成功率且能显著提高生存率。是否需要对高风险组早期应用TIPSS治疗,仍需要进一步研究和确认,但肯定的是,拯救无法控制的大出血时TIPSS选择的时机是越早越好。
外科分流手术与TIPSS疗效近似,但易导致肝性脑病,并且增加后续肝移植治疗的难度。与内镜治疗相比,手术分流能有效控制出血及降低再出血率,但并未改善生存率。Child A级者行急诊分流手术可挽救生命;Child B级者多考虑实施急诊断流手术;Child C级者决定手术应慎重(死亡率≥50%)。
表5 TIPSS治疗适应证及禁忌证

(三)再出血的预防
急性静脉曲张出血后,患者发生再出血和死亡的风险很大。未经治疗的患者,1~2年内出血复发率平均为60%,死亡率约为33%。因此,预防再出血(二级预防)是出血后治疗的基本出发点。首次出血成功挽救后且至少24小时无再出血迹象者,即可开始进行二级预防治疗。具体措施包括内镜下治疗、药物治疗、TIPSS或分流手术、肝移植。其中,内镜下曲张静脉结扎联合药物治疗是标准治疗方案。采取TIPSS或分流手术控制急性出血者,不需要进一步预防治疗。
1.药物预防
多项荟萃分析显示,非选择性β受体阻滞剂(NSBB)能降低再出血率和总体死亡率。研究分析显示,NSBB与硬化剂治疗(EIS)的疗效在再出血率和死亡率控制方面无显著性差异,但EIS治疗的不良反应率高且严重。
NSBB与硝酸酯类药物(如5-单硝酸异山梨酯,ISMN)联用,能协同降低门脉压力,理论上能更有效地降低再出血风险。有研究比较了ISMN和NSBB联用与NSBB单用的效果,但结果不一。从药物联合治疗和内镜治疗对比的文献中,可以间接得出药物联合相对于NSBB单用的优势:对照研究表明,纳多洛尔联用ISMN,疗效优于EIS;有荟萃分析表明,联合药物治疗和EVL相比,再出血率和死亡率无明显差异。综合随机对照试验数据的分析显示,药物联合治疗能将再出血率平均控制在33%~35%,小于NSBB治疗42%~43%的再出血率。联合药物治疗似乎比单独应用更有效,但相应的副作用也可能更大。
2.内镜下治疗进行预防
内镜下治疗预防再出血的方法包括曲张静脉结扎(EVL)和硬化剂治疗(EIS)。EIS能有效地降低再出血和死亡风险。通常4~6次治疗后,曲张静脉能基本消除,但是消除后1年内曲张静脉复发的概率较高(40%)。严重并发症包括吞咽困难、食管狭窄和治疗后食管溃疡,而食管溃疡引起的再出血能达到所有再出血原因的14%。如前面所述,EIS相比于药物治疗无显著优势,而且相关副作用却更严重,因此在EVL出现后,EIS逐渐被EVL替代。在15项EVL和EIS对照的临床试验的基础上,EVL的优势显著:再出血控制更有效,并发症相对少且轻微,患者死亡风险更低。因此,二级预防时的内镜治疗应首选EVL治疗。临床上应避免EVL与EIS联用,否则不仅不能提高临床疗效,而且更容易引起严重并发症如治疗后食管狭窄等。EVL治疗时,每隔1~2周重复一次,直至曲张静脉消失。据文献报道,EVL治疗后再出血率平均为32%,并发症发生率平均为14%,不过通常较轻微。最常见的并发症为一过性吞咽困难、胸部不适。
3.药物联合内镜治疗
内镜治疗期间、曲张静脉消失前,非选择性β受体阻滞剂能起到一定的预防曲张静脉出血的作用;内镜治疗成功后,非选择性β受体阻滞剂亦能预防曲张静脉再发。有两项随机研究将药物-内镜联合治疗与EVL单独治疗进行了对比,发现两者在总体再出血率(23%vs 47%)及静脉曲张相关再出血率(14%vs 38%)上都有显著性差异,而在死亡率上无显著区别。药物-内镜联合治疗与药物治疗对比的荟萃分析发现,联合治疗在控制总体再出血率和静脉曲张相关再出血率方面都有显著性优势。
总之,EVL与NSBB联合应用是最理想的二级预防措施。如初级预防时或第一次二级预防时单独应用EVL或药物治疗后发生再出血,进一步预防再出血时应首先选用内镜与药物联合疗法。同时,可通过HVPG监测治疗效果。患者药物治疗后若HVPG下降至12mmHg以下或较基线水平下降>20%,再出血率会显著降低(约10%)。也有学者认为,最适合的二级预防方案亦可根据HVPG应答情况进行调整。药物治疗应答者,可不进行内镜下治疗。
4.介入及手术治疗
外科手术指征为反复出血内科治疗无效、全身情况能耐受手术的Child A级患者。随着药物发展和内镜治疗技术的进步,肝硬化门静脉高压症外科手术治疗例数明显减少。分流手术在降低出血风险方面非常有效,但大大增加了肝性脑病发生率,死亡率并无改善。同样,有荟萃分析比较了TIPSS与内镜下治疗预防再出血的效果,亦得到了相同的结果:尽管TIPSS更有效地降低了再出血率,但是肝性脑病发生率明显上升,最终两组间死亡率无显著性差异。而且,有临床试验表明,药物治疗(普萘洛尔与硝酸酯类药物联用)与TIPSS相比,尽管前者的再出血率控制效果相对欠缺,但费用及肝性脑病发生率大大降低,生存率明显提升。因此,TIPSS不适合作为预防再出血的一线治疗方案,可用于内镜及药物联合治疗失败后的拯救措施或作为肝移植前的过渡手段。近年来,聚四氟乙烯(PTFE)覆膜支架广泛应用于临床,明显降低了TIPSS术后再狭窄及血栓形成率,可提高远期效果,但需进一步临床对照研究证实。有研究显示在药物和内镜治疗无效的Child A级和B级患者中,TIPSS与远端脾肾分流术具有相同的再出血控制疗效、肝性脑病发生率和死亡率。具体分流措施的选择,应根据各医院的具体情况制定。
5.肝移植
理论上,肝脏移植是治疗终末期肝病最有效的方法。Child B级和C级的患者,如果条件许可,可以考虑肝移植。













