英文名称 :bipolar disorder
中文别名 :双相情感障碍;躁郁症
双相障碍(bipolar disorder)亦即双相情感障碍,过去被称为躁郁症(manic-depressive psychosis),是指既有躁狂或轻躁狂发作,又有抑郁发作,或2次及以上的躁狂、轻躁狂发作的一类心境障碍。典型躁狂发作时,患者表现为情感高涨、思维奔逸和意志行为增强的“三高”症状,典型抑郁发作时,患者出现情绪低落、思维迟缓和意志行为减退的“三低”症状;病情严重的患者可伴有幻觉、妄想。
双相障碍的病因和发病机制尚不清楚。目前认为遗传与心理社会因素均有重要作用,其中遗传因素的影响更为突出。这些因素可能通过影响中枢神经信息传递等过程,导致躁狂或抑郁症状。
家系研究表明,双相障碍患者子代的患病风险是25%,如双亲均患双相障碍,则子代的患病风险高达50%~75%。单卵双生子双相障碍的同病率为80%,双卵双生子为24%,患有双相障碍的亲生父母所生寄养子的患病率高于正常亲生父母所生寄养子的患病率。上述说明,遗传因素在双相障碍发病中的影响远甚于环境因素。
神经生化机制研究表明,多种神经递质(5-HT、NE、DA、GABA、ACh等)及相应受体功能紊乱与双相障碍发病有关,其中5-HT和NE与双相障碍关系最为密切。无论抑郁还是躁狂,5-HT都呈现缺乏状态,但仅有5-HT缺乏并不一定导致疾病,需有NE异常才会表现出临床症状。NE异常可能是双相障碍的状态标记,NE不足出现抑郁症状,亢进则出现躁狂症状。但也存在与上述观点矛盾的研究报道。线粒体功能失调与双相障碍发病有关。双相障碍患者的下丘脑-垂体-肾上腺轴(HPA轴)呈现过度活跃状态。影像学改变主要涉及额叶、基底节区、扣带回、杏仁核、海马等与认知和情感调节关系较密切的神经环路损害,也涉及这些脑功能区皮质下白质的微观结构变化,从而出现皮质和皮质下连接损害及脑功能连接损害。
此外,神经免疫炎症反应说、肠道菌群说在近年来均得到广泛研究。双相障碍患者存在免疫相关基因多态性、基因表达、促炎症因子上升、抗炎因子下降等改变。目前有脑-肠轴的神经交互通路、脑-肠轴的神经内分泌-HPA轴途径等假说。
应激和负性生活事件,如离婚、失业、严重躯体疾病以及社会经济状况差等心理社会因素在双相障碍的发生、发展中起到了重要作用。
看起来完全相反的症状会发生在同一个患者身上,古代人就有认识和记载。早在公元前1世纪,希腊医生Soranus发现患者在一次发作中同时存在躁狂和抑郁,而且这些不同的情绪会交替发作。我国明朝著名戏曲作家高濂在其养生著作《遵生八笺》中也记录了躁郁症患者的表现。1896年克雷丕林将该病命名为躁狂抑郁性精神病,1957年德国医生Leonhard提出了单相(仅有抑郁发作)、双相情感障碍的概念。1980年,双相情感障碍取代躁狂抑郁症,写入了美国《精神障碍诊断和统计手册(第3 版)》(DSM-Ⅲ)中。
双相障碍是一类严重的精神障碍,影响大约4%的世界人口,成为导致青少年和青年人致残的第四大疾病。中国精神卫生调查显示,双相障碍12个月患病率为0.5%,终生患病率为0.6%(黄悦勤等,2019)。患者一生中往往面临多次发作,躁狂或抑郁交替反复出现,在疾病间歇期,有的患者能完全缓解如常人,有的患者则残留各种症状。超过50%的患者在首次发作4~5年内出现疾病复发,终生复发率达90%以上。双相障碍患者自杀风险较一般人群高15倍,约15%的患者死于自杀(Walker ER et al,2015)。在世界卫生组织报告的精神与物质使用障碍的疾病负担排名中(Ferrari AJ et al,2016),双相障碍位居第六。
1.遗传
家系研究和基因组学研究均提示,产后抑郁症具有一定的家族聚集性,可能与某些基因的变异有关。产后情感障碍患者的子女,发生情感障碍的几率高于未患产后情感障碍者病的子女。国外的研究还表明,有过产后心境障碍发作的患者,再次出现产后心境发作的风险明显升高,发生率可高达50%~90%。
2.神经内分泌
内分泌系统失调的病理假说也受到人们重视。内分泌与神经传导通路相互作用,下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴功能障碍是双相障碍发病机制中的因素之一。双相障碍患者体内HPA轴功能异常,下丘脑释放促肾上腺释放激素(corticotropin-releasing hormone,CRH)引起垂体促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)及外周器官肾上腺皮质释放皮质醇分泌紊乱的现象。皮质醇分泌过多可能造成抑郁症状,导致神经细胞毒性作用;ACTH和皮质醇增多可能引起躁狂发作,造成认知异常与功能障碍。此外,药物对HPA轴的调节作用也是目前治疗心境障碍的新进展。
下丘脑-垂体-甲状腺(hypothalamic-pituitary-thyroid,HPT)轴异常在双相障碍的患者中相当常见,特别是快速循环型双相障碍患者。甲状腺素对中枢神经系统的发育有重要意义,成人甲状腺功能减退造成躯体代谢低下,引起中枢神经系统病变,导致抑郁及认知功能受损。补充甲状腺素有助于难治性抑郁症的治疗。在过去30年间,有许多报道提出补充T3(25~50mg/d)能够增强抗抑郁药的效果。最近,美国国立精神卫生研究所(NIMH)的STAR-D研究证实,联合使用T3能改善患者对抗抑郁药的反应,增加抗抑郁药物治疗无效患者对药物的敏感性。亦有研究指出,对于伴有甲减的抑郁症患者T4也是有效的抗抑郁药增效剂。此外,甲状腺功能也影响女性心境障碍的患病,与产后情绪变化和经前综合征均有关。
3.神经递质
5-羟色胺(serotonin,5-HT)和去甲肾上腺素能(norepinephrine,NE)等神经递质系统紊乱与双相障碍关系最为密切。文献指出,脑中5-HT系统有显著的性别差异,部分依赖于雌激素,另一部分依赖睾酮。总体而言,雌激素增加5-HT的神经传递效能。5-HT分布与再摄取在女性的前额叶、下丘脑、及边缘系统较男性更显优势。也有证据指出,睾酮对5-HT系统的活性作用与雌激素相反。减少雄激素能增强中枢5-HT活性,给予睾酮可降低中枢5-HT活性。
近来磁共振脑成像研究发现,双相障碍患者脑中有细微的结构、化学物质及功能变化,提示该病与神经心理机制的关联。
4.雌性激素
自从胚胎发育、青春期以及月经周期、妊娠期、哺乳期到绝经期,女性都经历了性激素水平的变化。尽管男性性激素的波动相对稳定,但在青春期雄激素急剧增加,并随着年龄增长而递减。
研究发现雌激素、黄体激素、雄激素均通过应激反应过程显著影响神经系统的功能,与情感障碍的发生密切相关。性激素水平的急剧变化或脑结构和功能的发育差异可能造成情感障碍的性别差异。性激素通过改变神经递质、神经肽信号传导效能、神经兴奋性以及突触可塑性,间接介导了情绪变化。雌激素受体与雌激素结合后,可改变其他类固醇激素转录因子的活性,包括糖皮质激素、甲状腺素、黄体激素受体。除此之外,雄激素代谢酶在部分大脑区域起到调节雄激素与其受体结合活性的作用。睾酮在脑中可被代谢成:①二氢睾酮:对雄激素受体亲和力较强;②雄烯二酮:对雄激素受体亲和力较弱;③雌二醇:对雌激素活性强于雄激素受体。雄、雌啮齿类下丘脑外与焦虑相关的脑区,包括海马、中缝核及皮质雌激素受体密度无明显差异。
性激素对女性生殖周期的影响与抑郁有肯定的联系。雌激素与黄体激素、神经递质、神经内分泌、昼夜规律对心境障碍均有影响,具体机制尚不明确,可能是通过影响5-HT和NE合成、释放而发生作用的。胎儿时期类雌激素物质的暴露会增加抑郁的终生患病率。研究表明,雌激素用于治疗产后及围绝经期抑郁可能有效。
客观测量方法如多导睡眠图,也印证了睡眠减少是双相躁狂的特征表现。对未经治疗的躁狂患者多导睡眠图的研究发现:总睡眠时间减少、觉醒时间增加、REM 潜伏期缩短。这些结果与抑郁症患者中发现的多导睡眠参数相似。双相躁狂患者的多导睡眠测量可能会受到白天活动过度的影响,因为正常人的睡眠结构也能够被白天活动增加所影响。这样,双相躁狂的多导睡眠异常是由躁狂状态本身导致还是继发于躁狂的其他症状(如躯体或精神活性水平增加、代谢改变等等)仍不清楚。
双相抑郁和单相抑郁睡眠的区别可以令人信服的应用于临床上两种抑郁发作的鉴别。但针对双相抑郁睡眠质量的客观研究(如采用多导睡眠图等)通常发现单相抑郁和双相抑郁的睡眠异常是相似的。尽管匹配了年龄、性别和症状严重程度后,有限的数据表明双相抑郁患者比单相抑郁患者有着更多的早醒和更长的总REM 密度。
有限的研究评估了缓解期双相障碍多导睡眠图的异常。Knowles 等人,研究了10例缓解期双相患者5个晚上,除了有较多的觉醒之外,没有发现双相患者和年龄匹配的正常对照有显著差异。Sitaram 等人发现缓解期双相患者相比正常对照REM密度和REM 睡眠的比例增加。最近,Millar 等比较19例缓解期双相Ⅰ型患者和年龄性别匹配的19例健康对照,发现缓解期双相患者有更长的入睡潜伏期、睡眠时程增加。Harvey 等观察了缓解期双相患者、失眠症患者和有良好睡眠的对照,发现70%的缓解期双相患者临床上有显著的睡眠障碍,睡眠效率下降,对不良睡眠的焦虑和恐惧增加,白天活动水平下降。
双相障碍是一种慢性、高复发性的精神障碍,因此在各国指南中,均强调全病程综合治疗和疾病管理。综合治疗手段包括药物治疗、物理治疗和心理社会干预。构建良好的医方-患者-家属治疗联盟,共同参与治疗,有利于患者康复。2015年《中国双相障碍防止指南(第2版)》中全病程治疗理念如表1所示。
表1 双相障碍全病程治疗目标、疗程和要点
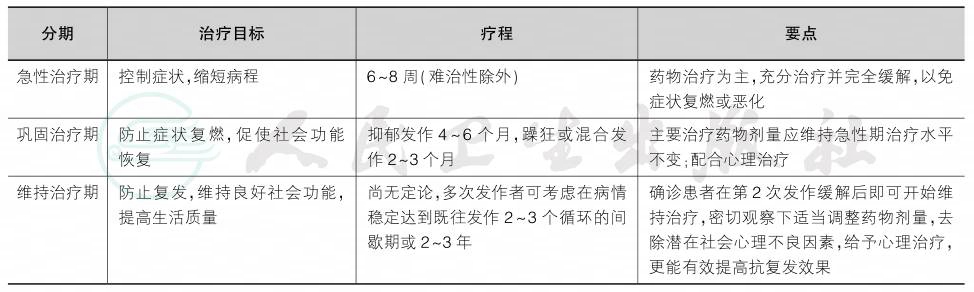
1.药物治疗
是双相障碍的主要治疗手段。心境稳定剂是各类型双相障碍的基础用药,使用应贯穿全病程。目前临床使用最广泛的是碳酸锂和丙戊酸盐,对双相躁狂、双相抑郁、巩固维持治疗均有效。拉莫三嗪对双相抑郁和巩固维持治疗有效。卡马西平也是经典的心境稳定剂,但因不良反应和药物相互作用较多,目前临床使用很少。两种心境稳定剂联用如碳酸锂+丙戊酸盐或碳酸锂+拉莫三嗪的组合也比较常见。
非典型(第二代)抗精神病药物是最常用的联合用药,包括利培酮、喹硫平、奥氮平、阿立哌唑、齐拉西酮等。尽管单一用药也有一定的疗效,但通常在心境稳定剂基础上联用,不推荐联用两种抗精神病药物。这类药物起效快,广泛而独特的作用机制对情绪症状和精神病性症状均有疗效。
抗抑郁药在双相障碍中使用则应谨慎,因易导致抑郁转相为躁狂,使心境不稳定,疾病迁延和复杂化。本节治疗推荐均以2015年《中国双相障碍防治指南(第2版)》为准。
(1)双相躁狂的药物治疗
推荐以心境稳定剂(锂盐和丙戊酸盐)、非典型抗精神病药物(奥氮平、利培酮、喹硫平、阿立哌唑、齐拉西酮、阿塞那平和帕潘立酮)和部分典型抗精神病药物(氟哌啶醇和氯丙嗪)作为双相躁狂的一线治疗。上述药物可以单用,也可以联用,如一种心境稳定剂联用一种非典型抗精神病药物,或者两种心境稳定剂联用。典型抗精神病药物因不良反应明显,仅建议短期使用。苯二氮䓬类药物可用于急性躁狂期的辅助治疗。
(2)双相抑郁的药物治疗
双相Ⅰ型抑郁推荐以心境稳定剂(锂盐、丙戊酸盐和拉莫三嗪)、非典型抗精神病药物(奥氮平、喹硫平)单药或联合治疗为一线治疗,奥氮平和抗抑郁药氟西汀联用、锂盐/丙戊酸盐和抗抑郁药安非他酮联用也属于一线治疗。
双相Ⅱ型抑郁首选喹硫平单药治疗,其次心境稳定剂(锂盐、丙戊酸盐和拉莫三嗪)单药或联用SSRI类抗抑郁药物、拉莫三嗪联合喹硫平、非典型抗精神病药物联用抗抑郁药物都有效。
抗抑郁药物不适用于快速循环发作、混合发作或有严重躁狂发作病史的患者,除非首选治疗方案经反复调整仍治疗无效者。急性期已经使用抗抑郁药物,进入巩固/维持期阶段建议逐步减量。
(3)双相障碍巩固维持期药物治疗
锂盐、拉莫三嗪和喹硫平都被作为双相Ⅰ型和双相Ⅱ型障碍巩固维持期的首选推荐。对于双相Ⅰ型障碍,还有部分非典型抗精神病药或者心境稳定剂联合抗精神病药被作为首选推荐。
2.物理治疗
电休克治疗(ECT)/改良电休克治疗(MECT)在双相障碍患者中广泛使用,适合极度兴奋躁动、冲动伤人、有高度自杀风险、木僵、拒食、不能耐受药物及难治性的双相患者。一般6~12次为一个疗程,快速控制症状后转入药物治疗。
近年来,以脑刺激等神经调控技术为代表的物理治疗方法在双相障碍中得到了越来越多的验证和应用。主要包括经颅磁刺激(TMS)、经颅直流电刺激(tDCS)、迷走神经刺激术(VNS)和深部脑刺激技术(DBS)。
3.心理社会干预
在双相急性期和巩固维持期,药物治疗与心理治疗的结合可作为最佳管理措施。附加心理治疗的主要目标为患者教育,如果可能的话,对照料者进行有关压力管理策略的教育,识别和干预复发的早期迹象,保持有规律的生活方式。此外,由于对药物不依从的比例很高(急性发作后高达60%),心理社会治疗还需强调对药物治疗的配合。
以证据为基础的心理治疗模式包括认知行为疗法、以家庭为中心的疗法、人际和社会节律疗法、群体心理教育和系统护理管理。这些心理社会干预方法可以有效降低双相障碍的复发率、减少住院次数,提高药物依从性,改善患者社会功能。













