英文名称 :uterine myoma
子宫肌瘤(uterine myoma)是女性生殖器中最常见的良性肿瘤,由平滑肌及结缔组织组成。多见于30~50岁妇女,据统计生育期妇女的肌瘤发生率为20%~25%,40岁以上妇女的发病率则高达30%~40%。因肌瘤多无或很少有症状,临床发病率远低于肌瘤真实发病率。
确切病因尚未明确,可能与正常肌层的体细胞突变、性激素及局部生长因子间的相互作用有关。
1.与性激素相关
因肌瘤好发于生育年龄。在妊娠、外源性高雌激素作用下,肌瘤生长较快;抑制或降低雌激素水平的治疗可使肌瘤缩小;绝经后肌瘤停止生长、萎缩或消退,提示其发生可能与女性性激素相关。生物化学检测证实肌瘤中雌二醇的雌酮转化率明显低于正常肌组织;肌瘤中雌激素受体(ER)浓度明显高于周边肌组织,故认为肌瘤组织局部对雌激素的高敏感性是肌瘤发生的重要因素之一。此外研究证实孕激素有促进肌瘤有丝分裂活动、刺激肌瘤生长的作用,肌瘤组织中的孕激素受体浓度高于周边肌组织,分泌期的子宫肌瘤标本中细胞分裂象明显高于增殖期的子宫肌瘤。
2.与遗传学相关
细胞遗传学研究显示25%~50%子宫肌瘤存在细胞遗传学的异常,包括从点突变到染色体丢失和增多的多种染色体畸变,首先是单克隆起源的体细胞突变,并对突变肌细胞提供一种选择性生长优势,如85%的子宫肌瘤病人拥有突变的转录介导亚基Med12,从而促使子宫肌层干细胞转变为肿瘤形成干细胞;其次是多种与肌瘤有关的染色体重排,常见的有12号和14号染色体长臂片段易位(12;14)(q14-15;q23-24)、12号染色体长臂重排、7号染色体长臂部分缺失(7q22q32)等,与之相关的基因有HMGA2、RAD51B和CUX1。分子生物学研究提示子宫肌瘤由单克隆平滑肌细胞增殖而成,多发性子宫肌瘤由不同克隆细胞形成。
3.与细胞因子相关
一些生长因子在子宫肌瘤的生长过程中可能起着重要作用,如胰岛素样生长因子(IGF)Ⅰ和Ⅱ、表皮生长因子(EGF)、血小板衍生生长因子(PDGF)A和B、血管生成因子(VEGF)等。
1.按肌瘤生长部位 分为宫体肌瘤(90%)和宫颈肌瘤(10%),其中宫颈肌瘤多为单发,后壁常见。
2.按肌瘤与子宫肌壁的关系 分为3类(图1):
(1)肌壁间肌瘤(intramural myoma):占6 0%~70%,肌瘤位于子宫肌壁间,周围均被肌层包围。
(2)浆膜下肌瘤(subserous myoma):约占2 0%,肌瘤向子宫浆膜面生长,并突出于子宫表面,肌瘤表面仅由子宫浆膜覆盖。若瘤体继续向浆膜面生长,仅有一蒂与子宫相连,称为带蒂浆膜下肌瘤,营养由蒂部血管供应。若血供不足,肌瘤可变性坏死。如蒂扭转断裂,肌瘤脱落形成游离性肌瘤。如肌瘤位于宫体侧壁向宫旁生长突出于阔韧带两叶之间称阔韧带肌瘤。
(3)黏膜下肌瘤(submucous myoma):占10%~15%。肌瘤向宫腔方向生长,突出于宫腔,仅为黏膜层覆盖。根据肌瘤体积在肌壁内的比例,亚型分为:0型(带蒂的黏膜下肌瘤,肌瘤完全位于宫腔内未向肌层扩展),1型(黏膜下无蒂肌瘤,向肌层扩展<50%),2型(黏膜下无蒂肌瘤,侵占肌层部分≥50%)(图2)。黏膜下肌瘤易形成蒂,在宫腔内生长犹如异物,常引起子宫收缩,肌瘤可被挤出宫颈外口而突入阴道。
3.子宫肌瘤常为多个,以上各类肌瘤可单独发生亦可同时发生。两个或两个部位以上肌瘤发生在同一子宫者,称为多发性子宫肌瘤。
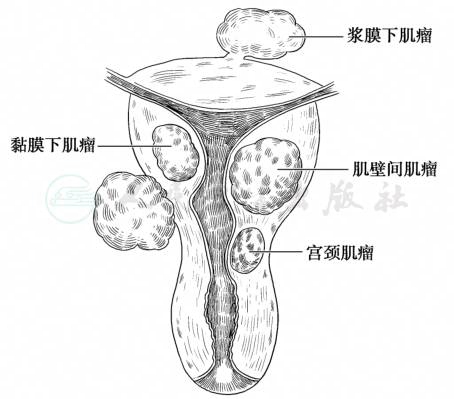
图1 子宫肌瘤分类示意图
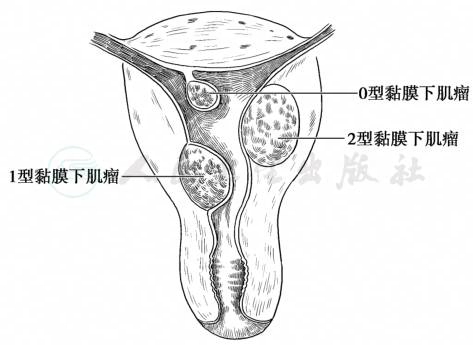
图2 子宫黏膜下肌瘤亚型分类示意图
1.巨检
肌瘤为实质性球形包块,表面光滑,质地较子宫肌层硬,压迫周围肌壁纤维形成假包膜,肌瘤与假包膜间有一层疏松网状间隙,故易剥出。血管由外穿入假包膜供给肌瘤营养,肌瘤越大,血管越粗,假包膜中的血管呈放射状排列。肌瘤长大或多个相融合时呈不规则形状。肌瘤切面呈灰白色,可见漩涡状或编织状结构。肌瘤颜色和硬度与纤维组织多少有关。
2.镜检
肌瘤主要由梭形平滑肌细胞和不等量纤维结缔组织构成。肌细胞大小均匀,排列成漩涡状或棚状,核为杆状。
3.特殊类型的子宫肌瘤以病理检查来诊断
与非特殊类型子宫肌瘤的区别,在于核分裂象和细胞异型程度。特殊类型的子宫肌瘤在病理组织学上,均属于良性肿瘤。
(1)富于细胞平滑肌瘤(cellular leiomyoma)
肿瘤中有丰富的平滑肌细胞,排列紧密,细胞大小及形态尚一致,仅个别细胞有异形,偶见约1~4个/10个高倍视野的分裂象。
(2)奇怪型平滑肌瘤(bizarre leiomyoma)
肿瘤以圆形或多边形细胞为主,胞质嗜酸性,核周呈透亮空隙。其特征为细胞多形性,核异型甚至出现巨核细胞。但无分裂象可见。临床呈良性表现。
(3)血管平滑肌瘤(angio-myoma)
平滑肌瘤中血管丰富,瘤细胞围绕血管排列,与血管平滑肌紧密相连。肌瘤也可向脉管内生长,促使脉管的平滑肌组织增生后突向管腔,该类型子宫肌瘤可以累及静脉、淋巴管,甚至心脏和肺血管。肿瘤切面色泽较红。
(4)腹腔弥漫型平滑肌瘤病(leiomyomatosis peritonealis disseminata)
平滑肌瘤弥漫分布于腹膜、大网膜、肠系膜、直肠子宫凹陷及盆腹腔器官表面。大体上较难与腹膜转移癌和胃肠道间质肿瘤相鉴别,但HE染色可发现增生的梭形细胞排列成漩涡状,波形蛋白、ER和PR表达可阳性。
(5)上皮样平滑肌瘤(epithelioid leiomyoma)
平滑肌瘤以圆形或多边形细胞组成,常排列成上皮样索或巢状。肌瘤呈黄色或灰色。应注意其边缘部分是否有肌层浸润,若有浸润应视为恶性。
(6)神经纤维样平滑肌瘤
肿瘤细胞核呈栅栏状排列,似神经纤维瘤。
(7)脂肪平滑肌瘤(lipoleiomyoma)
镜下见平滑肌细胞与脂肪细胞形成的小叶互相掺杂在一起。
肌瘤变性是肌瘤失去原有的典型结构。常见的变性有:
1.玻璃样变(hyaline degeneration)
又称透明变性,最常见。肌瘤剖面漩涡状结构消失,为均匀透明样物质所取代。镜下见病变区肌细胞消失,为均匀透明无结构区。
2.囊性变(cystic degeneration)
继发于玻璃样变,肌细胞坏死液化即可发生囊性变,此时子宫肌瘤变软,很难与妊娠子宫或卵巢囊肿区别。肌瘤内出现大小不等的囊腔,其间有结缔组织相隔,数个囊腔也可融合成大囊腔,腔内含清亮无色液体,也可凝固成胶冻状。镜下见囊腔为玻璃样变的肌瘤组织构成,内壁无上皮覆盖。
3.红色样变(red degeneration)
多见于妊娠或产褥期,为肌瘤的一种特殊类型坏死,发生机制不清,可能与肌瘤内小血管退行性变引起血栓及溶血,血红蛋白渗入肌瘤内有关。病人可有剧烈腹痛伴恶心呕吐、发热,白细胞计数升高,检查发现肌瘤迅速增大、压痛。肌瘤剖面为暗红色,如半熟的牛肉,有腥臭味,质软漩涡状结构消失。镜检见组织高度水肿,假包膜内大静脉及瘤体内小静脉血栓形成,广泛出血伴溶血,肌细胞减少,细胞核常溶解消失,并有较多脂肪小球沉积。
4.肉瘤样变(sarcomatous change)
肌瘤恶变即为肉瘤变,少见,仅为0.1%左右,多见于绝经后妇女。肌瘤在短期内迅速长大或伴有不规则出血者应考虑恶变。若绝经后妇女肌瘤增大更应警惕恶性变可能。肌瘤恶变后,组织变软而且脆,切面灰黄色,似生鱼肉状,与周围组织界限不清。镜下见平滑肌细胞增生,排列紊乱,漩涡状结构消失,细胞有异型性。
5.钙化(degeneration with calcification)
多见于蒂部细小血供不足的浆膜下肌瘤以及绝经后妇女的肌瘤。常在脂肪变性后进一步分解成甘油三酯,再与钙盐结合,沉积在肌瘤内。X线摄片可清楚看到钙化阴影。镜下可见钙化区为层状沉积,呈圆形,有深蓝色微细颗粒。
治疗应根据病人年龄,生育要求,症状及肌瘤的部位、数目全面考虑。
1.随访观察
无症状或症状轻微病人,一般不需治疗,特别是近绝经期妇女,绝经后肌瘤多可萎缩或逐渐消失。每3~6个月随访一次,进行妇科检查和B型超声检查,必要时行彩色多普勒超声检查,检测肌瘤的血流信号。若肌瘤明显增大或出现症状,可考虑进一步治疗。对未孕的病人,尤其要重视定期随访,若评估肌瘤可能引起不孕和流产时,应及早手术治疗,以免对今后妊娠产生不良影响。
2.药物治疗
症状轻,近绝经年龄或全身情况不宜手术者或在手术前控制肌瘤的大小以减少手术难度,可给予药物对症治疗。但因为是非根治性治疗,停药后一般肌瘤会重新增大。
(1)促性腺激素释放激素类似物(GnRHa)
采用大剂量连续或长期非脉冲式给药可产生抑制FSH和LH分泌作用,降低雌二醇到绝经水平,以缓解症状并抑制肌瘤生长使其萎缩。但停药后又逐渐增大到原来大小。一般应用长效制剂,间隔4周皮下注射1次。常用药物有亮丙瑞林(leuprorelin)每次3.75mg,或戈舍瑞林(goserelin)每 次3.6mg。目前临床多用于:①术前辅助治疗3~6个月,待控制症状、纠正贫血、肌瘤缩小后手术,降低手术难度,减少术中出血,避免输血;②对近绝经期病人有提前过渡到自然绝经作用;③因子宫肌瘤引起不孕的病人,孕前用药使肌瘤缩小以利自然妊娠。用药6个月以上可产生绝经期综合征,骨质疏松等不良反应,故长期用药受限。有学者指出,在GnRHa用药3个月加用小剂量雌孕激素,即反向添加治疗(add-back therapy),能有效减少症状且可减少这种不良反应。
(2)米非司酮(mifepristone)
为人工合成的19-去甲基睾酮衍生物,具有强抗孕酮作用,亦可用于子宫肌瘤治疗。每日5~10mg/d口服,连续服用3~6个月,作为术前用药或提前绝经使用。但停药后肌瘤会重新增大,且不宜长期使用,以防其拮抗糖皮质激素的不良反应。
(3)其他药物
在子宫肌瘤病人的经期,可以使用雄激素减少子宫出血量。雄激素可对抗雌激素,使子宫内膜萎缩;也可直接作用于子宫,使肌层和血管平滑肌收缩,从而减少出血量。在近绝经期应用雄激素可提前绝经。常用药物:丙酸睾酮25mg肌注,每5日1次,经期25mg/d,共3次,每月总量不超过300mg,可用3~6个月;甲睾酮10mg/d,舌下含服,连用3个月。其他减少子宫出血量的辅助药物还包括子宫收缩剂(缩宫素)和止血药(如妥塞敏、止血敏、立止血等)。
3.手术治疗
适应证为:月经过多继发贫血、有膀胱、直肠压迫症状或肌瘤生长较快疑有恶变者、保守治疗失败、不孕或反复流产排除其他原因。手术途径可经腹、经阴道或宫腔镜及腹腔镜下手术。术式有:
(1)肌瘤切除术(myomectomy)
适用于希望保留子宫的病人。多经腹或腹腔镜下切除;黏膜下肌瘤或大部分突向宫腔的肌壁间肌瘤可宫腔镜下切除。宫颈肌瘤和突入阴道的黏膜下肌瘤可经阴道摘除。部分病人在术后会复发,其中约1/2病人需要再次手术。肌瘤术后复发的高危因素有:病人年龄在30~40岁,有≥2个的子宫肌瘤,子宫体积增大如孕>10周。
(2)子宫切除术(hysterectomy)
不要求保留生育功能,或疑有恶变者,可行子宫切除术,包括全子宫切除和次全子宫切除,多经腹、经阴道或腹腔镜下切除。术前应宫颈细胞学检查排除宫颈恶性病变。围绝经期的子宫肌瘤要注意排除合并子宫内膜癌。必要时可于术中行冰冻切片组织学检查。依具体情况决定是否保留双侧附件。
(3)子宫动脉栓塞术(uterine artery embolization,UAE)
子宫动脉栓塞术是经皮的微创介入治疗。治疗原理为:由于肌瘤组织与正常子宫组织相比生长分裂活跃,耗氧量大,对无氧代谢耐受力差;子宫血供的特殊性导致子宫正常组织有丰富的血管交通网,并且对血栓的溶解能力较肌瘤组织强;通过对子宫肌瘤供血动脉的栓塞,以达到阻断瘤体血供,瘤组织坏死萎缩,使瘤细胞总数减少,从而达到缓解症状的目的。适用于有症状性的肌壁间肌瘤(非带蒂肌瘤),希望保留子宫但传统非手术治疗失败又不耐受手术的病人,肌瘤数目<6个或无生育要求的病人。手术的绝对禁忌证相对较少,包括有生育要求,未明确性质的盆腔肿块或子宫病变、凝血功能障碍等。该手术不良反应少,常见的并发症有穿刺相关并发症、栓塞后综合征、感染、非靶向栓塞等。但动脉栓塞术后5年内的再次干预率较高,达到28%~32%,再次干预包括再次子宫动脉栓塞、肌瘤切除术或子宫切除术,主要原因是子宫肌瘤供血的不完全阻断。
4.其他治疗
(1)高强度聚焦超声(high intensity focused ultrasound, HIFU)
是利用超声波聚焦子宫肌瘤病灶,通过超声波产生的热效应、机械效应、空化效应准确消融目标肌瘤。根据治疗监控方式的不同,HIFU分为两大类,即磁共振监控的HIFU(MRgFUS)和超声监控的HIFU(USgHIFU)。有生育要求的肌瘤病人慎用。
(2)射频消融术(radiofrequency volumetric thermal ablation, RFVTA)
射频消融术是在B超引导下的、利用射频对子宫肌瘤进行消融的门诊无创手术,肌瘤不受大小、位置的限制,体积<1cm或位置在肌层深部的肌瘤都可以被消融。禁忌证是有生育要求的病人。临床研究显示肌壁间肌瘤病人经过治疗后,月经量明显减少;消融术后,3年内的再次干预治疗率为11%,临床效果良好。
(3)左炔诺孕酮宫内缓释系统(levonorgestrel-releasing intrauterine system, LNG-IUS)
是一种能稳定释放左炔诺孕酮的T型节育环,释放的左炔诺孕酮局部作用于子宫内膜使其萎缩从而减少月经量。因此,在肌瘤较小、合并月经过多的病人中,可考虑宫内LNG-IUS的治疗。
1.妊娠合并子宫肌瘤病人剖宫产同时是否可行肌瘤切除术
足月妊娠时,子宫肌瘤边界清晰,容易分离,而且对催产素敏感性高。Hassiakos等研究了141例因妊娠合并子宫肌瘤实施剖宫产术的病人,其中47例在剖宫产同时行肌瘤切除术。与剖宫产术时未行肌瘤切除术的病人相比,剖宫产术同时行肌瘤切除术的病人手术时间和住院天数延长,但两者在术中出血、术后感染等并发症方面的差异无统计学意义。妊娠合并子宫肌瘤病人在剖宫产同时行子宫肌瘤切除术的意义在于:
(1)避免短期内再次手术,使病人心理上和生理上得到恢复。
(2)肌瘤剔除术后子宫收缩更为协调,有利于子宫修复,对减少术后出血及盆腔感染可能也有一定的作用。但剖宫产术同时行肌瘤切除术需在术前和术中做好充分准备。术前应行B型超声检查,了解肌瘤与胎盘位置以决定是否同时行肌瘤切除术,若切除,需要选择适合的切口及手术方式,并备有充足血源。术中要求手术者技术娴熟,能处理髂内动脉或子宫动脉结扎术或子宫切除术。术中一般先作剖宫产(除黏膜下肌瘤外)、缝合剖宫产切口,然后再行肌瘤切除术。肌瘤挖除前先在瘤体周围或基底部注射缩宫素,可有效减少手术出血量。对一些粟粒大小肌瘤可应用高频电刀,使其炭化,临床上亦收到良好的效果。
2.40岁以上无生育要求的多发性子宫肌瘤病人是否可行子宫肌瘤切除术
对于此类病人,临床上一般采取全子宫或次全子宫切除术。但近年来,越来越多的病人提出了保留子宫的要求。因为子宫不仅是生育的器官,同时也是性器官,甚至有研究表明可能具有一定的分泌功能,有些妇女对于子宫的缺失具有巨大的心理负担。因此,无生育要求的多发性子宫肌瘤病人若对保留子宫有强烈的愿望,可以行子宫肌瘤切除术,但需告知其术后复发的风险,并强调定期随访的重要性。同时,术前可通过阴道用米索前列醇或术中瘤体内注射垂体后叶素、丁哌卡因联合肾上腺素等药物以及放置止血带等方法减少术中出血。
3.子宫肌瘤的激素替代治疗的思考
研究发现,绝经后使用激素替代疗法的妇女,无论是单用雌激素或雌、孕激素联合应用均有促进子宫肌瘤生长的作用,但一般不会引起绝经后流血等临床症状。目前认为,绝经期子宫肌瘤妇女使用激素治疗不是绝对禁忌证,而是属于慎用范围。对于有绝经期症状者可以采用激素治疗,使用时注意孕激素用量不宜过大,雌激素和孕激素采用小剂量、个体化治疗,且口服比经皮用药对肌瘤的生长刺激作用为弱。但对绝经期使用激素治疗的子宫肌瘤妇女要强调知情同意和定期检查及随访的重要性,治疗期间应注意观察有无异常阴道流血等临床症状的出现,同时定期行B型超声检查子宫肌瘤大小和子宫内膜厚度。一旦发现子宫肌瘤增大或出现异常阴道流血可停药,并进一步检查异常阴道流血的原因。
4.子宫肌瘤不孕病人治疗的思考
约有30%子宫肌瘤病人表现为不孕,这与肌瘤生长的部位有关。如子宫角部的肌瘤可造成输卵管扭曲、变形,影响精子或受精卵通过,减少受孕机会。黏膜下子宫肌瘤占据宫腔的位置、影响受精卵着床。而较大的肌壁间肌瘤既可改变宫腔的正常形态,又可压迫输卵管。对于这些病人,应考虑行肌瘤切除术。一般肌壁间肌瘤切除术后建议避孕一年,黏膜下肌瘤宫腔无损者避孕4~6个月后考虑妊娠。妊娠后加强管理,警惕孕中、晚期子宫破裂,适当放宽剖宫产指征。
有关行辅助生育技术前子宫肌瘤不孕者是否先作肌瘤切除术,尚无统一意见。需要综合考虑病人年龄、不孕时间、卵巢储备功能、肌瘤部位和病人的意愿。若肌瘤随访病人,在备孕期间可监测排卵,指导性生活,提高备孕效率;对于有排卵障碍者可使用促排卵药物助孕。目前对于肌瘤小、宫腔未变形,或为浆膜下肌瘤的病人,一般可直接采用IVF-ET。
5.腹腔镜下旋切播散的预防
自从1995年美国FDA正式批准旋切器在腹腔镜中应用以来,腹腔镜下旋切器得到了极大的推广应用。但在2014年4月17日FDA发布了一个安全警告“腹腔镜下粉碎在子宫切除术和肌瘤切除术中的应用”,因为目前尚无可靠的方法来预测肌瘤是否为子宫肉瘤,建议临床医生彻底讨论所有病人治疗的益处和风险,并告知病人腹腔镜粉碎术可能造成肌瘤包含意外的癌组织的播散,使预后显著恶化。因此,建议临床使用旋切袋,将瘤体放在袋中进行旋切,取出袋体后,反复冲洗盆腔,以尽可能避免旋切器在粉碎中发生的潜在并发症。
6.特殊类型子宫肌瘤的治疗
特殊类型子宫肌瘤,如富于细胞性平滑肌瘤、奇异性平滑肌瘤、上皮样平滑肌瘤和弥漫型平滑肌瘤,属良性肿瘤,以个体化治疗为主。手术治疗主要取决于病人年龄、有无生育要求及肌瘤本身特点,按良性子宫肌瘤的手术治疗原则处理,避免过度诊治。有生育要求的病人可以行肌瘤剔除术,无生育要求的病人可行全子宫切除术,其中病灶超过子宫范围的病人,可行全子宫+双附件+子宫外肿瘤切除术。术后要加强长期随访,以便发现复发病例,及时处理。一旦复发,要做扩大范围的手术,必要时放化疗,防止肉瘤样变。其他治疗方法还包括:GnRHa、子宫动脉栓塞术和高强度聚焦超声治疗。













