英文名称 :metastatic brain tumours
在1898年Bucholz首先报告脑转移瘤(metastatic brain tumours),但脑转移瘤的确切发生率尚难确定,统计资料认为脑转移瘤占颅内肿瘤的10%左右,国内大宗材料统计占颅内肿瘤的4.67%~12%,癌症死亡病例的尸解材料证实50%的病人均有脑转移,由于近代神经影像学的进步及尸解材料证实脑转移瘤的发生率在不断增高,目前统计20%~40%的癌瘤病人发生脑转移瘤,美国2009年、2011年统计每年有170000~200000原发性脑肿瘤,而有100000~170000脑转移瘤的病例,由于磁共振检查能发现很小的脑转移瘤和医学的不断进步,癌肿病人的生存期延长,脑转移瘤的发病率仍会不断增加。据美国、冰岛、芬兰流行病学调查材料(2008)脑转移瘤的年发生率为8.3~11/10万人口。
性别分布与原发癌有关,如占脑转移瘤一半以上的肺癌男性多见,而乳腺癌为女性肿瘤。总的统计男性多于女性,男、女之比为1.5∶1。
Serizawa(2008)报告从1998—2005年治疗的2390例脑转移瘤中原发癌为肺癌者1572例(65.78%),来自胃肠道者316例,乳癌者211例,肾癌113例,其他肿瘤159例。在我国男性以来自肺和消化道癌肿脑转移多见(71.6%),女性以来自乳腺、生殖系统癌肿脑转移多见(55.7%),国内一组577例颅内转移瘤(杨树源2008),占颅内肿瘤的11.9%,来自肺癌转移者占68.8%,消化道肿瘤占5.2%,肾癌转移者占2.25%,乳癌占1.21%,原发癌未明确者占18.5%,多发转移瘤占53.2%。我院统计脑转移瘤的最小年龄为6岁,最大79岁,以40~60岁最为多见。
1.原发癌肿部位
脑转移瘤病理与原发癌肿病理改变相一致,但仍有5%~11%脑转移瘤病人在手术时甚至术后若干时期仍未能发现原发病灶。美国morialSloan-Kettering癌症中心1993年报告各种癌症病人发生脑转移的比例如下:在123360例癌肿尸解中24%有脑转移,43560例结肠和直肠癌中72%有脑转移,48620例肺癌尸解发现34%有脑转移,13440例乳癌脑转移占30%,46230泌尿系统癌肿中占23%,1360例黑色素瘤中占16%,白血病占6%。Serizawa(2008)报告从1998—2005年治疗的2390例脑转移瘤中原发癌为肺癌者1572例(65.78%),来自胃肠道者316例,乳癌者211例,肾癌113例,其他肿瘤159例。在我国男性以来自肺和消化道癌肿脑转移多见(71.6%),女性以来自乳腺、生殖系统癌肿脑转移多见(55.7%),据统计在成人脑转移瘤最常来源于肺、乳腺,依次为胃肠道、泌尿系统癌肿和恶性黑色素瘤。在年轻病人中以肉瘤(骨肉瘤、横纹肌肉瘤、尤因肉瘤)脑转移或源于身体其他部位的生殖细胞瘤脑转移多见。
2.转移途径
恶性肿瘤转移至颅内主要通过以下3种途径:
(1)血源性扩散:血源性扩散是脑转移瘤最常见的途径,癌细胞进入血流后首先进到肺,在肺形成转移瘤,部分癌细胞通过毛细血管进入肺循环入左心再进入颅内,故肺癌易于发生脑转移。血源扩散的脑转移瘤以大脑中动脉供血区最多见,但亦可在椎动脉供血区,脑转移瘤常位于脑灰、白质交界处,二个脑血管供血的交界区,即分水岭区。因这些区域皮层小动脉管径变细瘤栓易于停留于此发生脑转移瘤。另外脑转移瘤癌瘤细胞也可能经椎静脉丛逆行进入颅内,特别是位于腹腔、盆腔的肿瘤经腹腔静脉进入椎静脉丛(Batson静脉丛)入颅。
(2)经淋巴扩散:癌细胞可经淋巴循环沿脑神经周围的淋巴间隙进入脑脊液循环,进入颅内扩散,消化系统肿瘤易经淋巴系统转移至颅内。
(3)直接侵入颅内:鼻咽癌、视网膜母细胞瘤、耳癌、颅骨的恶性肿瘤可直接侵入颅内产生颅内转移。癌细胞转移至脑如何发展成脑转移瘤的确切机制尚不清楚,但这些癌细胞能释放破坏脑组织的酶,如溶酶体水解酶(lysosomal hydrolase)、胶原溶解酶(collagenolytic enzymes)等。
脑转移瘤可为单发,亦可是多发的,并可转移至软脑膜上,从尸解材料发现脑转移瘤多发者占75%,临床上用CT检查半数以上的病例为多发,但MR检查仅19%为单发,75%黑色素瘤为多发,结肠癌、乳腺癌、肺癌等脑转移也多为多发。孤立性脑转移瘤是指颅脑肿瘤经病理证实为转移瘤,但经各种检查尚未发现颅外原发病灶者。因脑转移瘤多位于大脑中动脉供血区故以额、顶叶最多见,80%~85%位于大脑半球,10%~15%在小脑,3%~5%在脑干,但盆腔肿瘤易向后颅凹转移,可占后颅凹脑转移瘤的50%。脑转移瘤通常呈球形,与周围脑组织边界清楚,但电镜下呈浸润性生长,血运多不丰富,在瘤周有一水肿带,脑水肿范围与肿瘤大小常不成比例,大的肿瘤呈扁平形沿神经纤维生长,中心常有坏死和脓样囊液,肿瘤切面呈灰红色,结节状,其病理与原发癌一致。
1.血液检查
一半以上病人血沉加快,伴有贫血。
2.神经影像学检查
CT和MRI是颅内转移瘤诊断最有效和最常用的检查方法,其优点是无创、准确、快捷。可对转移瘤部位、大小、单发或多发精确定位,除平扫外强化是不可少的,可发现5~10mm的小病灶,MR比CT更敏感,脑转移瘤常有瘤周水肿,瘤周水肿常十分严重,并可显示肿瘤的占位效应,脑积水等改变。MR所显示脑转移瘤常位于脑灰白质交界处,边界较清楚,小的瘤结节及明显的血管源性脑水肿。Runge认为高剂量钆增强扫描0.2mmol/kg或0.3mmol/kg体重注射比常规0.1mmol/kg更易发现小病灶和多发病灶(图1,图2)。为了对原发癌肿的寻找及了解,必要的胸片、CT扫描、内脏B超、SPECT、PET-CT等检查是不可缺少的。
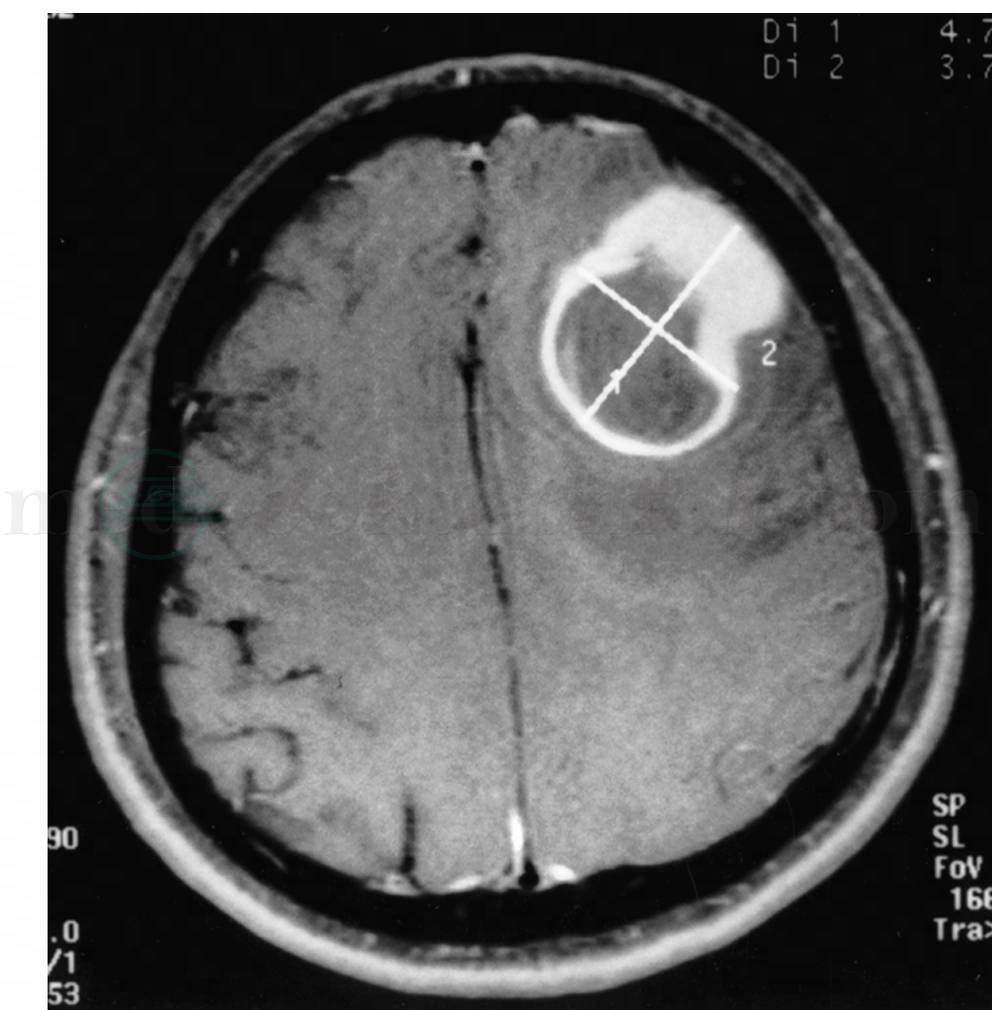
图1 额叶单发转移瘤
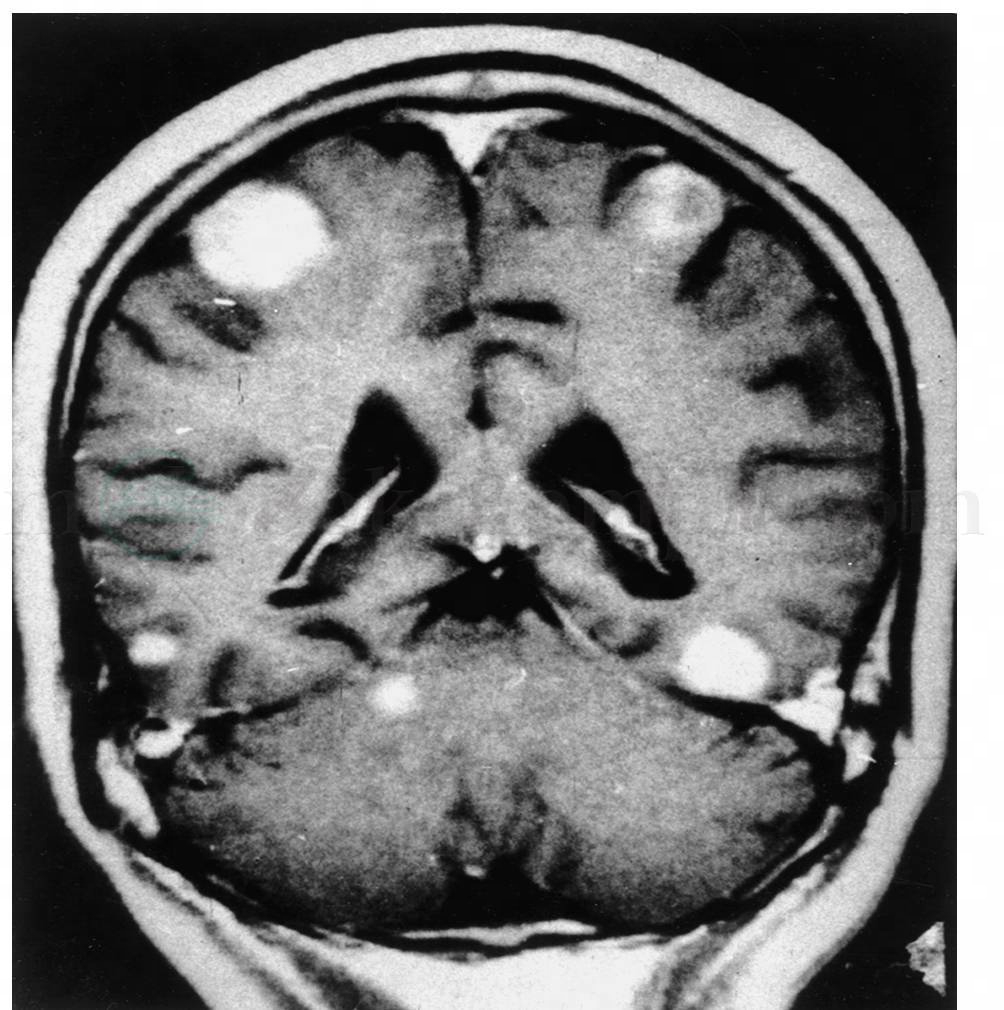
图2 脑多发性转移瘤
由于诊疗技术的不断进步,癌肿病人的生存期有所延长,对脑转移瘤的治疗直接关系到病人的生存期和生活质量。脑转移瘤的治疗目的是缓解病人的症状,延长生存期,改善生存质量。在制定治疗方案时有很多因素影响着治疗效果,如原发癌肿的部位,恶性程度,控制情况,身体其他部位是否还有其他转移病灶,病人一般健康情况(Karnofsky performance status,KPS),颅内转移瘤的部位,是否适于手术切除,脑转移瘤是单发还是多发性等等。
目前常用的治疗方法是:
1.糖皮质激素治疗
糖皮质激素对所有脑转移瘤都适合(有糖尿病的病人不适合),因它可明显的减轻瘤周脑水肿,故可快速缓解症状。常用地塞米松16mg/d,静脉分4次滴注,口服剂量是4mg,每6小时一次,用后70%~80%病人症状与体征明显好转。如上述剂量疗效不理想还可加大用药剂量。类固醇激素治疗在第一次用药后6~12小时即见疗效,3~7天最有效。用药几周后当症状稳定后可逐渐减量,约有10%的病人不能耐受大剂量激素治疗需减少剂量。糖皮质激素治疗的毒副作用是腹胀,激素性肌病、震颤、失眠、精神症状等。据统计单独用激素治疗,脑转移瘤的中位生存期是2个月。
2.放射治疗
(1)全脑放射治疗(whole-brain radiation therapy,WBRT)是治疗脑转移瘤的主要手段,经WBRT后75%的病人临床症状改善,特别适合于治疗多发性脑转移瘤和影像上不显示的微小转移瘤病人,经治疗后15%的病人生存期超过1年,5%~10%达2年(Posner 1992)。但不同病理类型肿瘤对放射治疗的敏感性不同而疗效不同,淋巴瘤、睾丸恶性肿瘤、乳腺癌等对放疗敏感,而黑色素瘤、非小细胞肺癌、肾细胞癌和结肠癌脑转移则对放射治疗不敏感,因此应有活检病理材料才可行WBRT。目前尚无统一的全脑治疗方案可遵循,因脑转移瘤病人的生存期较短,因此常用短疗程足够剂量的全脑放疗。一个多中心放射治疗研究组的研究(Mintz 2007)认为,给予2000cGy到5000cGy的总剂量对病人神经体征及生存期的影响并无统计学上的差异,目前常用的WBRT方案是300cGy每天一次共10天,或2000cGy分5次照射,总剂量为3000cGy到5000cGy。WBRT对大的肿瘤只能对其外部瘤肿起杀伤作用,而肿瘤中心缺氧细胞对离子辐射有抵抗力,影响疗效。目前尚无瘤细胞对放疗敏感的检测手段。使用nitromitazoles等药物可增加乏氧细胞对放射治疗的敏感性,以提高疗效,但毒副作用大应慎重使用,但对非小细胞肺癌脑转移行WBRT加用放疗增效能剂莫特沙芬钆(metexafin)较单独WBRT在改善神经功能上效果更好,乳癌脑转移行WBRT时加用放疗增效剂efaproxiral可延长病人生存期一倍。多中心研究组的结果(The cancer care Ontario practice guidlines 2007)显示WBRT可使脑转移瘤的中位生存期增加3.5~6.3个月,WBRT加用SRS可延长病人中位生存期为6.5个月。
放射治疗的并发症:放疗的早期有暂时性症状或体征加重,故放射治疗期间维持激素治疗是十分必要的,其有缩小放疗并发症的效果。在放疗开始最初几天内病人会出现恶心、呕吐、头痛、发热和脱发,这些症状较为常见,这些急性反应可能与脑血管自动调节紊乱和毛细血管通透性增加有关,偶可出现放疗引起的腮腺炎或味觉丧失等。有报告在生存期超过一年以上行WBRT后可引起弥漫性白质脑病(diffuse leukoencephalopathy),有11%的病人于照射后出现痴呆、共济失调、尿失禁等症状,磁共振检查显示脑皮质萎缩和白质高信号改变,生存期超过两年者50%可出现痴呆等严重并发症,因此有建议对估计病人生存期可能超过一年的病人每日照射剂量减少至250cGy以下,延长放疗时间,这样可减少此类并发症。
(2)立体定向放射外科治疗:近年来报告立体定向放射外科(stereotactic radiosurgery)对各种脑转移瘤无论是单发的还是多发的都有效,其放射源是60Co,直线加速器或质子源照射可大剂量照射于靶区杀死瘤细胞而靶周放射剂量很低。放射外科可改善症状,较好的控制肿瘤而副作用小,其优点是非侵袭性,不需住院,其主要缺点是造成放射性脑坏死。由于粒子辐射造成毛细血管通透性改变,致使病灶周围产生神经源性水肿或脑血流量减少。放射外科的疗效与肿瘤的容积有关。以3~4cm3以内的肿瘤疗效最好。Adler(1992)报告33例不同来源的脑转移瘤经放射外科治疗后行神经影像学检查,29%病人肿瘤消失,50%肿瘤缩小,12%稳定,其余5例增大,这5例经活检证实为脑组织坏死。Alexander(1995)回顾分析248例用放射外科和WBRT治疗脑转移瘤的病人,平均中位生存期为9.4个月,一年肿瘤局部控制率为85%,2年为65%,影响肿瘤局部控制率的原因是复发性肿瘤,位于幕下的肿瘤和肿瘤体积大于3cm3以上者。Niranjan(2000年)认为多数脑转移瘤边界清楚,因此能集中剂量照射肿瘤,较优于外科加WBRT治疗。随着各种放射外科设备的不断改进,目前使用放射外科治疗脑转移瘤的病例与日俱增,有认为γ刀治疗脑转移瘤的疗效比x刀(linear accelerator,LINAC)好。Serizawa(2008)使用γ刀治疗脑转移瘤2390例,放疗后中位生存期为7.7个月,经多元分析与预后不良的相关因素是:原发病灶治疗情况,男性和KPS评分低等。Swinson(2008)报告立体定向放射科治疗各种病理类型的脑转移瘤619例,1569个转移瘤,中位生存期为7.9个月,一年生存者36%,两年为14%。女性、较年轻、KPS>80、转移瘤较少,原发癌控制好者生存期长。Frazier(2010)报告γ刀治疗237例脑转移瘤,其中34.2%为非小细胞肺癌,13.9%为乳癌转移,治疗后中位生存期为8.5月,脑转移瘤为1个,2~3个,4个以上中位生存期分别为8.5个月,9.4个月和6.7个月。年龄>65岁生存期为7.8个月,小于65岁为9个月。KPS<70中位生存期为2.9个月,KPS≥70则为10个月。即使对放疗有抵抗的肿瘤,如黑色素瘤SRS后局部肿瘤控制率可达97%,神经功能障碍改善率为53%,中位生存期从2.3个月提高到9个月,Serizawa(2009)报告治疗10163个脑转移瘤行SRS治疗,认为影响疗效最重要的因素是肿瘤的容积量,当肿瘤容积为≤1ml时,一年肿瘤控制率为99.5%,肿瘤容积量为(<1ml,≥4ml)时,一年肿瘤控制率为92.6%,(<4ml,≥10ml)时为87.3%,>10ml时为65.5%。如全脑放疗后再用立体放射外科治疗可增加局部肿瘤控制率,一年为92%,两年为80%,而单用SRS一年为71%,两年为52%(Serizawa 2009)。从2000—2006年12篇报告SRS治疗脑转移瘤3647例,肿瘤控制率为80%~95%,中位生存期为8~15个月(Serizawa 2009)。
3.外科治疗
由于神经外科麻醉、神经影像学和手术技术及设备的不断进步,使神经外科手术治疗脑转移瘤的疗效有所改进,手术适应证也在不断改进和放宽。原则上脑转移瘤病人原发癌肿已处于晚期,或身体其他部位有多发转移灶者或病人处于恶病质身体十分衰弱者都是手术的禁忌证,有人也将颅内多发转移瘤视为手术禁忌证,相反当原发癌肿已得到有效控制的脑转移瘤病人,治疗的好坏就直接关系到病人的生存期和生存质量了。单发性脑转移瘤在手术可接近区应全切除肿瘤然后行WBRT,这样可降低肿瘤复发率或延长复发时间。两个前瞻性研究报告进一步证实上述结果。Patchell(1998年)报告手术治疗46例脑转移瘤手术全切除,另外49例手术切除肿瘤后随之行WBRT,在随访中肿瘤原位复发者手术组为46%,手术加WBRT组为10%(P<0.001),其他部位复发手术组为70%,手术加WBRT组为18%(P<0.001),神经功能恶化手术组为44%,手术加WBRT组为14%(P=0.003),但二组生存期无统计学差异。
Patchell报告46例脑转移瘤,外科手术加WBRT总剂量为3600cGy,每日300cGy,共12天,其生存期为10个月,而单独行放疗者仅为3.75个月。Vecht(1993年)报告一组颅外病变稳定的63例单发脑转移瘤,外科手术加WBRT生存10个月,单独放疗为6个月,二组放疗方法相同,每日200cGy分二次给予,共2周。从几个临床随机对照研究(Mintz 2007)证实单发脑转移瘤、KPS>70个月,手术加WBRT优于单独WBRT,前者中位生存期为9.2~10个月,肿瘤复发率为20%,而WBRT中位生存期为5~6个月,肿瘤原位复发占52%(P=0.01)。
基于上述研究结果,对原发癌肿已得到控制,身体一般情况尚好的单发性脑转移瘤推荐外科切除肿瘤后行WBRT,但单发性脑转移瘤仅占脑转移瘤的1/3左右,在这1/3病例中,因肿瘤位于重要功能区或原发癌肿未能控制等因素,因此仅一半此类单发脑转移瘤能行手术切除肿瘤。
对脑多发性脑转移瘤病人,原则上不适于外科手术治疗,Bindal(1993)报告切除多发性脑转移瘤加WBRT,中位生存期为14个月,但Hazuka(1993)报告18例多发性脑转移瘤手术后中位生存期仅为5个月,且有较高的手术死亡率及后遗症,因此目前多数人推荐多发性脑转移应行WBRT,手术仅限于切除大的脑转移瘤危及病人生命者,或对病人预计能生存3个月以上为提高放疗疗效切除大的肿瘤,减少其容积使放疗更为有效。
4.化学治疗
虽然早在1965年Wilson和Garza首先用化疗治疗脑转移瘤,但对化疗的疗效尚难肯定,特别是多数化疗药物不能透过血-脑屏障。近年来的研究认为化疗的优点在于:①对某些转移瘤化疗是有效的;②化学治疗既可治疗脑转移瘤,又可同时治疗原发癌肿;③采取必要手段使血-脑屏障开放,可使化疗药物较好的透过血-脑屏障。恶性生殖细胞瘤、小细胞肺癌、乳癌等对化疗疗效尚好,有报告小细胞肺癌脑转移使用化疗药
物治疗后56%的病人临床症状好转,第一次治疗后3周检查CT也可显示肿瘤缩小,同样在34例乳癌脑转移病人中化疗后52%症状改善。中位生存期达13.1个月。近年来采用新型烷化剂替莫唑胺(temozolomide)治疗脑转移瘤日渐增多,认为其与放疗结合应用对脑转移瘤有一定效果,特别是对非小细肺癌、乳癌转移有一定疗效(Trudeou 2006,Kourousis 2009)。
5.脑转移瘤的复发与治疗
对治疗后残留的或复发的或又出现新的转移瘤都归入此类,外科和WBRT仍有31%~48%的脑转移瘤在治疗后不太长时间内复发,这是一个十分棘手的问题。目前可供选择的治疗方法有再次手术、外照射、立体定向放射外科或化学治疗。外科手术切除大的肿瘤可起到改善症状延长生存期的效果,其中位生存期可达6个月。Young,Kaye等认为对原发肿瘤已得到控制,KPS>60分,肿瘤对放疗不敏感者,肿瘤位于非功能区者可考虑再次手术切除肿瘤。Bindal治疗48例,经外科及WBRT后复发的脑转移瘤病人,再次手术切除肿瘤,无手术死亡率,中位生存期为11.5个月。对身体一般状况较好,原癌对放疗敏感者再次行放射治疗仍有效。













