英文名称 :breast adenosis;adenosis of breast
乳腺腺病(adenosis of breast)是乳腺小叶内末梢导管或腺泡数目增多伴小叶内间质纤维组织增生而形成的,是乳腺结构不良症的早期表现。乳腺腺病依其不同发展阶段,大致可分为腺泡型和硬化性。腺泡型腺病是腺病的早期阶段,小叶内末梢导管数目明显增多,小叶扩大、融合成片,边缘模糊。小叶内间质纤维组织增生,失去原有疏松状态。硬化性腺病在腺泡型腺病的基础上,乳腺小叶内间质结缔组织进一步增生,当硬化性腺病形成边界清楚肿块时称为腺病瘤。世界卫生组织(WHO)将乳腺腺病分为硬化性腺病、顶泌汗腺腺病、盲管腺病、微腺腺病和腺肌上皮腺病。硬化性腺病与浸润性乳腺癌有微弱的相关性。
(一)腺病
乳腺腺病(adenosis)是一种常见的良性增生性疾病,发生于20~40岁的女性。病变主要影响乳腺实质的小叶(腺泡)成分。腺病可合并纤维化,后者常导致腺体扭曲变形,形态可类似乳腺浸润癌。腺病病灶通常小,为镜下改变,但可广泛分布。部分腺病形成可触及的包块,称之为结节性腺病或腺病瘤。腺病有几种不同的组织学类型,但有关的诊断标准尚未完全统一。其主要改变是乳腺的腺泡和小导管明显的局灶性增生,并有不同程度的结缔组织增生,小叶结构基本失去正常形态,甚者腺泡上皮细胞散居于纤维基质中。
1.大体病理
肿块多为灰白色较坚硬的结节,无包膜,与正常乳腺组织边界不清。单发或多发,其大小<2cm。切面见灰白色或棕色半透明的颗粒状改变,有时和乳腺癌不易区别。
2.组织病理
镜下由上皮和肌上皮层组成的腺泡或腺管,围绕基底膜呈疏松的结构性增生。
(1)小叶增生型腺病:为腺病的早期形态,也称为单纯型腺病(pure adenosis),主要为乳腺小叶增生,小叶内导管及腺泡均增生,数目增多,小叶体积增大,纤维组织轻度增生,小叶内及小叶间见有淋巴细胞浸润,小叶境界仍保持清楚,小叶形态不规整或小叶间相互靠近。此型又可分为泡型和管型。泡型腺病主要是小叶内腺泡增生,数目增多,腺泡上皮增生成两层或多层并充满腺泡腔中。管型腺病主要为小叶内末端导管增生及腺泡导管化,导管数目增多,有的导管上皮增生呈乳头状突入腔内。
(2)纤维腺病型腺病:腺病的中期形态。此时小叶内腺管和纤维组织都增生并有不同程度的淋巴细胞浸润,增生的纤维组织将腺管彼此分开,小叶结构紊乱,腺管上皮增生呈多层或形成乳头状、筛状,甚至完全充满管腔。小叶内导管扩张形成微囊,当腺管和纤维组织进一步灶性增生时,可形成纤维腺病瘤。
(二)硬化性腺病
硬化性腺病(sclerosing adenosis)是腺病的最常见形式,是以小叶为中心的腺体和小管增生伴间质增生为特征的终末导管小叶单位(terminal duct lobular unit,TDLU)病变,间质增生可致程度不等的腺体受压变形和扭曲(图1)。
硬化性腺病的病变可单发或多发。其特点是小叶内纤维组织过度增生,致使腺泡萎缩乃至消失,只残留萎缩的导管。组成增生的腺体和小管是良性的,常表现为扁平的腺上皮周围有肌上皮层包绕。腺上皮细胞缺乏细胞非典型性,但是,当伴有顶泌汗腺化生时可表现令人担忧的图像。肌上皮细胞成分有些患者很明显,有些患者常规HE染色难以识别,应用肌上皮标记免疫染色可容易地识别,常用的肌上皮标志物如Calponin、SMMHC和p63。最重要的诊断特征是其在低倍镜下的结构。结节保持着圆形、卵圆形小叶轮廓,以小叶为中心,中心区细胞多于周边区。腺泡挤压和扭曲在病变的中心最明显,腺泡腔可以完全被挤压闭塞,导致在间质内出现漩涡状实体性细胞索。硬化性腺病的腺体内常见微钙化,顶泌汗腺化生区域也常见,但神经和血管浸润偶见。形成包块的病变常表现为各种生长方式混合存在的腺病,其中以硬化性腺病最常见,偶见硬化性腺病伴有导管原位癌或小叶原位癌。硬化性腺病在形态学上有时与乳腺浸润性癌相似,特别是与小管癌容易混淆。小管癌本质是浸润性,并且在显微镜下见不到正常的乳腺导管和小叶结构,小管癌的间质是促纤维组织增生性的,小管癌的小管一般不规则且有棱角,并且小管常呈开放状。硬化性腺病由扭曲增生或闭锁的腺体和小管构成,其间质是纤维性或硬化性的,保存有肌上皮细胞和缺乏非典型性上皮细胞。对于伴有原位癌的硬化性腺病,通过免疫组织化学证实肌上皮细胞的存在是除外乳腺浸润癌的关键。硬化性腺病继发成为浸润性癌的危险性似与普通的纤维性囊性乳腺病相同。
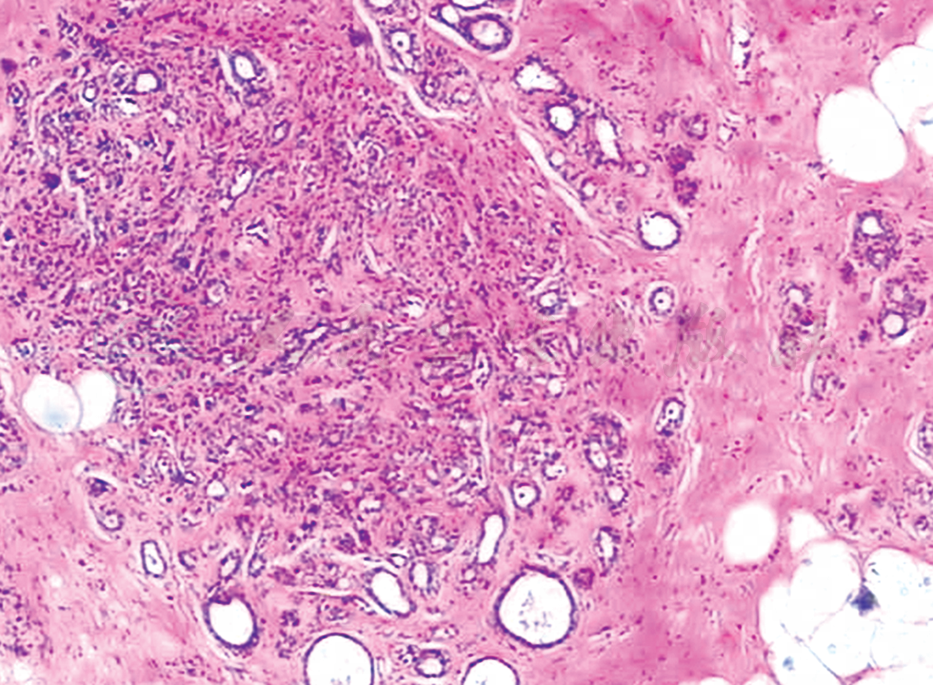
图1 硬化性腺病(HE低倍)
肌上皮及间质纤维组织增生,增生的腺泡受压变形
(三)顶泌汗腺腺病
顶泌汗腺腺病(apocrine adenosis)可用于指几种病变,这是一个意义含混的概念,特指硬化性腺病中伴有广泛的顶泌汗腺化生,顶泌汗腺化生在腺性区域中≥50%。顶泌汗腺上皮可具有细胞学非典型性,以至组织学表现有时与乳腺浸润性癌类似。有学者认为,它是一种潜在的癌前病变,存在c-myc基因蛋白的过表达,但无c-myc基因的扩增。
典型的顶泌汗腺细胞核大而显著(平均直径6~8μm),细胞呈柱状时常位于基底部,呈圆形至卵圆形,空泡状,核膜厚而光滑,染色质均匀,颗粒块状,通常有1个比较一致的核仁(一般直径<2μm,增生时约3μm),缺乏核分裂。根据顶泌汗腺细胞的胞质特点,主要有A、B两种类型细胞。A型细胞具有丰富的嗜酸性、颗粒状胞质,通常可见核上空泡,其中含有黄褐色的脂褐素。胞质嗜酸性颗粒常于腔面浓集(呈双折光性),容易观察到一圆顶状腺腔部分,常见有顶浆分泌型胞突。B型细胞属于广义的透明细胞,胞质淡染,透明,呈泡沫颗粒状(类似于皮脂样细胞),可出现大小不等的空泡(多见于不典型顶泌汗腺细胞),有时可见中间型细胞,其胞质嗜酸性颗粒分布紊乱,部分淡染加杂有胞质小空泡形成(图2)。
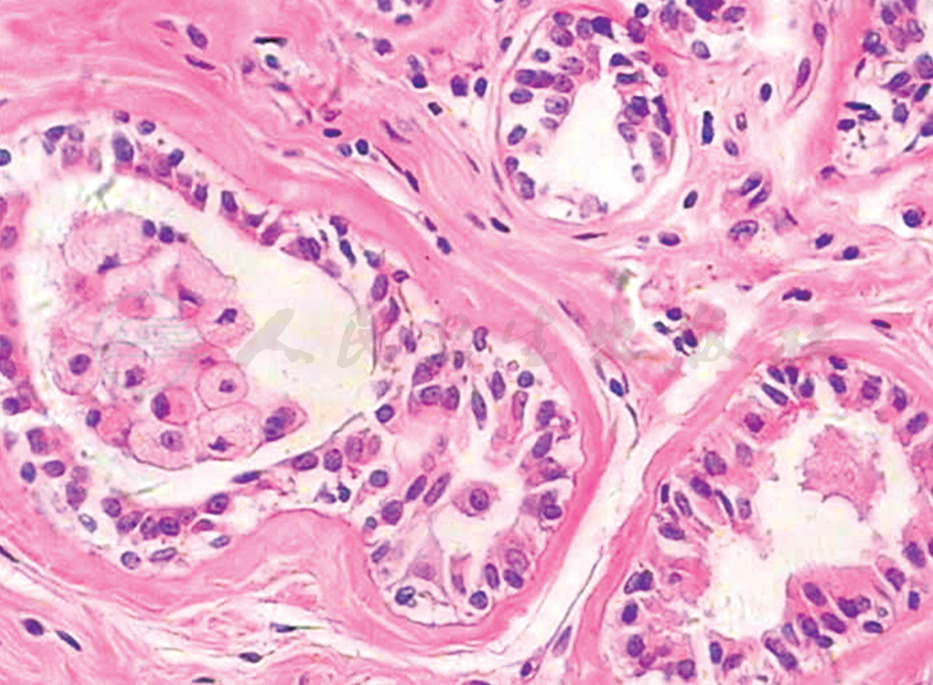
图2 顶泌汗腺腺病(HE高倍)
硬化性腺病伴有大量的顶泌汗腺化生
不典型顶泌汗腺增生性病变(atypical apocrine proliferations)主要包括不典型顶泌汗腺腺病和不典型顶泌汗腺型导管增生,两者均具有不典型顶泌汗腺细胞,其中不典型顶泌汗腺腺病主要表现为腺管增生,而不典型顶泌汗腺型导管增生则主要表现为顶泌汗腺细胞增生,并可出现异型性结构。目前,不典型顶泌汗腺增生性病变的诊断尚缺乏统一的界定标准。
不典型顶泌汗腺细胞核特征是判断不典型顶泌汗腺细胞最为重要的指标,以下4条表现中满足2条即可考虑细胞有不典型性。①细胞核的位置出现异常,核明显增大,与“正常”顶泌汗腺细胞比较,面积增大3倍、直径增长1.7倍。②核仁增大、出现多个核仁且大小不一。③核膜增厚不规则。④核染色质可呈细颗粒深染而细腻,核分裂常不明显。另外,不典型顶泌汗腺细胞的胞质常出现嗜酸性颗粒分布紊乱,胞质变淡,泡沫-空泡化,不典型细胞增多,缺乏坏死(图3)。免疫表型顶泌汗腺及不典型顶泌汗腺细胞GCDFP-15均呈阳性,雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、细胞角蛋白(cytokeratin5/6,CK5/6)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)均呈阴性;不典型顶泌汗腺细胞可表达人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)。
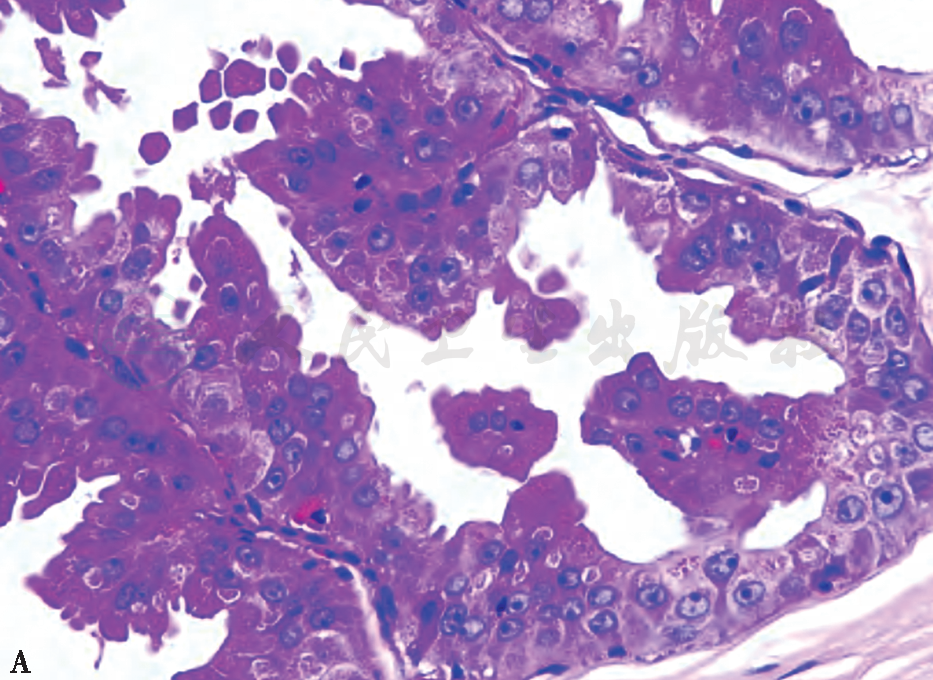
A 不典型乳头状顶泌汗腺囊肿
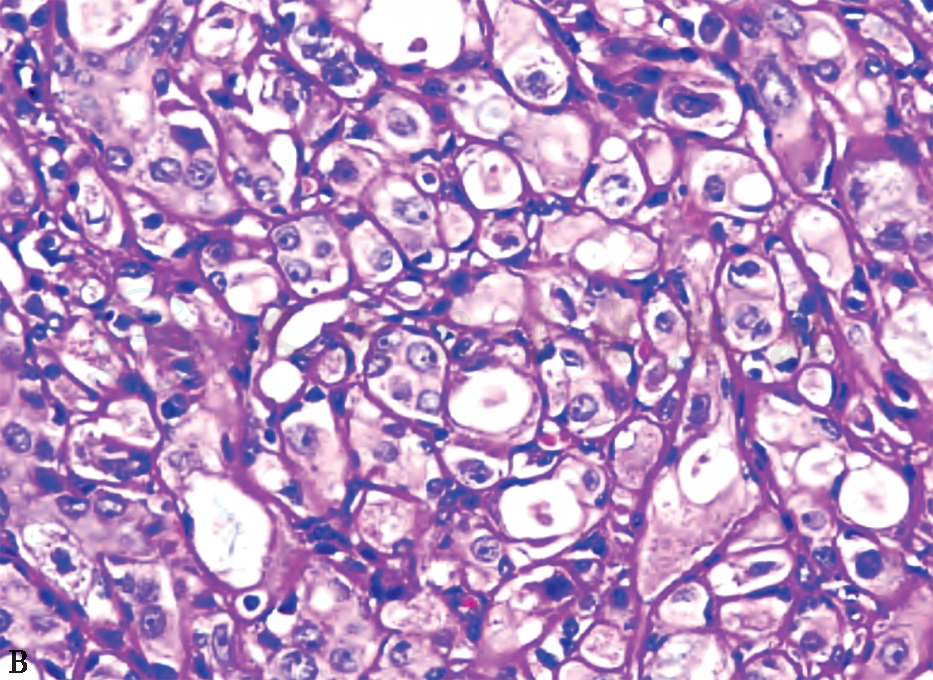
B 不典型顶泌汗腺腺病
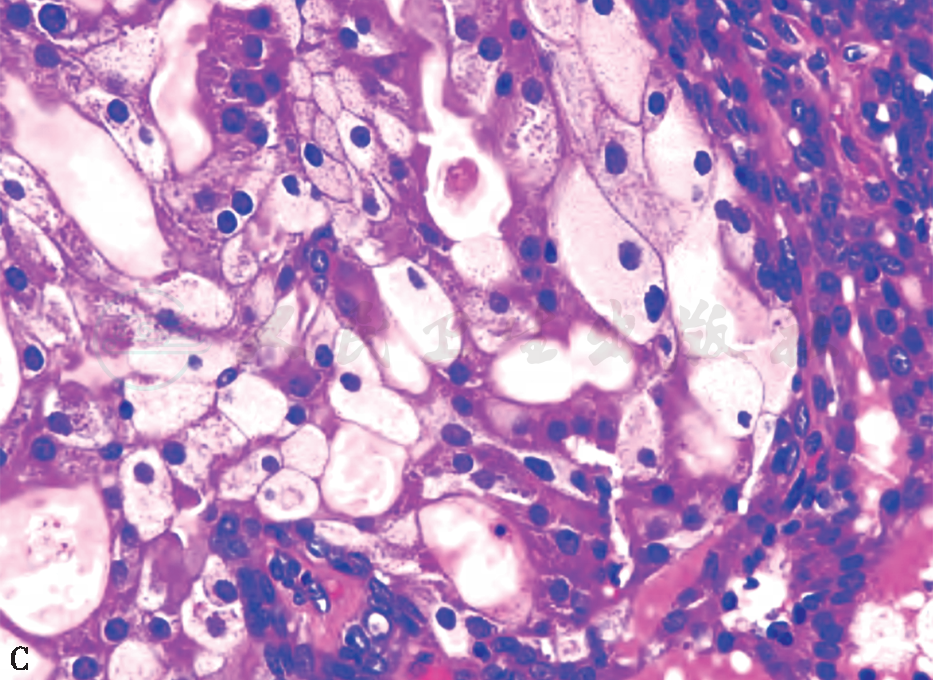
C 不典型顶泌汗腺型导管增生
图3 不典型顶泌汗腺增生性病变的 组织病理学表现(HE 高倍)
不典型顶泌汗腺腺病一般是在顶泌汗腺腺病基础上出现细胞学的不典型性,病变范围比较大。病理检查:镜检表现病变范围通常比较大(4~8mm),常出现小叶轮廓,有的融合成结节状。病变区内出现增多受挤压、密集的小腺管,其衬覆的顶泌汗腺细胞具有不典型增生,但不典型增生的定义尚无统一标准,主要表现为细胞体积及核增大,核面积较“正常”增大3倍,核形不规则,核仁增大或有多个核仁,罕见核分裂及坏死。胞质嗜酸颗粒分布紊乱,泡沫状或空泡化,可出现大的空泡类似于小腺腔,腺腔亦可扩张,衬覆的顶泌汗腺细胞扁平化,腔内可有分泌物,通常缺乏上皮的明显增生及结构上的不典型性,可伴不典型顶泌汗腺型导管增生及顶泌汗腺型导管原位癌。不典型顶泌汗腺细胞免疫表型雄激素受体(androgen receptor,AR)、GCDFP-15均呈阳性,ER、PR、CK5/6、Bcl-2均呈阴性。腺管周围有肌上皮,肌上皮标志物如p63、Calponin、SMA等阳性(图4)。
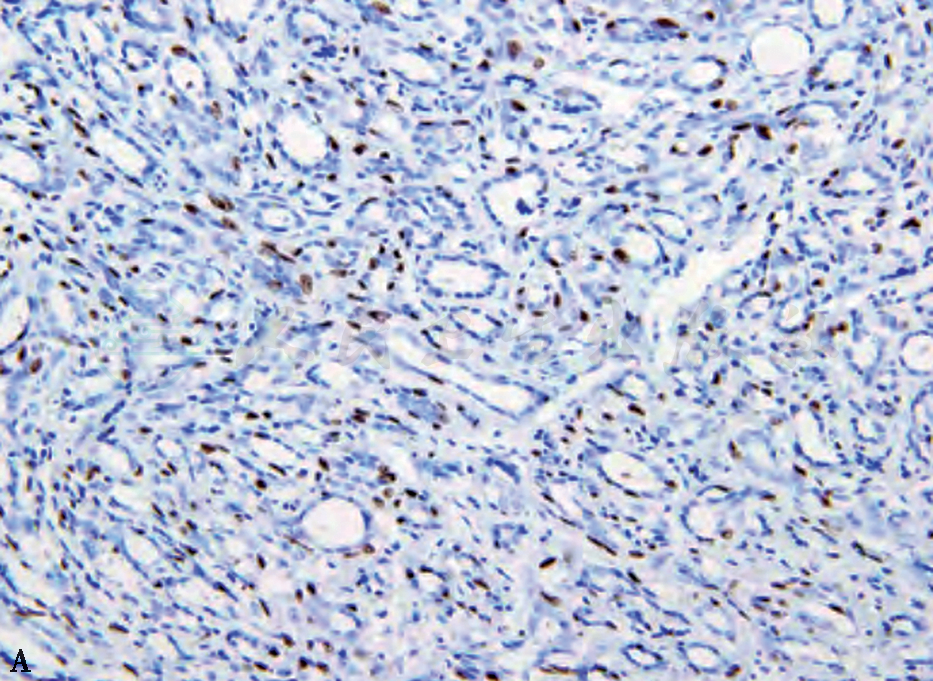
A 腺管周围肌上皮p63呈阳性
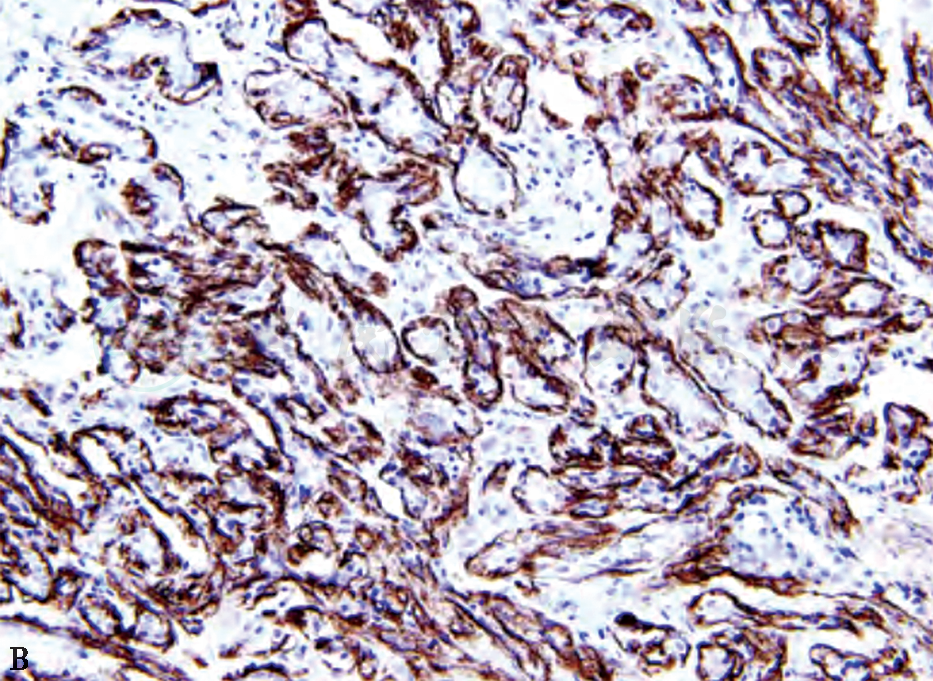
B 腺管周围肌上皮SMA呈阳性
图4 不典型顶泌汗腺细胞免疫组织化学表现(MaxVision 高倍)
不典型顶泌汗腺型导管增生通常是在顶泌汗腺细胞增生的基础上出现细胞学不典型性,常伴结构异型性,并局限在一定的范围内,达不到诊断低级别顶泌汗腺型导管内癌的全部诊断标准。诊断不典型顶泌汗腺型导管增生,无法完全套用普通导管内增生性病变谱系中的不典型导管增生的标准。目前尚未建立诊断不典型顶泌汗腺型导管增生的自身标准。O’Malley等主要根据细胞学的异型性进行诊断,病变范围<4mm,且不考虑组织学结构的变化。Tavassoli等在诊断时,需根据细胞学特征并结合组织学结构的改变进行考虑,病变范围<2mm。目前主要参照普通导管内增生性病变的诊断标准,根据顶泌汗腺细胞学上的异型性,特别是细胞核的异型性,在低级别顶泌汗腺细胞核级时,需结合结构异型性,如筛状、索条状、实性和微乳头状等。另外,也需结合病变大小(通常<2~4mm)进行综合判断。
(四)微腺性腺病
微腺性腺病(microglandular adenosis)是一种少见类型的腺病,其特征为小圆形腺体弥漫紊乱增生。腺体可呈簇分布,但通常缺乏硬化和挤压,周围胶原间质缺乏细胞或透明变性,无弹性变性。腺体腔圆,腔内常含碘酸雪夫染色(periodic acid-schiffstain,PAS)阳性、嗜碱性分泌物(图5)。
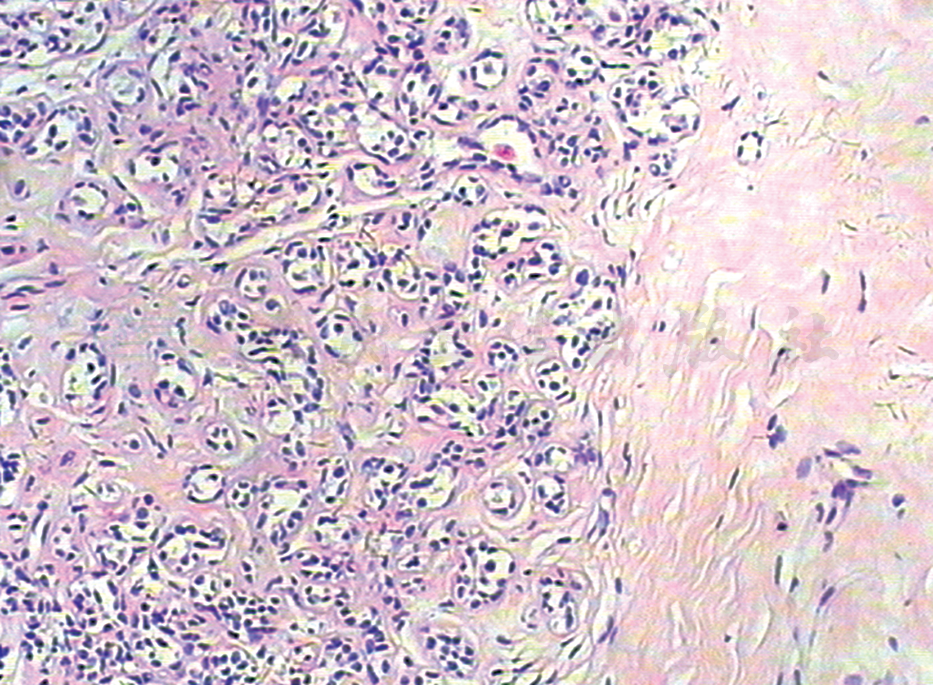
图5 微腺腺病(HE 低倍)
微小腺体分布在变性间质中
上皮为立方状,缺乏胞质顶突,胞质透明或嗜酸性颗粒状;细胞无非典型性核,缺乏肌上皮细胞,周围基底膜存在,但常不明显。免疫组织化学检测层粘连蛋白(laminin,LN)或Ⅳ型胶原可证实。电镜检查显示,分层的基底膜围绕微腺腺病的腺管。微腺腺病除表达CK,也可表达S-100。当微腺腺病伴发癌变时,可保留腺泡结构或为导管及特殊组织学形态。这些浸润癌的组织学亚型,大部分也保持S-100表达。微腺性腺病与小管癌相似,腺体也是单层细胞衬覆,没有外层肌上皮。但是与小管癌不同的是,微腺性腺病的腺体呈圆形,被覆单层立方形细胞,胞质透明到轻度嗜酸性,核小而规则,且腺体没有胞质顶端分泌现象,腺体周围有基底膜样物质包绕。有学者认为,微腺性腺病是一种潜在的癌前病变,可经过不典型微腺性腺病发展为原位癌和浸润癌,与高级别导管原位癌和各种类型的浸润性癌,甚至包括化生性癌和腺样囊性癌的发生有关。
该病治疗以药物治疗为主。一般采用疏肝理气、化瘀散结的方法,可用中成药乳癖消片、乳疾宁片、乳康片和乳结消颗粒等内服;一般不主张常规使用激素治疗,会因应用不当致体内激素紊乱,只有其他疗法无效或患者疼痛症状较重时,才可慎重使用。药物治疗疗效不明显或临床上不易与乳腺癌相鉴别时,可以手术切除局部肿块,术中行冷冻切片检查,以明确诊断,避免漏诊或误诊。













