英文名称 :hypertensive intracerebral hemorrhage
中文别名 :高血压脑出血
高血压脑出血是由于高血压病伴发的脑小动脉病变在血压骤升时破裂所致,称为高血压性脑出血。其原发于脑实质,为非外伤性自发性出血,出血也可扩展至脑室或蛛网膜下腔。
每年全球200万~300万人发生脑出血,占所有新发脑卒中的10%~15%,脑出血全球总发病率为24.6/(10万·年)。在我国,脑出血发病率为60~80/(10万·年),该数据远远高于西方国家和其他亚洲国家。脑出血中原发性脑出血占80%~85%,原发性脑出血合并高血压者占50%~70%。尽管脑出血约占脑卒中发病的20%,但其致死和致残率却远高于后者。
高血压脑出血多按照出血部位分类,多灶性出血罕见。也有按发病时间将其分为特急性、急性和亚急性,或按病情轻重分为轻、中、重型。
高血压脑出血按部位分为基底节区出血、丘脑出血、皮层下脑叶出血,脑干(脑桥)出血和小脑出血,其中最多见的是基底节区出血,约占全部高血压脑出血的50%。出血位于幕下的约占20%~30%,可以发生在小脑半球、小脑蚓部和脑干,脑干出血主要发生在脑桥,大约占全部高血压脑出血的3%~13%。
有人又将基底节区出血细分为壳核型(血肿局限于壳核内),壳核-内囊型(血肿向内侵犯内囊),壳核进展型(血肿以壳核为中心向周围扩展,累及内囊、半卵圆中心、放射冠和部分颞叶及侧脑室)和脑室型(血肿巨大,破入侧脑室和第三脑室)等4型。将丘脑出血细分为丘脑型(血肿小,局限于丘脑内)、丘脑-内囊型(血肿向外侵犯内囊)、丘脑底-中脑型(血肿向下侵犯丘脑底部和中脑)和脑室型(向内破入脑室)等4型。
临床分型的目的是便于指导治疗和判断预后。天津马景鉴、杨树源等1995年按CT所见和患者预后提出将高血压脑出血分为幕上和幕下两大类,幕上出血占71%,又分为浅表型(壳核、外囊和皮层下)、深部型(基底节内侧、内囊、丘脑)和脑室型(血肿主要破入脑室),其中深部型占59%;幕下又分为外侧型(小脑外侧)、中间型(蚓部和脑干)和混合型(小脑外侧和蚓部),其中外侧型占45%。幕上的深部型和脑室型死亡率明显高于浅表型,幕下的中间型和混合型死亡率高于外侧型,为降低死亡率,前者在治疗上应考虑更为积极的外科干预。
根据出血后患者的意识状态,临床又将其分为五级,以便记录比较,并作为判断手术指征时参考。五级为:Ⅰ级清醒或嗜睡,伴有不同程度偏瘫和/或失语;Ⅱ级:嗜睡或朦胧,伴不同程度偏瘫和/或失语;Ⅲ级:浅昏迷,伴偏瘫,瞳孔等大;Ⅳ级:昏迷,伴偏瘫,瞳孔等大或不等大;Ⅴ级:深昏迷,去脑强直或四肢软瘫,瞳孔单侧或双侧散大。
高血压脑出血的发病原因是脑内小动脉在长期高血压刺激发生慢性病变基础上破裂所致。由颅内大动脉直接发出小动脉的直径约为100~200μm的穿通血管,包括豆纹动脉、丘脑穿通动脉以及基底动脉的脑干穿通支等。这些微小动脉的慢性病变主要包括脑小动脉硬化、脑血管透明脂肪样变性以及粟粒状微动脉瘤形成等。
粟粒状动脉瘤又称微动脉瘤,主要指脑内小动脉某些局部呈纺锤样扩张,好发于基底核、丘脑、脑干等部位,是高血压脑出血的可能原因。出血多在脑实质,出血到一定程度形成血肿。血肿形成后,随时间进展而呈现不同的病理特点。超急性期(6h内),血肿形成边缘多不规则,血肿内一般无脑组织。血肿周围血管充血,局部高压引起周围脑组织受压移位、缺血、水肿和坏死。急性期血肿周围脑水肿明显,半球体积增大,压迫该侧脑室变形并向对侧移位甚至形成脑疝,脑疝常为脑出血致死的直接原因。24h后局部出现白细胞浸润,血肿开始溶解,呈果酱状或渐渐液化,周围新生毛细血管形成,巨核细胞浸润,血肿液化后连同周围液化坏死的脑组织一起被由小胶质细胞和血管外膜来源的细胞所吞噬,血肿因而逐渐被吸收。血肿液在早期呈黑褐色,渐呈棕色,最后变成草黄色液体。血肿周围的胶质和结缔组织增生,上有含铁血黄素沉着而呈棕黄色。少数血肿可机化。
长期高血压病可导致小动脉壁透明样变性,内膜下脂质和蛋白质沉着,累及全身小动脉,尤其以心、肾、脑血管受影响最大。由于小动脉壁的病变导致强度下降,在长期高血压的作用下,脑底部的穿支动脉可发生大量粟粒状微小动脉瘤,又称Charcot-Bouchard动脉瘤。这些细小的穿支动脉直接自颅底的大动脉发出,承受的血压高于其他部位同等直径的小动脉,在突然升高的血压冲击下容易破裂出血。自从一百多年前Charcot和Bouchard发现脑底部穿支动脉的微小动脉瘤后,上述小动脉改变导致高血压脑出血的学说已被广泛接受,但是什么原因造成小动脉壁变性、内膜下脂质和蛋白质沉着,这种改变能否逆转和如何逆转的问题,至今尚未有满意的答案。最近有人将开颅血肿清除术时找到的出血动脉仔细取出做病理检查,发现部分高血压脑出血患者的出血动脉存在内膜剥离现象,并形成夹层动脉瘤,此类病变导致的动脉破裂约占高血压脑出血的20%。
小动脉破裂出血后,血凝块释放的血管活性物质可以使动脉收缩,其周围的压力随着血肿量增加而升高,患者凝血机制无异常时,出血在数分钟到数小时后会自行停止,24小时后血肿通常不再继续增大。Kazui等分析了204例患者的CT影像,发现出血后3小时内血肿继续增大者占36%,6小时后占17%,但24小时后降至0。日本一组90例高血压脑出血,24小时内重复CT扫描,9例发现血肿增大。国内一组300例患者,早期血肿增大的为20.3%,其他一些报告见表1。总体上,脑出血后接受首次CT检查的时间越早,发现血肿扩大的概率就越高。血肿增大的原因多与出血后血压过高有关,而发病后经常出现的颅内压升高、频繁呕吐、呼吸道梗阻等均可导致血压升高。此外患者凝血机制障碍(如正在服用抗凝药物)、过度使用药物脱水等也可能导致血肿增大。如何预测早期血肿扩大,目前尚缺乏可靠方法,临床发病后患者症状不断恶化时,特别要考虑是由于出血未停止,血肿增大所致,应及时复查CT。文献报告对脑出血患者行CTA检查,如发现血肿内存在斑点样或线状增强,即“斑点征”(spot sign),可独立预测血肿将增大。脑内血肿早期增大的患者预后较血肿稳定者差。
表1脑内血肿发病早期扩大的部分报告
脑内血肿开始是暗红色的血凝块,沿白质纤维间隙扩张,数小时后略收缩变硬,不易吸除。周围脑实质受压缺血,可导致点片状坏死出血。此后的1~2周内血肿逐渐自溶,其内的血红蛋白在1~2天中自外向内逐渐由氧合血红蛋白转变为脱氧血红蛋白,其后数周到数月内在炎性细胞浸润作用下被分解吸收,遗留下胶质增生和含铁血黄素沉着,最终形成小的空腔。
脑内血肿占位效应及血肿在形成和降解过程中释放的生物活性物质,导致脑内发生一系列病理变化和器质性损害(图1)。

图1脑出血后的病理生理改变
出血量超过颅内有效代偿容积后,如不采取治疗措施干预,其病理过程将自然形成恶性循环,升高的颅内压使脑血流下降,缺血缺氧的脑组织发生代谢障碍和水肿,使颅内压进一步升高,病人情况进行性恶化,多在数天内死亡。出血量少时,仅影响局部脑组织,导致部分神经功能障碍,不形成致命的恶性循环,病人度过急性期后,脑水肿消退,血肿逐渐吸收,形成裂隙样空腔,周围胶质瘢痕增生。存活病人神经功能可以部分恢复,但多留下永久性损害
Suzuki和Ebina最早指出脑内血肿除占位效应外,还有毒性作用。Kanno等在大鼠脑神经元培养液中加入不同浓度的血红蛋白,24小时后检测神经元活性。发现神经元活性降低程度与血红蛋白浓度有关,高浓度血红蛋白对神经元有毒性作用。
脑水肿是脑损伤的重要表现,实验证实,由于凝血级联反应,凝血酶原激活转变为凝血酶,后者具有神经毒性作用,是导致脑水肿的主要原因。正常循环血液中不存在可以测出的凝血酶,但在脑出血后,通过凝血级联反应每毫升血浆可产生210~360U凝血酶,仅1U凝血酶就可使1ml血液在15秒内凝固。已证实由凝血酶原转变为凝血酶的程度与血肿周围脑水肿程度一致,并可被凝血酶抑制剂(如nexin-1蛋白酶、水蛭素)所抑制。有实验分别用全血或惰性油蜡混合物注入鼠脑,发现仅全血造成周围脑水肿。用微球囊模拟占位效应,可造成脑血流下降,但在头24小时内并无脑水肿出现。用猪脑出血模型试验,24小时内血块收缩,血肿体积变小,周围脑水肿反而明显,同时发现血肿周围血清渗出后1小时,即出现脑水肿。体外实验发现,凝血酶可抑制鸡和鸟的脊髓运动神经元,诱发其退变、死亡。在C6胶质瘤细胞培养液中加入凝血酶,24小时后标志脑细胞损伤的乳酸脱氢酶(LDH)明显增加,培养液中凝血酶≥500nmol/L时可致星形细胞和海马神经元死亡。
此外,动物实验及临床应用SPECT及PET观测结果表明,脑出血后血肿周边存在着脑血流量下降现象,其程度与血肿大小及部位有关,小量出血使局部血流短时下降,大量出血则可致同侧半球长时间缺血。丘脑出血引起的双侧半球血流下降较之壳核出血更明显,且持续时间长,表明出血部位越靠近中线,脑血流改变也越明显。缺血将导致脑组织细胞能量代谢障碍,ATP储备耗尽后,细胞膜的正常跨膜电位不能维持,钠离子、钙离子和水内流,兴奋性氨基酸释放,自由基生成,最终使细胞肿胀坏死。动物实验表明,当脑血流量下降到20ml/(min·100g)脑组织以下,脑的功能即受到损害,低于10~12ml/(min·100g)脑组织,2~3小时内即可发生脑组织梗死。正常成年人颅内代偿容积有限,幕上约为60ml,幕下15ml左右。大脑半球出血量﹤50ml时,对颅内压及脑灌注压的影响还是可逆的,如超出此耐受阈值,血肿占位和对脑组织的毒性作用造成的颅内高压和脑血流量下降将形成恶性循环,导致患者死亡。
经受住了脑出血急性期打击的患者,随着血肿的逐渐吸收,症状逐渐好转,进入延续1~2年的恢复期,多数患者最后会遗留或轻或重的神经功能障碍,仅少数出血量少,或出血部位在非重要功能区的患者可以完全恢复。
(一)计算机断层扫描(CT)
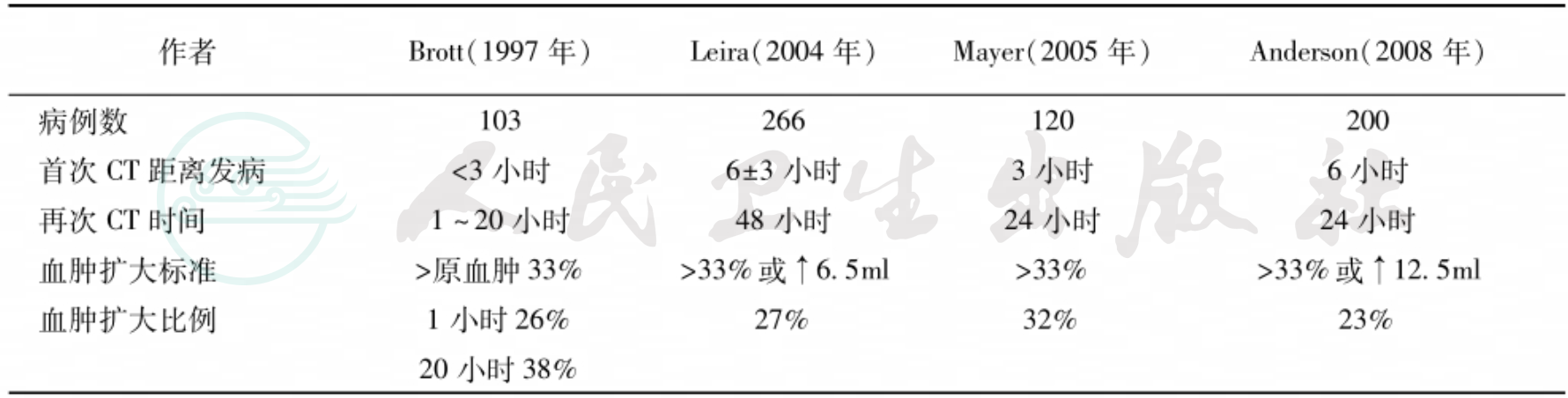
头部CT是最重要的辅助检查手段。在CT设备已经普及的今天,对怀疑有脑出血的患者应立即行常规头部CT扫描。初发病时脑内血肿在CT平扫上呈现明显的不规则片状高密度影(CT值约28~45Hu),边缘清晰,与周围的脑组织(CT值约15~27Hu)极易区别。数小时后,血肿周围脑组织水肿可出现低密度区,脑内结构受压移位。4~7天后血肿的密度逐渐减低(每天降低约2Hu),2~3周后血肿的CT值与脑组织相同,此时不要误以为血肿已吸收(图2~图4)。CT检查可以迅速明确诊断,确定出血部位并计算出血肿体积,必要时还可以重复检查,动态观察血肿变化。在常规CT片上也可以用改良的椭圆体体积公式(血肿体积≈血肿长径×宽径×高径/2)简单地估计血肿体积。准确掌握血肿的部位、大小、脑组织水肿和脑结构移位程度,对于决定下一步应采取的治疗措施和判断患者预后帮助极大。
原发性单纯脑室出血甚为少见,临床上多数(>80%)为脑室附近实质内出血破入脑室,依序为:底节、丘脑、小脑、脑桥。脑室出血后,如脑室液中血细胞比容>16%,CT片上才能表现为出血,如<12%则不能提示。此外,脑室液CT值为20~40Hu提示为血性脑室液,40~80Hu则为血凝块。
多层螺旋CT动脉血管成像技术(CTA)可以显示脑内主要血管影像,排除血管畸形,有助于判断破裂出血动脉的部位及是否有活动出血,预估血肿继续扩大的可能性。

图2典型壳核出血的CT图像,可见血肿将内囊向内推挤,并破坏部分内囊进入苍白球并破入侧脑室

图3图2患者经小切口“锁孔”开颅血肿清除术后1天,CT复查可见直径约2.5cm的骨窗及脑内的引流管影,血肿清除满意,脑室移位已基本恢复,但脑内和脑室内仍可见积血
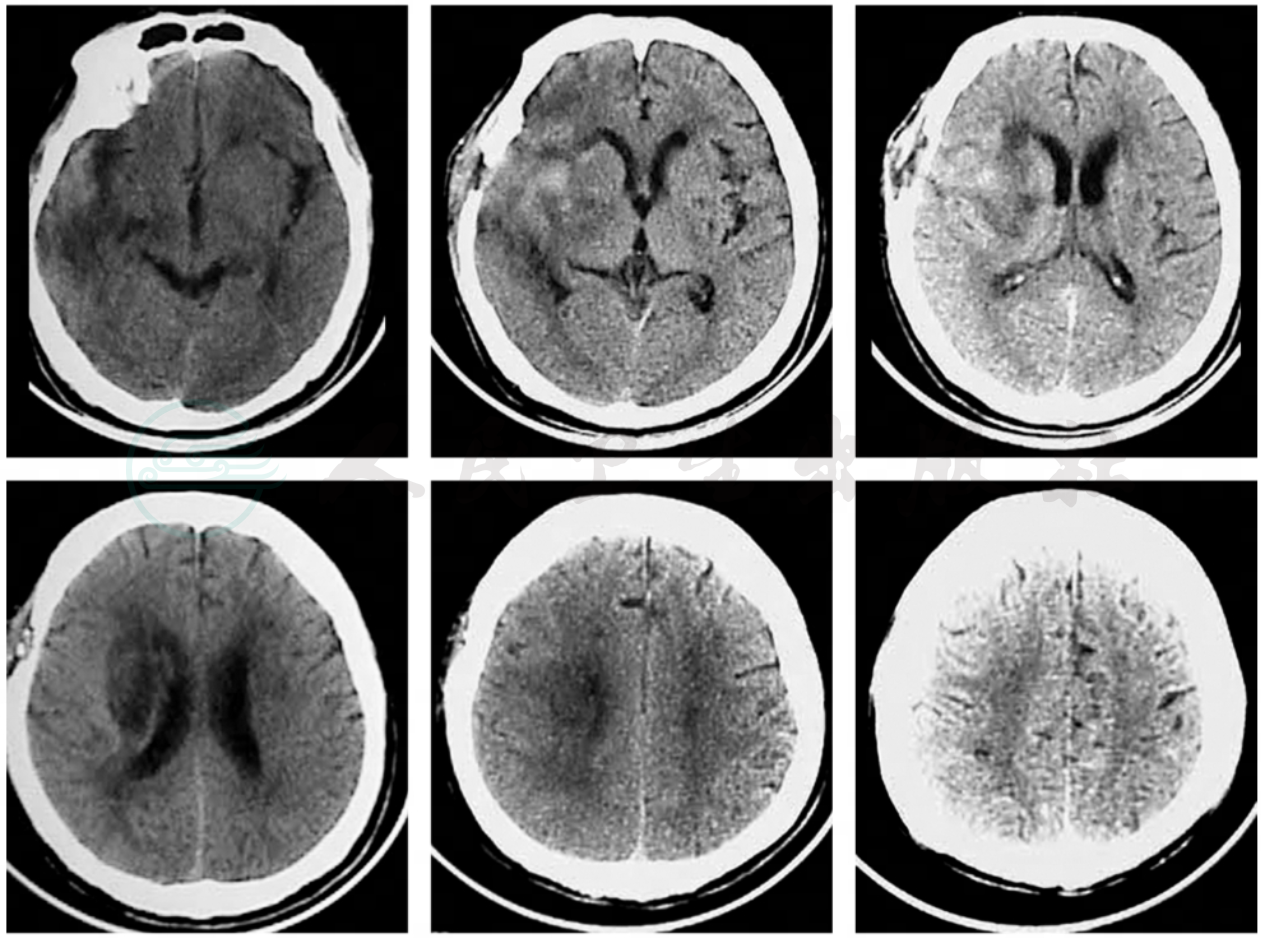
图4同一病人手术后15天,脑内血肿已消失,脑室及中线结构已恢复正常位置
(二)脑血管造影
脑血管造影通常极少能直接看到造影剂溢出破裂动脉,也不能显示血肿本身,本身有一定风险,且耗时费力,但在脑出血的鉴别诊断上脑血管造影仍然有不可替代的作用。对不典型的自发性脑出血,怀疑有脑血管畸形或动脉瘤破裂的患者,除可采用CTA外,必要时应考虑行脑血管造影(DSA)明确诊断。
(三)磁共振扫描
不同时期的脑内血肿在磁共振(MRI)扫描影像上有不同的特点,详见表2。MRI可以满足高血压脑出血的诊断要求,根据脑内血肿在MRI影像上的特点,还可以大致判断出血的时间,是否有反复多次的出血等。但MR检查需要患者较长时间(10分钟以上)静止不动地躺在扫描机内,这对已有意识障碍的患者很难做到。由于CT可以快速准确地做出脑出血的诊断,完全能够满足临床治疗的需要,价格也比MR低很多,因此一般不用MRI作为脑出血患者的首选检查,仅在患者度过脑出血急性期后,诊断上有疑问,需要进一步查明出血原因时,才考虑选用MRI检查。
表2脑出血不同时期影像学检查的表现

(四)其他
在不具备以上检查条件时,既往曾用颅脑超声检查以发现可能存在的中线结构移位,但准确性差,早已废用。血肿破入脑室或蛛网膜下腔时,腰穿脑脊液可以呈血性或红细胞计数升高,有助于脑出血和脑梗死的鉴别。CT已明确诊断的患者,无须再行腰穿检查。
高血压脑出血的治疗可分为内科保守治疗和外科手术治疗。据国外现有的前瞻性临床研究表明,两种治疗方法的死亡率和致残率大体相同,外科治疗并未显示出明显的优越性。但近年来国内的大宗病例总结显示,早期手术清除血肿可以使重型患者死亡率显著降低。
(一)内科保守治疗
主要的治疗原则分述如下:
1.控制动脉血压
过高的动脉血压是脑内破裂动脉出血不止、血肿继续增大的主要原因之一。因患者同时有高颅内压存在,为保证足够的脑灌注压,平均动脉压亦不宜过低。应将血压平稳控制在一个合理的水平,可选用有效降压药物将血压控制在发病前的基础血压水平。因病情一般都很重,多用压宁定(盐酸乌拉地尔)等药静脉滴注,快速将血压控制在预期水平。最新研究表明,发病后血肿周围的脑组织血流量较对侧有显著降低,但收缩压控制在150mmHg左右的患者,与收缩压控制在180mmHg的患者比较,血肿周围脑组织血流量没有显著差别,支持2010年美国脑出血治疗指南提出的脑出血后快速将收缩压控制在140mmHg是安全的提法。
2.合理使用止血药物
发病早期可以适当使用止血药物使破裂血管的出血尽快停止,发病24小时后出血通常已经停止,此时再用止血药则无意义,反而有可能增加脑血管和其他部位血管发生血栓(如下肢深静脉血栓形成)的风险。长期口服华法林抗凝的患者,发病早期(6小时内)需要立即注射维生素K1,有条件者可以静脉注射凝血酶原复合体浓缩物或重组凝血因子Ⅷa,促使凝血功能尽快恢复正常。
3.降低颅内压,控制脑水肿
发病早期可以使用甘露醇脱水。肾功能不好的患者则要慎用甘露醇等高渗性脱水药,可减少其用量,并配合使用呋塞米等利尿剂。度过急性期后,高颅内压趋于缓解时,可改用甘油果糖等较缓和的高渗性脱水药。如果患者因下丘脑损害和大量利尿而出现低血钠,可使用3%~5%的高张氯化钠100~200ml/次静脉滴注,能同时起到补充血钠和高渗脱水降低颅内压的作用。
4.预防肺部感染和消化道出血等并发症
可预防性使用抗生素和降低胃酸分泌的药物,昏迷患者应考虑尽早施行气管切开术以便于呼吸管理和排痰,有胃肠道麻痹的患者应置胃肠引流管,减轻腹胀,避免胃内容物反流误吸导致吸入性肺炎。
5.一般治疗
注意患者的护理,定时翻身拍背,适当吸氧,保持呼吸道通畅。监测并保持患者的水、电解质平衡和营养平衡,胃肠道功能恢复较好的患者可以早期适量进食进水,或经胃管滴注要素营养液。治疗患者可能存在的基础疾病如糖尿病、冠心病等。卧床少动的患者应该使用下肢气动按摩装置,高危患者在活动出血停止后(发病或术后1~3天)可以使用低分子肝素预防深静脉血栓形成。
上述内科保守治疗原则也是外科手术治疗的基础,多数血肿体积较小的患者可以经保守治疗获得好的转归。
(二)外科治疗
本世纪初始,神经外科医生即努力探索外科疗法。1903年Harvey Cushing指出:脑出血后继发脑水肿较出血本身所致的损害还重,并提出了手术治疗的指征及可行性。1932年Bagley认为,手术效果和出血部位密切相关,深部者预后不佳。次年Penfield报道2例手术成功,此后虽有些零星报道,但由于术前对出血量、出血部位及其影响范围不能作出准确判断,加之对手术适应证、手术时机的认识不尽一致,所以结论各异,疗效并不理想。
高血压脑出血手术治疗的目的主要是清除血肿、降低颅内压,使受压的神经元有恢复的可能性,减少或防止脑出血后一系列继发性病理变化,挽救生命及争取部分神经功能恢复。CT的问世,不但解决了血肿定位和定量问题,而且结合患者的临床表现,基本上统一了对手术适应证的认识。此外,手术方法的改进也起到了很大作用。随着近年来微创外科技术的发展,神经外科医生已经可以在CT等先进的定位手段帮助下,通过小切口锁孔开颅,在手术显微镜下准确清除血肿,或在CT引导监测下简单地经皮钻孔穿刺抽吸血肿,大大减少了手术创伤,使得手术治疗的死亡率较内科保守治疗明显下降。
1.手术适应证
临床回顾性分析表明:无意识障碍者,多无需手术;有明显意识障碍、脑疝尚不明时,外科治疗优于内科;深昏迷、双瞳扩大、生命征趋于衰竭者,内、外科疗法均不理想。CT立体定位,血肿穿刺吸除术以及注射纤溶药物溶解血肿的方法,由于定位准确、创伤小,除用于常见部位出血外,现已用于脑深部出血,如丘脑、脑室出血,脑桥出血,手术适应证也较宽。
目前,关于脑出血的手术适应证可从下述几点综合考虑:①出血量:通常皮质下,壳核出血大于30ml,小脑出血大于10ml即有手术指征。②意识状态及其程度:根据出血后患者意识障碍程度,Ⅰ级者一般不需手术。Ⅴ级者由于已处晚期,手术很难奏效。Ⅲ级者最适合手术治疗,Ⅱ、Ⅳ级者中大多数也适宜手术,但Ⅱ级如出血量不多,也可先采用内科治疗,根据病情变化再定。Ⅳ级者如高龄、病情进展快,脑疝时间已较长,估计预后欠佳者不考虑手术。③部位:浅部位出血要多考虑手术,如皮质下、壳核出血。小脑出血位于容积较小的后颅凹,并靠近脑干,早期多无意识丧失,在出现不可逆的恶化之前也常无明显先兆。为了防止意外发生,手术是唯一有效的治疗,除非临床症状轻微,出血量很少(小于5ml),可以保守治疗,密切观察患者变化。脑干出血如发生在中脑或延髓,患者多迅速发展为不可逆的深昏迷,没有手术机会。单纯脑桥出血的患者早期生命体征如能稳定,且出血量大,也可以行手术清除血肿,早期手术虽然有一些成功的报告,但仍有较高的死亡率,要慎重对待。④出血后病情进展迅猛,短时内即陷入深昏迷,常提示出血量大且深在,预后多不佳,手术应慎重考虑。⑤年龄及一般状况:病前有心、肺、肾等脏器严重疾患,高龄且日常生活已不能自理者,术后恢复通常困难,效果很差,一般不宜手术。
对临床医生非常重要的是,手术前应仔细向患者家属说明病情及手术危险性,告知可能发生的残疾和能达到的生存质量,使家属对手术效果有充分理解,并取得家属一致的同意。
2.手术时机
动物实验已经证实脑出血30分钟后,邻近的脑组织出现“海绵样改变”,3小时后范围扩大,6小时后紧靠血肿的脑组织坏死,周围血管特别是静脉出血,12小时后坏死出血相互融合,说明出血后造成的不可逆性损害,多在3~6小时左右即已形成。尸检统计表明,多数脑出血死亡病例都在出血后早期死亡,因此早期手术有可能降低脑出血死亡率和病残程度。事实上,Kaneko等报告的两组病例(38例、100例),在出血后7小时内超早期手术,其结果无论从死亡率(7%~7.8%)及功能恢复(63%生活自理)均明显优于以往报告。
超早期手术的主要问题是再出血。多数患者的活动性出血在发病最初的几十分钟内就已经停止,但如前述,仍有约20%~30%的患者在发病24小时内脑内血肿增大。因此,超早期手术必须要考虑在清除血肿的同时有效止血的问题,才能提高治愈率及患者的生存质量。美国2010年发表的脑出血治疗指南对超早期微创脑内血肿清除术的好处持怀疑态度,不过国内一组多中心研究报告,529例发病后不同时间段行微创血肿穿刺部分吸除+引流术患者,术后再出血的比例为8%~16%,各组间并无统计学差异,3个月时的死亡率和生存质量也无差异。综合目前脑出血的治疗现状,对有明确手术指征的病例,发病后意识模糊但状态稳定,血肿量<60ml的患者,可以考虑推迟到发病24小时后再行手术,以减少术后再出血的风险。血肿量大,意识障碍有加重趋势,随时可能发生脑疝的患者,则应尽早手术,争取机会挽救患者生命。
3.手术前准备
脑出血发病突然,病情进展快,脑损伤的程度在数小时内可迅速加重,因此手术前正确处理对减轻继发性脑损伤,改善预后极为重要。
发病早期患者常有头痛,呕吐及一定程度的意识障碍,在运送患者时要注意避免误吸,保持呼吸道通畅,避免因舌后堕而呼吸困难,导致缺氧,加重脑损害。急诊室初步判定为高血压脑出血后,应立即给予20%的甘露醇静脉快速输注,吸氧和留置导尿,静脉给予降压药控制过高的血压,同时尽快行CT扫描明确诊断,完成血常规等必要的化验检查。如果适合手术治疗,应立即剃头备血,争取尽快手术清除血肿,解除对脑组织的压迫。
4.手术方法
(1)开颅血肿清除术:可采用皮骨瓣成形开颅或钻孔扩大骨窗法。以壳核出血为例,通常在额颞或颞部作马蹄形切口,行骨瓣开颅,也可在血肿距脑皮层表面最近的部位,例如在颞部颧弓上钻孔,穿刺抽出部分积血初步减压后,再延长切口,扩大骨窗直径至3cm左右。剪开硬脑膜后,在手术显微镜下,于血肿距皮层最近处(颞上或颞中回)切开皮层,或经侧裂显露岛叶,在岛叶皮层上切开,进入血肿腔,将血肿清除。小脑出血可根据出血部位,于枕下行中线或旁正中直切口,钻孔后扩大骨窗,十字剪开硬脑膜,穿刺证实后,切开小脑,行血肿清除。脑桥及延髓出血采用枕下入路,中脑出血采用颞下切开小脑幕入路进行手术。
清除血肿时,应在显微镜下于血肿腔内操作,吸引力不要过大,以免损伤周围组织,遇有动脉活动出血,要用双极电凝妥善止血,或用钛夹夹闭。粘连过紧的小血块,可能贴近原发出血点,应予以保留。对血肿周围的脑软化带尽量少扰动,已形成的血肿“包膜”除非诊断需要,不必处理,以免加重损伤。妥善止血后,血肿腔内留置引流管,结束手术。
皮骨瓣成形开颅清除血肿多需全身麻醉,手术创伤大,增加患者负担,现已很少采用。钻孔扩大骨窗法创伤较小,局麻下即可进行,同样可以彻底清除血肿,达到立即减压,且止血满意。
(2)脑室穿刺引流:对出血破入脑室或主要是脑室出血的患者,可行脑室穿刺置管持续引流,脑室内出血量大或已铸型者,可行双侧侧脑室额角穿刺置管持续引流,并经该引流管缓慢注入生理盐水5~10ml+尿激酶1万U/次,夹闭30分钟后再开放,每天2次,将积血融化引出,维持引流数日。
(3)血肿穿刺吸除术:早年由于对血肿部位及出血量不能作出准确判断,仅盲目穿刺,且无法了解抽出量占全部出血量的多少,因此效果不佳。有时还增加再出血机会。CT问世后,随着临床和实验研究的不断深入,穿刺吸除血肿由于创伤小,操作简便,目前已被广泛采用。
根据CT定位,利用立体定向技术或简易定位标尺,标出血肿中心,以此为靶点,确定穿刺点。穿刺点应选在血肿距头皮最近、无大血管或重要功能区处。国内现有专用脑内血肿穿刺套件,局部麻醉下用带硬质套管的钻头直接穿过头皮钻开颅骨并刺入血肿腔,由于外套管一次刺入不再移动,与头皮、颅骨、脑膜及脑组织密贴,减少了损伤出血的概率;或采用常规头皮切口,乳突拉钩牵开后用颅钻钻孔;或在头皮行小切口后,用骨锥直接锥孔,再将穿刺针或吸引管准确置于血肿中心。用注射器抽吸血肿时,抽吸压力可根据血肿性状掌握,有些实验已计算出使用负压范围(31.7kPa)以保证安全。术中如能吸除出血总量的60%~70%,脑受压即可得到一定缓解,剩余部分可置管引流解决,以免颅内压波动过大,并防止再出血及对周围脑组织造成损伤。出血后数小时内血液凝固,液态血肿仅占血肿量的1/5,如果不易吸出,不可强求,可用生理盐水冲洗使血肿破碎后再行吸除,但要控制冲洗压力,避免损伤脑组织。术毕计算吸出总量,对残留血肿可注入尿激酶进行溶解,以利引流排出。术后可随时行CT复查,并视有无再出血及时采取相应措施。
对血肿破入脑室者,可先吸除脑实质内出血,再根据出血量行一侧或双侧脑室外引流,并定期注入尿激酶。
穿刺吸除血肿法适用于各部位出血,特别是深部出血,如丘脑出血、脑实质出血伴脑室出血,进展缓慢的脑干出血也已有成功报道。由于本法不能止血,故只有无活动出血方可进行,有人认为以出血后3天为宜,特别是合并应用尿激酶时,以减少再出血机会。但文献中也有不同看法,一组505例报告,出血后1~3天吸除血肿的占84%(424例),全组再出血仅2例。另一组1041例穿刺后再出血率为3.2%,指出再出血与早期特别是超早期手术、过度吸引、术中血压过高(>27kPa)有关,并提出血肿清除率以65%~75%为稳妥。
作者认为,发病6小时内,CT怀疑有活动出血的患者,应给以止血药物治疗,不能延期手术的,以小骨窗开颅血肿清除术为宜,术中可以发现并处理出血动脉。穿刺吸除法在发病24小时后施行较为稳妥。值得提出的是:超早期使用穿刺抽吸治疗,置入硬质套管吸除部分血肿后,如果遇到活动出血,可以向血肿腔内注入注射用凝血酶(立止血)1kU,保留3分钟,出血多可停止。然后用生理盐水反复冲洗至水清,并及时复查CT,必要时转行开颅血肿清除术。此外对小脑出血者建议慎用。
(4)神经内镜清除血肿:内镜应用历史虽长,但科技含量高的神经外科专用内镜,则是近十余年发展起来的。专用内镜已可制成细管径(<5mm)、多视角、照明良好以及可供吸引、冲洗、电凝的通道。由于其具有微创特点,应用范围日益扩大,无论脑室或脑实质内出血均可采用,除可满意清除出血,还可通过电凝或激光止血。Auer等(1989年)报告50例脑内血肿采用内镜清除,并和50例内科治疗组进行随机对照。结果:6个月时两组病死率分别为42%和70%,提示内镜治疗明显优于内科治疗组。上述结果在Fernandes等对7组脑出血进行Meta分析后,被认为是唯一能表明外科治疗对ICH是有益的。国内几组报告于发病后2~42小时,经CT导向定位,行内镜清除血肿,吸除血肿占总量的70%~80%,效果满意。虽然文献报告术后可发生再出血(12.5%),但国内尚少遇到,可能与例数不多有关。无疑,内镜为高血压脑出血提供了一新的微创治疗手段。
5.术后处理
无论何种手术治疗,术后处理要注意:①保持血压稳定,防止过高造成再出血,过低导致脑血流不足;②控制颅内压增高,减少因高颅压所致的继发性损害;③防、治并发症,加强护理,保持水电解质平衡,以及补充营养等。术后常见的并发症是肺部感染、消化道出血、泌尿系感染、肾衰竭等。当患者度过急性期后,即可逐步进行语言、肢体等神经功能康复治疗。
6.手术效果
CT应用前手术死亡率一般多在50%左右,与内科保守治疗相当。近十余年来,由于对血肿准确的定位,采用早期或超早期手术,死亡率已明显下降。一组505例急诊锥颅治疗高血压脑出血报告,死亡率为19.8%。国内30单位参加的脑出血治疗协作组,采用钻颅”碎吸”血肿1041例,死亡率为22.3%。应用开颅超早期手术清除119例壳核出血的报告,全组无死亡率。另一组73例重症高血压脑出血超早期手术死亡11例,死亡率13.1%。此外,丘脑出血穿刺吸引手术例数也日益增多,死亡率大都在30%以下。小脑出血手术91例,死亡9例,死亡率9.8%。北京中日友好医院神经外科2001年1月~2003年1月两年中连续手术治疗高血压脑出血患者98例,主要采用超早期小骨窗开颅显微血肿清除术和立体定向穿刺血肿抽吸术,死亡20例,死亡率21%,手术治疗效果满意。
7.影响疗效的因素
(1)术前意识状态与手术疗效有极大关系 意识状态Ⅰ~Ⅴ级分类中,各组死亡率分别为0,13%,32%,64%,94%。国内120例手术结果:术前无昏迷的39例无死亡。浅至中度昏迷50例,死亡8例(16%),深昏迷31例,死亡17例(54.8%)。由此可见,术前意识障碍越重,疗效也越差。
(2)出血量及出血部位与手术疗效关系密切 脑组织破坏及受压与出血量呈正相关,因此出血量越多,预后越差。但是从治疗角度看出血部位更为重要,深部出血可直接影响脑重要结构,死亡率明显高于皮层下出血。皮层下、壳核外侧出血手术疗效满意,丘脑出血则较差,脑干出血更差(表3)。小脑出血的外科疗效明显优于内科,术前无意识障碍者可无死亡率。血肿破入脑室可阻塞脑脊液循环通路,常使病情加重。但也有少数患者因血肿破入脑室,减轻了对脑实质的压迫和破坏,一旦度过急性期,血肿吸收后,恢复反而比未破入脑室者好。
表3102例原发性脑干出血的量及部位与病死率

(3)发病急、病情进展快者预后较差 此类患者出血猛,出血量大,如不手术,生存机会几乎为零,手术清除血肿也只能挽救部分患者生命,且病残率高。
(4)发病后血压过高、伴眼底出血者手术疗效差,术后再出血的概率增加。
(5)高龄(70岁以上),术前合并严重心、肺、肾等疾患预后差。对年龄影响要具体分析,随着保健水平的提高,相对健康的高龄老人越来越多,发病前是否有严重基础疾病对预后的影响要比年龄影响大的多,但年龄对手术疗效的影响仍不可忽视。













