患者男性,62岁。因“行走不稳2年,言语不清1年,右眼睑痉挛4个月”于2014年2月入我院神经科。
现病史
患者于2012年4月无明显诱因突然出现行走不稳,步基宽,走路易向右侧偏斜,伴视物成双、模糊,站立时有明确头晕症状,卧位时减轻,无恶心、呕吐,无视物旋转,无饮水呛咳、吞咽困难、言语不清,无肢体麻木、无力等症状与体征。就诊于当地医院,按“脑血管病”治疗(具体方案不详),出院后继续口服阿司匹林、维拉帕米、银杏叶片,上述症状部分缓解,但步基仍宽,动作迟缓,右手书写笨拙。2013年3月14日头晕症状加重,行走不稳,步距小、步基宽,说话笨拙,自觉舌不灵活,偶有饮水呛咳,无吞咽困难,无视物旋转,无肢体麻木、乏力,再次于当地医院就诊,头部MRI检查显示延髓腹侧稍长T1WI、长T2WI信号,FLAIR高信号,增强后病灶未见异常强化(图1),考虑“陈旧性腔隙性梗死”,经“输液治疗2周(具体方案不详)”症状无好转。至2013年10月逐渐出现右眼不自主挤眼,双腿不耐疲劳,平地仅能行走200m;2013年12月双手明显失灵,以至于持筷夹菜不稳,家属述其睡眠时鼾声重,讲话笨拙症状逐渐加重。2014年2月13日就诊于我院神经科门诊,查体:言语含糊,右侧不自主挤眼,眼球水平运动稍差,双手指鼻试验略差,行走缓慢,步基宽、站立不稳,Romberg征阳性,遂以“共济失调待查”收入院。患者自发病以来无发热、感冒、腹泻史,否认口眼干燥、口腔溃疡、光过敏、皮疹、雷诺现象等,进食尚可,大小便正常,体重无明显变化。
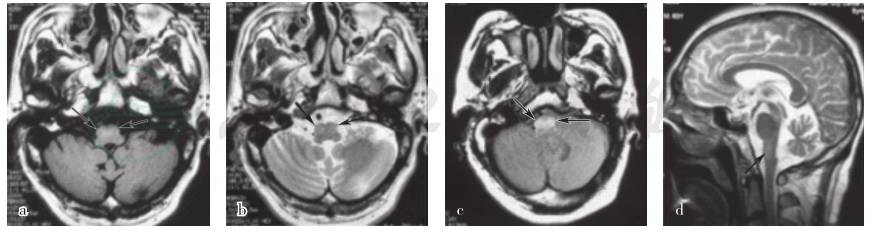
图1 患者头部MRI
检查显示下橄榄核肥大改变。a.横断面T1WI呈稍低信号(箭头所示);b.横断面T2WI呈稍高信号(箭头所示);c.横断面FLAIR成像呈高信号(箭头所示);d.矢状位T2WI呈高信号(箭头所示)
既往史
高血压病史2年,近期未服降压药物。精原细胞瘤病史30年。否认糖尿病、否认药物及食物过敏史。
个人史
否认吸烟史。饮酒史30年,每日饮白酒500g,近2年已戒酒,否认明确毒物接触史。
家族史
其父脑出血史,母有精神异常病史。
入院后体格检查
体温36.7℃,脉搏82次/min,呼吸18次/min,血压135/83mmHg。左足内侧有一6cm瘢痕;左足内侧见4cm×2cm肿物,无压痛,边界清,活动度可。神清、言语含糊,记忆力差,计算力差,对答切题。双眼水平活动略差,右眼睑痉挛,双侧眼球垂直眼震伴旋转成分,腭肌阵挛,其余脑神经检查无异常。四肢肌力、肌张力正常,四肢腱反射减低;双侧掌颌反射、Babinski征阳性;双侧小腿下2/3针刺觉、右膝关节下音叉振动觉减退;双侧指鼻欠稳准、轮替慢、跟-膝-胫试验正常、Romberg征阳性。步基宽、步距小,行走直线不能。脑膜刺激征阴性。
入院后诊治经过
①实验室检查,血常规,血红蛋白171g/L,余项正常;血清总胆固醇6.2mmol/L、甘油三酯3.84mmol/L、高密度脂蛋白胆固醇(HDL-C)0.92mmol/L、低密度脂蛋白胆固醇(LDL-C)3.66mmol/L;血清乳酸(LA)1.88mmol/L。红细胞沉降率、肾功能试验、血糖、甲状腺功能试验、血清同型半胱氨酸、叶酸、维生素B12均于正常值范围。临床免疫学检测:血清超敏C反应蛋白(hsCRP)3.86mg/L(<3mg/L)、类风湿因子(RF)21.9IU/ml(<20IU/ml);抗核抗体谱中抗rRNP抗体呈弱阳性29(阴性<15),血清免疫固定电泳、血清IgG、IgA、IgM、补体C3、补体C4、内因子抗体均正常。血清肿瘤标志物检测、血清抗Hu、Yo、Ri抗体等均呈阴性。腰椎穿刺脑脊液检查颅内压力80mmH2O,无色透明,脑脊液蛋白定量0.69g/L、IgG为0.083g/L,脑脊液常规、细胞学、寡克隆区带、抗神经节苷脂抗体无异常。②辅助检查,胸部X线正位片心、肺、膈未见明显异常,主动脉迂曲,胸椎骨质增生。腹部B超扫描示脂肪肝。头部MRI平扫+增强+脑干薄层扫描显示脑桥橄榄核异常信号;左侧额叶皮质下白质及深部脑白质斑片状非特异性改变。经颅多普勒超声可见右侧大脑中动脉狭窄,卧立位试验阴性。肛门括约肌肌电图未见肯定神经源性损害。因患者家属拒绝未行针极肌电图检查。入院时诊断“共济失调待查”。入院后即给予复合维生素B片、维生素B12、叶酸与尼麦角林片等。
神经科住院医师
定位诊断,双侧掌颌反射、Babinski征阳性,定位于双侧锥体束;四肢腱反射减低,双小腿下2/3针刺觉减退,定位于周围神经;右膝关节下音叉振动觉减退、Romberg征阳性,定位于脊髓后索-薄束核、楔束核-内侧丘系-丘脑腹后外侧核通路;饮水呛咳、吞咽困难,构音障碍重于饮水呛咳,双侧咽反射正常,定位于双侧皮质脑干束;行走不稳,指鼻、轮替差,定位于小脑及其联系纤维;眼震考虑为中枢性眼震;腭肌阵挛考虑去神经支配后的释放症状,定位于上运动神经元,结合头部影像学,定位于脑桥、延髓;记忆力下降、计算力差,定位于大脑皮质。定性诊断:结合目前病史、临床症状、体征及影像学表现,考虑中枢神经系统变性病。该患者锥体束损害明确,下运动神经元亦受累,不能完全排除运动神经元病之可能,但无肌萎缩、纤颤,故下运动神经受累证据不足,需进一步完善肌电图检查。有明确的小脑体征和震颤表现,需考虑以小脑受累为主的多系统萎缩(橄榄体-脑桥-小脑萎缩),但多系统萎缩的自主神经症状突出,而患者缺乏自主神经症状且多系统萎缩亦不能解释其病情全貌,需完善肛门括约肌肌电图、卧立位TCD检查以进一步明确。头部MRI显示以延髓腹外侧长T1WI信号、长T2WI信号、FLAIR高信号表现为主,既往可疑脑血管病史,按脑血管病治疗后病情曾部分好转,需考虑继发性中枢神经系统变性疾病如肥大性下橄榄核变性,该病可继发于出血、梗死、炎症、肿瘤、外伤等原因,临床主要表现为腭肌阵挛、共济失调、眼球震颤、复视等。鉴别诊断:①营养代谢性相关疾病,该患者有长期大量饮酒史,故可引起维生素B1缺乏而致Wernicke脑病或Korsakoff综合征,可出现眼球运动障碍、共济失调、精神症状,以及周围神经受累、记忆力减退,但此类疾病的影像学表现以幕上中线周围组织结构受累为主,极少有以脑干受累为主者,且患者已戒酒2年,病情仍呈进行性加重,亦不支持诊断,建议进一步完善代谢指标的筛查。②副肿瘤综合征,可多系统受累,本患者为老年,长期饮酒,需警惕此病可能,需进一步完善各项肿瘤标志物筛查。③遗传相关疾病,脊髓小脑性共济失调多中年发病,临床可表现为小脑性共济失调、锥体束征、眼震、周围神经损害,但该病为常染色体显性遗传,遗传早现现象明显,与该患者家族史不相符,且该病影像学主要表现为脑干和小脑萎缩,与其影像学亦不符,因此不作为主要考虑,必要时可行基因检测。
神经科副教授
同意上述分析。该患者延髓腹侧、中脑导水管腹侧长T2WI信号、FLAIR高信号,以神经变性病的可能性更大,但血管因素亦不能排除。首先应考虑继发于脑血管病的肥大性下橄榄核变性,慢性酒精中毒可能参与了发病。该患者血清抗Hu、Yo、Ri抗体阴性,血清肿瘤标志物无显著升高,影像学亦无肿瘤证据,因此不考虑副肿瘤综合征。肛门括约肌肌电图、卧立位TCD正常,诊断多系统萎缩的证据不充分。治疗方面可予营养神经和改善脑供血药物。有研究认为,肥大性下橄榄核变性的腭肌阵挛和震颤节律源于橄榄体的电活动,抗癫痫药物左乙拉西坦可抑制橄榄体放电,可能有一定效果。
神经科教授
该患者右眼不自主挤眼症状可能与单侧眼肌阵挛有关,原发性眼肌阵挛极少以单侧为主,需考虑继发原因。其同时存在腭肌阵挛、眼震、小脑性共济失调,结合影像学检查结果,可定位于脑干、小脑,亦可解释大部分症状与体征。头MRI检查可见橄榄核长T2WI信号,故定性诊断应首先考虑肥大性下橄榄核变性的可能。病因方面,呈急性发病,既往高血压病2级,外院曾诊断“脑血管病”,需考虑继发于脑血管病的肥大性下橄榄核变性。但影像学上未见明确的脑梗死或出血病灶,同时患者长期大量饮酒,周围神经受累明确,亦不排除酒精中毒参与肥大性下橄榄核变性的发病。治疗原则以对症治疗为主。
经查房讨论后加用左乙拉西坦250mg(2次/d),住院期间患者病情无明显好转,出院诊断“肥大性下橄榄核变性,周围神经病(慢性酒精中毒可能),右侧大脑中动脉狭窄,血脂异常、脂肪肝,高血压病2级”。患者出院后未按建议门诊复诊,电话随访得知患者继续口服左乙拉西坦、多种B族维生素与尼麦角林4个月,4个月后自觉症状无改善遂自行停药。再次建议其来门诊随诊。
肥大性下橄榄核变性(hypertrophic olivary degeneration,HOD)
肥大性下橄榄核变性最早于1883年由Oppenheim描述,是一种较罕见的由Guillian-Mollaret三角区病变引起的跨突触变性,主要发生在中脑、脑桥或小脑的出血、梗死、炎性、感染、脱髓鞘、肿瘤或创伤性病变一段时间后。Guillian-Mollaret三角区的解剖机制由Guillain和Mollaret在1931年提出,是由一侧中脑红核、延髓下橄榄核和对侧小脑齿状核构成的神经环路,齿状核发出的纤维经小脑上脚(结合臂)跨中线交叉至对侧红核并包绕红核(部分终止于核内、部分继续上升并止于丘脑),红核发出不交叉的纤维经中央被盖束下行到达同侧下橄榄核,下橄榄核再发出纤维经小脑下脚(绳状体)投射到对侧小脑半球皮质,继而投射到齿状核。该环路被认为是腭肌阵挛的解剖学基础,也称为“肌阵挛三角”(myoclonic triangle)。正常情况下,经该环路传递的神经冲动对下橄榄核具有抑制作用。当通路受损时,对下橄榄核的抑制作用解除,使下橄榄核过度兴奋,导致其肥大、变性。发生在中脑、脑桥被盖部、小脑上脚及小脑半球的各种破坏性病变,无论血管病变、炎性病变、感染、肿瘤、手术损伤等,一旦破坏齿状核-红核-下橄榄核通路,即可使下橄榄核发生慢性跨突触变性,引起HOD。依Guillian-Mollaret三角区受累部位的不同,HOD可分为3种:当病变位于脑桥中央被盖时,同侧下橄榄核发生HOD;当病变位于小脑齿状核或小脑上脚时,对侧下橄榄核发生HOD;病变同时累及中央被盖束和小脑上脚时,双侧下橄榄核均可发生HOD。一项回顾性研究发现,双侧HOD比单侧HOD更常见,双侧HOD占所有HOD的76%。单侧小脑上脚的病变也可继发双侧HOD,可能是因为病灶累及小脑上脚中有来自双侧齿状核和红核的神经纤维;而单纯小脑下脚的病变,仅造成下橄榄核传出神经通路的破坏,不会导致HOD,证明HOD是由于下橄榄核失去上游神经元传入的神经冲动所导致的变性。此类变性被称为“跨突触变性”,因为其发生于神经失去突触的冲动传入之后。这类变性亦可发生于其他情况,例如视网膜、视神经、视束病变或眼球摘除后的外侧膝状体变性。HOD的下橄榄核变性在大体上表现为肥大而非萎缩,其病理特点为神经元体积增大、空泡样变性和胶质细胞线粒体增生。
回顾性研究发现,44%的HOD患者在影像学上没有见到明确的破坏Guillian-Mollaret三角区通路的病灶。特发性HOD也曾有过1例报道。本例患者有可疑脑血管病史,但影像学检查未发现脑血管病病灶,缺乏脑血管病继发HOD的证据,不能排除慢性酒精中毒继发HOD的可能。但是,慢性酒精中毒相关性HOD以往尚未有过报道。
HOD的特征性表现包括腭肌阵挛、眼球震颤、Holmes震颤、共济失调、复视及肢体阵挛等。腭肌阵挛为HOD的核心体征,但并非所有HOD病例均存在腭肌阵挛,因为亦可见于亚历山大病、橄榄体脑桥小脑萎缩、脊髓小脑变性等疾病。HOD的典型阵挛是软腭和悬雍垂的不自主运动,由1~3Hz的肌肉收缩形成,严重阵挛可累及喉部、颈部肌肉甚至膈肌。该例患者表现有典型的腭肌阵挛、眼震、共济失调和复视,但因患者拒绝行肌电图检查,未能测量其具体的阵挛频率。
MRI是诊断HOD的可靠方法。其在MRI上的典型表现为延髓前外侧的长T2WI信号、等或长T1WI信号,下橄榄核体积正常或增大;下橄榄核等或长T1WI信号、长T2WI信号改变与细胞空泡变性、胶质细胞反应增生有关,而FLAIR低信号可能与变性的下橄榄核存在不同程度的液化或坏死有关。如果病灶已经发生液化、坏死且胶质明显增生,也可表现为长T1WI信号与FLAIR高信号。部分HOD患者可出现对侧小脑齿状核萎缩伴T2WI高信号、对侧小脑皮质萎缩,可能是由于下橄榄核与对侧小脑皮质之间的神经纤维联系中断。HOD的MRI表现随着病理改变而呈动态变化。其自然演化过程可分为6个阶段:①橄榄核无改变(发病<24小时);②橄榄核套变性(第2~7天或更长时间);③橄榄核肥大(自第3周起);④橄榄核最大阶段(约发生于8.5个月达到最大);⑤橄榄核假性肥大(神经细胞溶解阶段,发生于发病后9.5个月);⑥橄榄核萎缩(3~4年)。有文献报道,最早约在发病后3周,下橄榄核即可出现T2WI高信号,6个月时下橄榄核体积开始增大,10~12个月下橄榄核体积显著增大,24个月后T2WI高信号程度逐渐减低,病程持续3~5年下橄榄核可出现萎缩,但其长T2WI信号可持续多年。上述这些影像学特点与疾病病理演变过程基本平行。
目前,有关HOD尚无统一的诊断标准。在临床过程中,对于表现有头晕、腭肌阵挛、共济失调,而且头部MRI显示局限于下橄榄核的长T1、长T2信号,应考虑到HOD;临床观察发现腭肌阵挛伴小脑性共济失调表现,数月至数年前曾有累及脑干或小脑的脑血管病、脑炎、外伤、炎性脱髓鞘疾病病史者,亦应考虑HOD的可能。影像上除了下橄榄核区域T2WI高信号外,如果同时在Guillian-Mollaret三角区发现原发病灶,则高度提示HOD的诊断。HOD需注意与延髓梗死相鉴别,后者病变主要位于延髓腹内侧区域,可延伸至延髓背侧,而HOD发生在延髓腹外侧区。有少数延髓梗死病例的临床表现类似于HOD,但常同时伴有内侧丘系和锥体束受累的表现。对于HOD的治疗,主要是针对其原发病变和对症治疗。缓解症状可应用氯硝西泮、普萘洛尔,亦有文献报道盐酸苯海索、丙戊酸钠、金刚烷胺有效,左旋多巴、氟哌啶醇、激素疗效欠佳。Shepherd等报告1例继发于脑桥出血后的HOD病例,经氯硝西泮、左旋多巴、普萘洛尔等药物治疗无效后,于丘脑植入深部脑刺激(DBS)装置其震颤症状明显改善。本例患者试用左乙拉西坦,但因其未按建议随访,未增至足量,故效果欠佳。关于HOD预后相关文献报道较少,一般于发病3~4年部分患者症状可自发缓解,与HOD橄榄体的病理演变过程相符,本例患者发病已2年余,临床相始终未见明显缓解,仍需进一步随访。
综上所述,HOD是由于Guillian-Mollaret三角区受损引起的一种跨突触变性,典型的临床表现为腭肌阵挛和小脑症状等,既往数月或数年前存在累及脑干或小脑的病变。头部MRI显示延髓前外侧长T2WI信号、等或长T1WI信号,若同时合并齿状核-红核-下橄榄核通路远隔病灶则支持诊断。
[1]Samuel M,Torun N,Tuite PJ,et al.Progressive ataxia and palatal tremor(PAPT):clinical and MRI assessment with review of palatal tremors. Brain,2004,127(Pt 6):1252-1268.
[2]Carr CM,Hunt CH, Kaufmann TJ,et al. Frequency of Bilateral Hypertrophic Olivary Degeneration in a Large Retrospective Cohort.J Neuroimaging,2015;25(2):289-295.
[3]Goyal M,Versnick E,Tuite P,et al.Hypertrophic olivary degeneration:meta-analysis of the temporal evolution of MR findings.AJNR,2000,21(6):1073-1077.
[4]Sanverdi SE,Oguz KK,Haliloglu G.Hypertrophic olivary degeneration in children:four new cases and a review of the literature with an emphasis on the MRI findings.Br J Radiol,2012,85(1013):511-516.
[5]Lim CC,Lim SA.Images in clinical medicine:pendular nystagmus and palatomyoclonus from hypertrophic olivary degeneration.N Engl J Med,2009,360(9):12.
[6]Shepherd GM,Tauböll E,Bakke SJ,et al.Midbrain tremor and hypertrophic olivary degeneration after pontine hemorrhage.Mov Disord,1997,12(3):432-437.
[7]姜南,关鸿志,杨荫昌,等.行走不稳两年言语不清一年眼睑痉挛四个月.中国现代神经疾病杂志,2014,14(10):915-918.













