患者女性,50岁。因“排尿、排便障碍5年,肢体无力1年余”于2014年9月15日入院。
现病史
5年前患者无明显诱因出现排尿、排便障碍,表现为尿急、尿频、尿不尽,便秘与腹泻每周交替出现,偶有黑便,间断出现大小便失禁,未予处理。约1年半前出现左上肢无力,抬举困难,持物不稳,持筷、系扣等精细动作均受影响,无麻木、疼痛,未予处理,肌无力症状缓慢加重,同时出现头晕,体位改变时易诱发,无视物旋转、耳鸣、听力下降等。约2个月前写字时发现右手持笔不稳、写字不能,左手手指麻木,1周后出现右手手指麻木,双下肢行走乏力、易疲劳,双足踩棉花感,无走路不稳,独自行走、上下楼梯、蹲起均可,低头时有自颈部向四肢的串电感,无躯体束带感。遂至当地医院就诊,实验室检查红细胞计数2.12×1012/L、血红蛋白91g/L,维生素B12 29.56pmol/L(参考值范围133~675.40pmol/L),头部和颈椎MRI检查(2014年8月)显示双侧额叶内侧、基底节区多发性腔隙性梗死,C2~5水平脊髓后索异常信号(图1)。临床诊断为“脊髓亚急性联合变性”,予维生素B12(5mg/d)肌内注射,自觉四肢麻木无力症状无明显好转。为求进一步诊断与治疗收入我院。
患者自发病以来,无视力、听力改变,无声音嘶哑、饮水呛咳。平时无口干、眼干,关节肿痛,反复口腔溃疡,光过敏,雷诺现象等。饮食结构和进食量均正常,睡眠正常,体重略增加。
既往史
患者6年前诊断为巨幼红细胞贫血,自述治疗后好转(具体方案不详)。1个月前更换烤瓷牙数颗。否认高血压、糖尿病、心脏病等慢性疾病病史,否认肝炎、结核病等传染病病史,否认外伤、手术史,否认食物、药物过敏史。
婚育史、个人史、家族史
无特殊。
入院后体格检查
体温35.6℃,呼吸21次/min,脉搏84次/min,血压105/51mmHg。体型消瘦,神志清楚,语言流利,右侧面部针刺觉呈“洋葱皮”样减退,耳侧较鼻侧明显,其余脑神经未见明显异常。双上肢肌力4级、双下肢肌力5级,肌张力均正常,双上肢腱反射、双膝腱反射对称引出,双跟腱反射减退,双侧病理征未引出。T5~10水平、双手针刺觉减退,双髋、双膝关节音叉振动觉减退,双上肢、双踝关节音叉振动觉正常,关节位置觉、皮质复合觉正常。步态正常,一字步、足跟、足尖行走可。双侧指鼻试验、跟-膝-胫试验稍欠稳准,快复轮替动作正常,Romberg征阳性、Lhermitte征阳性,颈软无抵抗,脑膜刺激征阴性。
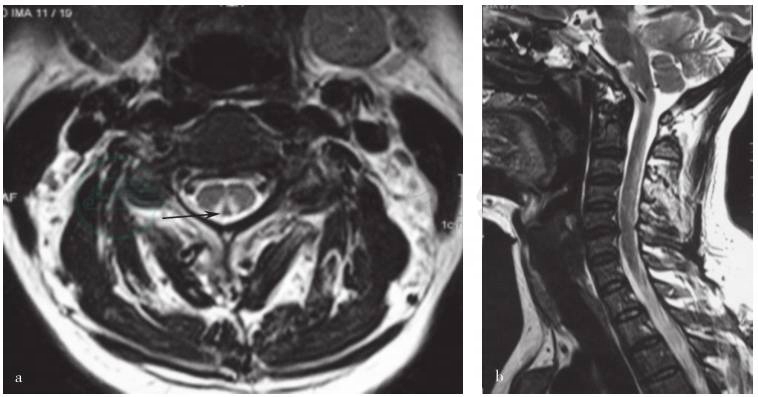
图1 患者颈椎MRI检查
T2WI显示C2~5水平脊髓后索高信号(箭头所示)。a.横断面;b.矢状位
入院后诊断与治疗经过
实验室检查血常规,红细胞计数3.42×1012/L,血红蛋白107g/L,红细胞平均体积(MCV)87fl,红细胞平均血红蛋白(MCH)29.30×10-6g,红细胞平均血红蛋白浓度(MCHC)337g/L。尿常规正常。便潜血试验阳性。红细胞沉降率(ESR)23mm/h,超敏 C 反应蛋白(hsCRP)18.69mg/L;血清铁4.82µmol/L(参考值范围8.96~30.45µmol/L),转铁蛋白2.70g/L(参考值范围2~3.60g/L),总铁结合力64.83µmol/L(参考值范围44.78~80.60µmol/L),铁饱和度0.074(参考值范围0.25~0.50),转铁蛋白饱和度0.071(参考值范围0.25~0.50),铁蛋白 35µg/L(参考值范围14~307µg/L)。外周血涂片可见红细胞形态大致正常,白细胞形态大致正常,血小板稍多。维生素B12、叶酸未见明显异常(已肌内注射维生素B12 1 个月)。血清铜 1.94×10-3µmol/L[参考值范围(11.81~18.89)×10-3µmol/L],24小时尿铜188.89×10-3µmol/L(参考值范围629.6~1 574×10-3µmol/L);血清铜蓝蛋白、血清锌未见明显异常。抗内因子(AIFA)抗体阳性。肝肾功能试验、血糖、血清脂质、凝血功能、网织红细胞分析、抗链球菌溶血素O(ASO)、类风湿因子(RF)、糖化血红蛋白(HbA1c)、甲状腺功能试验、抗核抗体(ANA)谱、抗可提取性核抗原(ENA)抗体谱未见明显异常。肌电图未见神经源性或肌源性损害。左上肢体感诱发电位(SEP)基本正常。胃镜显示慢性浅表性胃炎。胃体胃黏膜病理提示胃黏膜慢性炎症反应,伴轻度肠化生,壁细胞数目明显减少,建议临床除外自身免疫性胃炎。经消化科会诊明确诊断为自身免疫性胃炎。建议继续予维生素B12(5mg/周)肌内注射、硫酸铜(2mg/d)口服。治疗2个月后患者巨幼红细胞贫血得以纠正,走路踩棉花感较前有所好转,但双手精细活动仍差,四肢麻木无力基本无改善。
神经科主治医师
患者中年女性,隐匿起病,临床主要表现为排尿、排便障碍,双上肢麻木无力,远端明显,既往曾诊断为巨幼红细胞贫血。头部和颈椎MRI特征性表现为延髓、颈髓后索连续性长T1、长T2信号。定位诊断:双髋、双膝关节音叉振动觉减退,Romberg征阳性,考虑为躯干性共济失调,定位于脊髓后索;四肢麻木无力,远端明显,双侧跟腱反射减退,双侧病理征阴性,周围神经病受累可能大。定性诊断:外院实验室检查维生素B12水平明显降低,血常规和外周血涂片提示巨幼红细胞贫血,考虑脊髓亚急性联合变性可能性大,其治疗原则主要以维生素B12替代治疗为主,但患者已替代治疗1个月余,四肢麻木无力症状仍无明显好转,需与铜缺乏性脊髓病(CDM)相鉴别,后者临床特点和影像学表现与维生素B12缺乏所致脊髓亚急性联合变性相似,易有脊髓后索受累,可完善血清铜、24小时尿铜、血清铜蓝蛋白检查以资鉴别。
神经科教授
患者中年女性,临床主要表现为排便障碍,尿频、尿急、尿失禁,腹泻与便秘交替,四肢麻木无力,双手麻木,走路踩棉花感,与体位相关的头晕在翻身时也会出现。患者6年前明确诊断为巨幼红细胞贫血,无神经系统病变主诉,维生素B12补充治疗后病情有所恢复。再次治疗1个半月后,贫血情况明显改善,神经系统查体感觉障碍主要表现为“手套-袜套”样针刺觉减退,T5~10水平针刺觉减退,颈椎MRI显示颈髓后索连续性异常信号。定位诊断:主要考虑脊髓后索受累为主;目前患者腱反射仍可引出,提示周围神经病变仍较轻微;无明确的脊髓侧索损伤证据;体位性头晕是自主神经系统病变还是前庭系统病变,目前尚不能确定,考虑自主神经系统病变所致可能性大,可完善卧立位血压以辅助诊断;排尿、排便障碍主要表现为间断性尿频、尿急、尿不尽感,无明显尿潴留,不符合圆锥马尾病变致排尿、排便障碍的特点,考虑脊髓侧索病变可能性大,可用颈髓病变解释;胸部感觉平面不恒定,无明确定位指征;腹泻更倾向于内科疾病所致。定性诊断仍首先考虑脊髓亚急性联合变性,但单纯维生素B12缺乏不好解释该例患者在5年病程中未补充维生素B12而病情无加重,且无神经系统病变,在大剂量维生素B12替代治疗后,贫血症状得以纠正,四肢麻木无力和排尿、排便障碍仍未得以恢复,因此需考虑铜缺乏相关性脊髓病,该例患者血清铜和24小时尿铜均明显降低,可能是铜缺乏与维生素B12缺乏共同作用于脊髓后索所致。该例患者抗内因子抗体阳性,腹泻、肠易激症状突出,胃体胃黏膜病理检查不排除自身免疫性胃炎,后者可以导致维生素B12和铜离子吸收障碍,因此其脊髓病变最终诊断为脊髓亚急性联合变性,考虑维生素B12和铜缺乏共同所致。此外,合并胃肠道症状的神经系统疾病还需考虑淀粉样变性和线粒体神经胃肠脑肌病,两者均以周围神经受累为主,脊髓后索病变少见,仅作为鉴别诊断。
脊髓亚急性联合变性(subacute combined degeneration,SCD)
铜缺乏相关性脊髓病(copper deficiency myelopathy,CDM)
临床上对于脊髓后索和侧索病变患者,首先考虑维生素B12缺乏所致脊髓亚急性联合变性(SCD),同时也需考虑铜缺乏相关性脊髓病(CDM),两者临床症状、神经系统体征和影像学表现十分相似。Jaiser和Winston总结了55例铜缺乏相关性脊髓病患者的临床资料,1例同时合并维生素B12缺乏,余14例因既往曾接受维生素B12治疗而无法获得准确的原始数据。一项纳入23例脊髓后索和侧索病变患者的研究显示,3例为单纯铜缺乏相关性脊髓病,3例同时存在维生素B12和铜缺乏。该例患者最终诊断为维生素B12缺乏与铜缺乏共同所致脊髓亚急性联合变性。通常,脊髓亚急性联合变性是由于维生素B12缺乏导致的神经系统变性,病变主要累及脊髓后索、侧索及周围神经。根据该例患者的临床资料不应只考虑维生素B12缺乏导致的脊髓亚急性联合变性,而还要想到与之相似且可同时存在的铜缺乏相关性脊髓病。为何脊髓亚急性联合变性与铜缺乏相关性脊髓病的临床表现如此相似,其确切机制目前尚不清楚。有学者认为,甲基化环路途径是两者发病的共同途径,该环路中的甲硫氨酸合成酶是铜依赖性酶,该酶参与神经髓鞘合成,铜缺乏使该酶功能紊乱,出现髓鞘脱失和轴索变性,以脊髓后索等长轴突受累明显。
获得性铜缺乏相关性脊髓病由Kumar N等于2003年首先报告,其病例组13例患者主要表现为感觉性共济失调、下肢痉挛性瘫痪和周围神经病变,3例MRI呈现脊髓后索异常信号。此后,又有多例关于铜缺乏相关性脊髓病的报道,该病才逐渐被临床医师所认识。铜缺乏相关性脊髓病是铜缺乏导致的中枢和周围神经系统变性病,主要累及脊髓后索、侧索和周围神经,临床表现为感觉性共济失调、痉挛性瘫痪和周围神经病变,常合并贫血和白细胞缺乏症等血液系统病变。该病好发于30~82岁人群,女性多于男性。
Williams早在1983就总结了引起体内铜缺乏的常见原因,铜主要在胃和十二指肠吸收,故约有50%的患者因上消化道手术,尤其是胃部分切除术而使铜吸收障碍致铜缺乏;其他获得性因素还包括锌过量摄入、营养吸收障碍、肝豆状核变性患者过度使用铜锌螯合剂等。Menkes病为X连锁隐性遗传性疾病,是ATP7A基因突变引起的先天性铜缺乏疾病。
获得性铜缺乏疾病的神经系统受累以脊髓病变(后索和侧索受累)或脊髓神经病变(周围神经受累)最为突出,典型的临床症状为因脊髓后索病变出现的亚急性感觉性共济失调,表现为双手笨拙,步态不稳、步基增宽、踩棉花感,深感觉障碍、远端明显,部分患者可在屈颈时出现自上而下的串电感;脊髓侧索受累时则出现双下肢不完全性痉挛性瘫痪,表现为肢体无力、肌张力增高、病理征阳性,虽然部分患者因脊髓侧索病变表现为腱反射亢进,但腱反射减低甚至消失的现象在铜缺乏相关性脊髓病侧索病变患者中并不少见,可能与该病叠加周围神经病变相关,严重者可出现腕下垂或足下垂。亦有少数患者的感觉运动障碍表现为不对称性面部和肢体麻木无力,提示铜缺乏也可导致感觉神经节和前角运动神经元受累,Zara等以及Weihl和Lopate通过神经电生理监测也证实了这一点。此外,铜缺乏症的神经系统病变还可出现膀胱功能障碍、肌肉病、认知功能障碍、视神经病变致视力减退、视盘水肿等。影像学可无明显异常改变,但大多数患者的脊髓MRI表现为T2WI高信号,较少出现强化,以颈髓和/或胸髓后索连续病变最具特征性,部分患者还可见脊髓侧索病变,可延伸至延髓,治疗后髓内病变可减退或消失。铜缺乏相关性脊髓病患者腰椎穿刺脑脊液检查多正常,少数蛋白定量轻度升高。神经电生理监测无特征性改变,重症患者可表现为以轴索损害为主的多发性感觉运动神经病;此外还有极少数患者出现运动单位动作电位降低伴失神经支配现象,提示下运动神经元病变。体感诱发电位表现为中枢性本体感觉障碍,视觉诱发电位(VEP)呈现出潜伏期延长。
约80%的患者可出现血液系统病变,主要表现为贫血或粒细胞计数减少,贫血可以是小细胞性、正常细胞性或巨幼红细胞贫血;约50%的患者可出现粒细胞计数减少,但血小板或全血细胞计数减少相对少见。其他系统病变少见,仅Thackeray等和Videt-Gibou等报道5例铜缺乏脊髓病合并肝功能异常患者,考虑与铜缺乏导致的肝脏铁过量相关。
铜缺乏相关性脊髓病的诊断要点包括典型临床症状,亚急性起病的感觉性共济失调,可合并痉挛性瘫痪和/或周围神经病;贫血或粒细胞计数减少;血清铜、24小时尿铜和铜蓝蛋白明显降低;脊髓MRI特征性表现为颈髓和胸髓后索和侧索异常信号。铜缺乏相关性脊髓病与维生素B12缺乏所致脊髓亚急性联合变性的临床和影像学表现十分相似,且常合并维生素B12缺乏,尤其在接受上消化道手术的患者中更为多见,临床鉴别诊断困难,多于患者行维生素B12替代治疗而神经系统症状无明显改善后才诊断为铜缺乏相关性脊髓病。此外,还需与其他脊髓病变相鉴别,如多发性硬化(MS)、脊髓痨、脊髓肿瘤、脊髓血管病、脊髓肿瘤等,对于合并视神经病变的患者还需要与视神经脊髓炎(NMO)相鉴别。
治疗方面主要以铜剂替代治疗为主,目前虽无随机对照临床试验推荐合适的铜剂剂量、疗程、用药途径和剂型,但既往研究显示,口服铜盐治疗有效,常见的铜盐包括葡萄糖酸铜、硫酸铜、醋酸铜和氯化铜等。因为患者可能需要长期铜剂替代治疗,肠外用药途径并不推荐为首选。剂量建议为:元素铜2mg/d,若静脉滴注则建议每天用药时间>2小时,连续用药5天,此后按同样方法定期补铜。对于铜缺乏严重的患者,建议口服元素铜第一周8mg/d、第二周降至6mg/d、第三周4mg/d、最终以2mg/d维持治疗。服药期间需定期监测血清铜、24小时尿铜水平,及时调整用药方案。此外,需筛查有无引起铜缺乏的易感因素,及时纠正。对于额外补充锌剂的铜缺乏患者需要适时停止。消化道手术致铜缺乏的患者也需及时监测血清锌、铁、维生素B12、维生素E、维生素D水平,如有缺乏需及时补充。及时的铜替代治疗可以阻止病情进展,约50%的患者神经功能障碍有所好转,但感觉障碍恢复较慢,且易成为后遗症而难以恢复;大部分患者贫血和粒细胞缺乏可完全恢复。
临床上对于表现为感觉性共济失调、痉挛性瘫痪、周围神经病和贫血,且脊髓MRI表现为颈胸髓后索侧索病变的患者,除考虑单纯的维生素B12缺乏所致的脊髓亚急性联合变性外,还需与铜缺乏相关性脊髓病鉴别,且有可能两者共同致病,需及时检测血清铜、24小时尿铜和血清铜蓝蛋白,有助于及时诊断与治疗。该例患者同时存在维生素B12和铜缺乏,目前尚不能明确判断是单纯的维生素B12缺乏还是铜缺乏所致,临床上仍考虑为两者共同作用所致的脊髓亚急性联合变性可能性大,因此治疗方面也同时予维生素B12和铜替代治疗,随访观察显示,该患者无论是神经系统症状还是贫血均有所改善。
[1]Jaiser SR,Winston GP.Copper deficiency myelopathy.J Neurol,2010,257 (6):869-881.
[2]Kumar N,Gross JB Jr,Ahlskog JE.Myelopathy due to copper deficiency.Neurology,2003,61(2):273.
[3]Kumar N,Gross JB Jr,Ahlskog JE.Copper deficiency myelopathy produces a clinical picture like subacute combined degeneration.Neurology,2004,63(1):33-39.
[4]Weihl CC,Lopate G.Motor neuron disease associated with copper deficiency.Muscle Nerve,2006,34(6):789-793.
[5]Naismith RT,Shepherd JB,Weihl CC. Acute and bilateral blindness due to optic neuropathy associated with copper deficiency.Arch Neurol,2009,66(8):1025-1027.
[6]Videt-Gibou D,Belliard S,Bardou-Jacquet E.Iron excess treatable by copper supplementation in acquired aceruloplasminemia:a new form of secondary human iron overload?Blood,2009,114(11):2360-2361.
[7]彭琳,徐蔚海,彭斌,等.排尿排便障碍 四肢麻木无力.中国现代神经疾病杂志,2015,15(3):248-251.













