患者女性,19岁。因“双手不利4年,行走不稳3年,声音嘶哑1年”于2012年9月14日入院。
现病史
患者于4年前发现双手活动不利,表现为端碗失稳,持筷或切菜时动作较笨拙,不能顺利夹中或切中目标;自觉写字较前无明显变化。3年前出现行走不稳,行走时躯体晃动,似要向一侧倾倒,不能走直线。上述症状呈缓慢加重,2年前外院就诊分别进行血常规、肝功试验,各项指标均于正常值范围,但血清铜蓝蛋白降低,为16.7mg/dl(参考值范围22~58mg/dl);头部MRI检查未见明显异常,未予明确诊断和治疗。1年前,患者逐渐出现声音嘶哑伴语速减慢、语音拖长,但不伴饮水呛咳或吞咽困难。家属诉其似乎“反应有些缓慢”,如看电视、看书时对他人的呼唤反应迟钝。否认肢体麻木、无力;否认复视、视物模糊及听力异常等;否认口眼干、反复口腔溃疡、光过敏、关节肿痛、雷诺现象等。为进一步明确诊断与治疗入我院。入院时精神、饮食可,否认入睡困难、早醒等睡眠障碍,但家属诉其睡眠中可见肢体不自主运动,大小便正常,体质量无明显变化。
既往史
患者1岁时行左面部“血管瘤冷冻术”后形成瘢痕,18岁时曾行瘢痕切除术。
个人史
足月顺产,生长发育同正常同龄儿。自幼不爱运动,读书时不经常参加体育活动,学习成绩中等,今年职高毕业。生长于原籍,否认疫区、疫水接触史,否认毒物、放射线接触史,否认烟酒嗜好,无挑食、偏食习惯。
月经婚育史:
初潮15岁,行经天数7~14天,月经周期25~40天,末次月经2012年7月20日。未婚未育。
家族史
患者父亲有轻微的行走不稳,语速缓慢,构音欠清晰;其母体健,同父同母弟弟16岁,85kg/1.74m,体健;否认家族中有其他遗传病病史。
入院后体格检查
发育正常,体型偏瘦。心、肺、腹部检查未见明显异常。神清,构音不清,MMSE评分26分(计算力减4分)。双眼外展露白约4mm,余各向眼动充分,水平扫视运动缓慢,无眼震。其余脑神经检查未发现异常。四肢近、远端肌力5级,肌张力减低。头部及四肢可见肌阵挛。双侧上肢腱反射对称减低,双膝腱反射和双跟腱反射均未引出。双侧Hoffmann征、Rossolimo征、Babinski征、Chaddock征阴性。深浅感觉未见异常。双侧指鼻、跟-膝-胫试验欠稳准、轮替动作缓慢,反击征可疑阳性;行走不稳,步基宽,足尖足跟行走不能,直线行走不能,Romberg征阳性。脑膜刺激征阴性。
入院后辅助检查:
血常规,白细胞计数3.88×109/L、中性粒细胞比例(NEUT%)0.46,血红蛋白(HGB)117g/L,红细胞平均体积(MCV)78.6fl,红细胞平均血红蛋白(MCH)26.3pg,血小板计数206×109/L;尿、粪便常规、肝、肾功能检验、血清脂质、红细胞沉降率、超敏C反应蛋白、血清叶酸水平、血清维生素B12水平、甲状腺功能试验、铜蓝蛋白等实验室检查均无明显异常。铁四项检测:血清铁29.7μg/dl(参考值范围50~170μg/dl)、转铁蛋白3.18g/L(参考值范围 2.0~3.60g/L)、总铁结合力422μg/dl(参考值范围 300~430μg/dl)、铁饱和度 7%(参考值范围25%~50%)、转铁蛋白饱和度6.6%(参考值范围25%~50%)、铁蛋白5ng/ml(参考值范围14~307ng/ml)。腰椎穿刺脑脊液压力、常规、化合物、细胞学、寡克隆区带检测、髓鞘碱性蛋白均于正常水平。心电图基本正常。超声心动图:心脏结构和功能未见明显异常。腹部超声:左肾囊肿。胸部X线正侧位:胸椎侧弯,心肺未见明显异常。肌电图:上下肢呈周围神经源性损害;BAEP:双侧可疑中枢性损害(Ⅴ波分化不良)。脑电图为异常脑电波,呈前部阵发性慢波。颈椎MRI平扫未见明显异常。头部MRI检查显示延髓变细,脑桥腹侧块缩小,T2WI脑桥呈“十字征”;小脑体积缩小,其沟裂增宽,邻近脑池增宽(图1),符合橄榄核脑桥小脑萎缩综合征。外周血送检SCA1、SCA2、SCA3、SCA6、SCA8、SCA12、SCA17、DRPLA基因检测,结果显示:SCA2基因编码区(CAG)n三核苷酸重复数目异常,呈14/39次;SCA1、SCA3、SCA6、SCA17和DRPLA基因编码区(CAG)n三核苷酸重复数目正常;SCA8基因3'非翻译区(CTG)n三核苷酸重复数目正常;SCA12基因5'非翻译区(CAG)n三核苷酸重复数目正常。
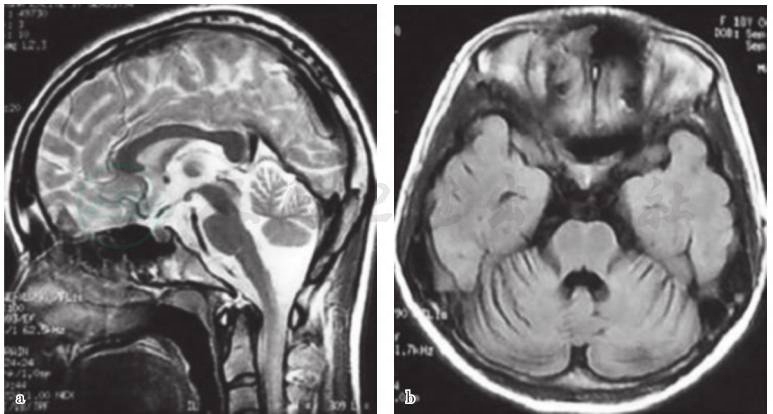
图1 患者头部MRI 检查
a.矢状位T2WI序列显示延髓变细,脑桥腹侧块变小 ;b.横断面T2-FLAIR序列小脑沟裂增宽,邻近脑池增宽
入院后诊治经过
结合患者临床表现、家族史、影像学特征及基因检测结果,临床诊断“脊髓小脑性共济失调2型(SCA2)”。予以B族维生素、维生素E胶囊、辅酶Q10治疗,明确诊断后患者出院。
神经科主治医师
①定位诊断,患者自发病以来表现为双手活动不利,行走不稳,声音嘶哑,语速缓慢等症状;四肢肌张力低,行走步基宽,直线行走不能,为小脑性共济失调步态;指鼻、跟-膝-胫试验欠稳准,轮替差,反击征可疑阳性、Romberg征阳性,而深感觉检查未见异常,定位于小脑及其联系纤维;双眼水平扫视运动缓慢,定位于脑干;计算力下降,定位于皮层;四肢腱反射减低,不排除周围神经受累;头部及四肢的肌阵挛,考虑锥体外系受损可能。结合患者的头MRI影像学检查、肌电图和脑电图检查,提示小脑及其联系纤维、脑干、大脑皮质、周围神经等多发神经系统受累。②定性诊断,患者为青少年女性,具有可疑的家族史,隐匿起病,呈慢性病程,突出表现为小脑性共济失调,脑干、大脑皮质和周围神经亦均有受累,考虑为遗传性共济失调。首先考虑脊髓小脑性共济失调(SCA),患者表现为小脑性共济失调和眼球水平扫视运动缓慢,有大脑皮质功能受损,较符合SCA的表现。其次考虑橄榄体脑桥小脑萎缩(OPCA)。该病分为散发性和家族性,家族性者以男性较多见,发病较早且有阳性家族史,以小脑性共济失调为主要表现,MRI提示延髓、脑桥和小脑均有明显萎缩,需考虑橄榄脑桥小脑萎缩的可能,但是患者眼球慢扫视运动较明显,则更支持SCA。另外,诊断还需考虑肝豆状核变性。该病于青少年期发病,可表现为小脑、锥体外系的症状与体征,本例患者外院血清铜蓝蛋白检查异常,不能排除诊断。但是患者双眼未见K-F环,且锥体外系症状与体征并不突出,故不支持诊断。营养代谢性疾病亦不应忽略,患者血清叶酸、维生素B12、甲状腺功能检查均于正常值范围,不支持诊断。
神经科主治医师
虽然查体未发现患者存在深感觉异常,但肌电图检查发现明确的周围神经受损,且以感觉神经受损为主,患者血糖、血清叶酸和维生素B12等均于正常值范围,仍考虑为SCA2引起的周围神经受累。双眼水平扫视运动缓慢是SCA2的突出表现,但这些体征亦可出现在亨廷顿舞蹈病、SCA1和SCA7中,但在SCA2出现特别早,且症状与体征表现尤为严重,该患者可能由于其家属未仔细观察,故主诉中并未提及,但入院后查体提示患者双眼水平扫视运动缓慢,可能与其父母家所述“发现患者反应缓慢”有关。SCA目前尚无有效治疗手段,营养支持、康复锻炼可能对改善生活质量起到一定作用,但不能延缓缓慢持续进展的病程,应定期随访。
脊髓小脑性共济失调2型(spinocerebellar ataxia type 2,SCA2)
脊髓小脑性共济失调(spinocerebellar ataxias,SCAs)是一类以小脑功能失调同时合并其他神经功能异常为特征的进行性神经系统退行性疾病,大多数为常染色体显性遗传(autosomal dominant,AD),少数为散发型。SCAs具有明显的临床和遗传异质性,目前根据突变基因的不同分型,已经确认的突变基因共有30余种,小脑性共济失调是其共同的临床特征。其中SCA2是最常见的3种类型(SCA3、SCA2和SCA6)之一,在印度和古巴人群中较为常见,以墨西哥人最常见。我国人群中SCA2次于SCA3,为第二常见类型。SCA2在1971年由印度的Wadia和Swami首先报告,因此也被称为Wadia-Swami型共济失调。当时他们注意到SCA2患者早发且显著的眼球扫视运动缓慢之特点。SCA2突变基因ATXN2定位于12q24.1,由该基因的CAG重复序列病理性扩增而致病。CAG扩增次数>31次即可能致病,且扩增次数越多,发病年龄越早,病情进展越快。
SCA2平均发病年龄为35岁(7~66岁),但当CAG扩增次数达>200次时则刚出生数月即发病。若发现以下症状与体征的组合通常提示SCA2:共济失调步态/构音障碍,帕金森样的强直/运动过缓,早期和严重的眼球扫视运动缓慢,严重的姿势性或动作性震颤,起先反射亢进然后迅速转为反射减弱,早期呈肌阵挛或束样运动,肌肉痛性痉挛。实际上,随着病情的进展,远端肌萎缩、吞咽困难、眼肌麻痹、大小便失禁、精神症状均可能相继出现,从而使患者逐渐丧失独立能力,这一过程可能出现于发病后12~25年。至病程晚期,SCA2患者通常会出现自主神经功能紊乱,产生血管收缩功能、心功能、消化系统功能、外分泌腺功能等异常;虽然患者人格和认知功能相对保存较好,但一些患者出现短时记忆功能、额叶执行功能、注意力和情绪控制水平下降。在古巴的SCA2患者中,有10%~33%的患者出现抑郁、焦虑、自杀倾向、失眠、性功能受损等。本例患者发病相对较早(15岁),但AXTN基因CAG重复次数较少(39次),临床表现以小脑性共济失调和水平扫视运动缓慢更突出,此外,符合SCA2的临床特点。高级脑干、周围神经、大脑皮质亦均受累,符合变性病广泛的神经系统损害的特点。但该患者并未出现自主神经功能紊乱、睡眠障碍、精神症状、大小便失禁、额叶执行功能受损等症状与体征,但随着病情的进展,有可能出现,在今后的随访中应当密切关注。贫血和白细胞计数下降可能与SCA2无关,胸椎侧弯可能与患者长期为维持身体平衡代偿的结果。水平扫视运动缓慢是SCA2极为重要的特征。其在SCA1、SCA7、亨廷顿舞蹈病(HD)患者中也较常见,但均不似SCA2出现得早、表现得如此突出。眼震电图检查显示,约有99%的SCA2患者可检测到异常,甚至在一些无症状患者中也发现异常,此与SCA2早期的影像学改变相符,即脑桥/橄榄区域(尤其是小脑中脚)萎缩。定量研究表明,SCA2中最大扫视速度(MSV)与CAG扩增次数相关,而与病程无关,因而认为MSV作为受遗传学控制的、客观的、可定量的生理学参数,可以成为研究CAG扩增引起多聚谷氨酰胺毒性的标志物。这种慢水平扫视运动可能与脑桥的兴奋爆发神经元(excitatory burst neuron)有关,对SCA2患者的尸检发现脑桥此类神经元大量减少。实际上,本例患者眼球水平扫视运动缓慢十分突出,但在患者主诉中却并未体现,可能对其生活影响不显著而未引起注意。
深部腱反射降低或消失和感觉神经元神经病也是SCA2较常见的表现。对阿根廷一个较大SCA2家系的调查发现,大多数患者深部腱反射在病程的不同阶段均表现为异常活跃;但周围神经病变表现不十分突出,仅有3例患者电生理检查提示感觉性周围神经病,相对应的深部腱反射降低。有趣的是,有些患者双侧上肢腱反射正常或消失而双下肢腱反射增高。通常周围神经受累可引起腱反射降低或消失,而腱反射异常活跃多提示锥体束受累,周围神经和锥体束受损均可出现在SCA2人群中。但是,双侧下肢腱反射增高、阵挛和Babinski反射在SCA2早期常见且突出,但是可迅速转变为腱反射降低或消失。该例患者双侧上肢腱反射减低、双下肢腱反射未引出,与神经传导速度检查的结果(下肢感觉神经诱发电位幅均未引出,上肢感觉神经诱发电位波幅下降)相符,故考虑其腱反射异常与周围神经损害相关。SCA2患者周围神经损害较为多见,主要表现为感觉神经元神经病,而且常以双侧上肢为主,这也是SCA2与其他SCA的不同之处,只是本例患者的周围神经损害上下肢均受累、下肢更重则是例外。
绝大多数的SCA2表现为小脑性共济失调型,但部分SCA表现为帕金森病的症状,小部分SCA2患者还可合并运动神经元病(MND)。帕金森型SCA2表现为帕金森病的典型症状而无明显的小脑体征,对左旋多巴治疗反应良好,还可出现药物引起的运动障碍;但是与经典的帕金森病相比,其临床症状相对较对称。帕金森型SCA2具备以下特征:①发病更晚;②进程更慢;③运动缓慢和强直较静止性震颤更常见;④对左旋多巴反应良好;⑤姿势不稳通常出现于病程较晚的阶段。与经典的小脑性共济失调型SCA2相比,帕金森型SCA2通常发病更晚,CAG扩增次数更少(<40次),但也有文献报道12岁发病、CAG扩增52次的帕金森型SCA2患者。由此可见,帕金森型SCA2单从临床上不易与帕金森病相鉴别。因而,对于一些家族性的“帕金森病”应当筛查SCA2基因。SCA2合并MND并不常见,在已报道的少数病例中,其MND的症状出现较晚,但病情进展相对较迅速,多在出现症状后2年内死于呼吸衰竭。该例患者符合小脑性共济失调型的特点。
SCA2影像学主要表现为橄榄、脑桥、小脑萎缩。最先出现脑桥/橄榄区域萎缩,尤其是小脑中脚部位,随后是小脑和中脑;至疾病较晚期,可出现额颞叶萎缩和广泛性脑室扩大。SCA2脑桥萎缩较SCA1和SCA3表现严重,而且其脑桥和小脑萎缩的程度似乎与临床严重程度相关。皮质萎缩也是SCA2特征之一,有些患者MRI还可出现基底节高信号,与多系统萎缩-C(MSA-C)相似,该例患者的MRI改变即表现为典型SCA2的影像学改变特点。
目前对于SCA2患者的治疗仍局限于改善症状。其康复锻炼可以作为治疗的基石,改善临床症状,提高生活质量。药物治疗,如左旋多巴、抗胆碱能药物可以改善震颤、张力障碍及运动过缓;镁制剂、奎宁、美西律或大剂量维生素B可缓解痛性肌肉挛缩;利鲁唑可通过降低小脑深部神经元过度兴奋性而改善症状;补充锌可降低患者的共济失调评分。针对发病机制的治疗目前仍旧处于展望阶段,希望在不久的将来能运用到患者身上。本例患者入院后接受维生素、辅酶Q10等营养神经药物治疗,同时进行康复锻炼,虽然出院时症状改变不十分明显,但指鼻和跟-膝-胫试验较住院时稳准。
本例为1例典型的SCA2患者。SCA2主要表现为小脑性共济失调、水平扫视运动缓慢、周围神经损害等特征,病情缓慢进展,逐渐出现广泛性神经系统损害。该病是由ATXN2基因的CAG序列扩增次数病理性增多致病,部分患者表现为帕金森病样症状与体征,少部分患者可合并运动神经元病。头部MRI检查表现为橄榄-脑桥-小脑萎缩。目前尚无特异性治疗手段,可采取康复锻炼和一些改善症状的药物辅助治疗以改善患者生活质量。
[1]王俊玲,徐倩,雷立芳,等.中国汉族人群脊髓小脑性共济失调 1、2、3、6、7、8、10、12、17亚型和齿状核-红核-苍白球-路易体萎缩亚型频率分布.中华神经科杂志,2009,42(10):672-675.
[2]Le Pira F,Zappalà G,Saponara R,et al.Cognitive findings in spinocerebellar ataxia type 2:Relationship to genetic and clinical variables.J Neurol Sci,2002,201(1-2):53-57.
[3]Velázquez-Pérez L,Seifried C,Santos-Falcón N,et al.Saccade velocity is controlled by polyglutamine size in spinocerebellar ataxia 2.Ann Neurol,2004,56(3):444-447.
[4]Rosa AL,Molina I,Kowaljow V,et al.Brisk deep-tendon reflexes as a distinctive phenotype in an Argentinean spinocerebellar ataxia type 2 pedigree.Mov Disord,2006,21(1):66-68.
[5]van de Warrenburg BP,Notermans NC,Schelhaas HJ,et al.Peripheral Nerve Involvement in Spinocerebellar Ataxias.Arch Neurol,2004,61(2):257-261.
[6]Gwinn-Hardy K,Chen JY,Liu HC,et al.Spinocerebellar ataxia type2(SCA2)with Parkinsonisum in ethnic Chinese. Neurology,2000,55:800-805.
[7]范思远,倪俊,杨荫昌,等.记忆力减退1年加重伴视物异常3个月.中国现代神经疾病杂志,2014,14(8):738-740.













