患者男性,16岁。因“双下肢无力、行走不稳2个月余”于2012年2月24日入院。
现病史
患者于2011年12月无明显诱因出现右踝酸痛,一周后右踝疼痛消失,出现走路不稳,家人发现其行走姿势异常,尚无跌倒,后逐渐出现双下肢无力,走平路及下楼梯尚可,上楼梯困难,无力症状休息后可有所缓解,略感下肢发僵,伴下肢轻度麻木感,无踩棉感,无肌肉酸痛。2012年1月双下肢无力逐渐加重,出现蹲起费力,走路跛行,走平路需辅助,伴小便费力、等待,大便尚可。病程中无双上肢无力,无视力改变,无构音不清、吞咽困难及饮水呛咳,无呼吸困难等。于2012年1月初就诊于当地医院,查体:神清语明,脑神经(-),双上肢肌力、肌张力、腱反射正常,双下肢肌力4级,肌张力稍高,腱反射活跃;双侧Babinski征、Chaddock征阳性,感觉未见明显异常;胸段MRI未见明显异常;头颅MRI提示双侧小脑、双侧额顶叶脑沟增宽,考虑脑萎缩(图1)。腰椎穿刺检查脑脊液常规、生化、结核抗体IgG均未见明显异常。血维生素B12、叶酸水平正常。诊断“脊髓病变”,予甲钴胺0.5mg/d静点及甲泼尼龙500mg×3天、250mg×5天、125mg×4天静点治疗,后改为泼尼松60mg、1次/d口服,并逐渐减量(每周减5mg),患者双下肢无力症状有所缓解。为进一步诊治入我院。患者发病前无感冒及疫苗接种史,发病以来有口干、眼干症状,无关节痛、雷诺现象、口腔溃疡等。精神、饮食、睡眠尚可,体重有所增加。
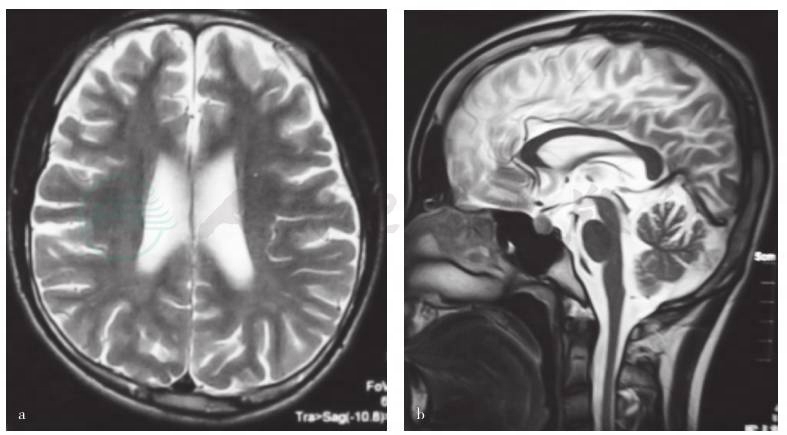
图1 患者头颅MRI检查
a.轴位T2WI显示脑沟增宽,双侧额叶明显,双侧脑室略显扩大;b.矢状位T2WI显示小脑萎缩
既往史
9岁时患“过敏性紫癜”(具体欠详)。11岁因一氧化碳中毒住院治疗,当时有无昏迷状况不详,经治疗无特殊遗留症状。否认肝炎、结核等传染病史及接触史。否认胃部疾病史。
个人史
足月顺产,生长发育似同龄儿,但自幼不喜运动,走路姿势欠正常,体育成绩差,学习成绩中等。否认烟酒嗜好,无偏食、挑食习惯。
家族史
父母体健,非近亲婚配。否认家族中类似疾病及其他遗传病史。
入院体格检查
发育正常,体型中等。心、肺、腹查体未见明确异常。神清语利,高级智能粗测无明显异常。向右注视时可见不持续水平眼震,眼科行眼底检查提示左眼视神经萎缩。余脑神经(-)。双上肢肌力5级,双下肢肌力近端4+级,远端5级,双上肢肌张力正常,双下肢肌张力略增高,双上肢腱反射对称正常,双下肢腱反射活跃,双侧Babinski征、Chaddock征均阳性。双侧指鼻尚准,轮替试验笨拙,跟-膝-胫试验欠稳准,右侧小脑反击征可疑。痉挛步态,步基较宽,直线行走不能,Romberg征可疑阳性。深浅感觉未见异常。脑膜刺激征(-)。
入院后辅助检查
血尿常规、肝肾功能、血沉、血肌酸激酶、叶酸、维生素B12(检查前已行维生素B12治疗)、内因子抗体、血抗核抗体、血免疫固定电泳、血氨、血气分析均未见明显异常。血清乳酸(空腹)2.70mmol/L(参考值范围0.5~1.6mmol/L),乳酸运动试验:运动前乳酸2.54mmol/L,运动后乳酸18.35mmol/L,血同型半胱氨酸119.3μmol/L(参考值范围5.0~15.0μmol/L),脑脊液常规、生化、细胞学、寡克隆区带均未见异常,脑脊液乳酸2.32mmol/L。血酰基肉碱谱显示C0(游离肉碱)低,C3(丙酰肉碱),C3/C2(乙酰肉碱)及C3/C0偏高,尿有机酸分析显示尿甲基丙二酸明显增高,综合分析提示甲基丙二酸血症。SCA(脊髓小脑性共济失调)3型基因、线粒体基因(6个位点7种突变)未检测到突变。肌电图提示肌源性损害;肌活检未见特征性肌肉病理改变。VEP显示双侧视通路损害,交叉前损害可能性大。头MRI提示脑室系统及脑沟、裂、池略增宽,小脑萎缩;颈、胸、腰椎MRI未见明显异常。超声心动提示二尖瓣前叶轻度脱垂,轻度二尖瓣关闭不全。腹部及泌尿系超声未见明显异常。
入院后诊断及治疗经过
结合患者临床表现、头颅MRI、血生化及尿有机酸分析结果,诊断为“甲基丙二酸血症合并同型半胱氨酸血症”。治疗上给予低蛋白高热量膳食,并请营养科会诊制定相应食谱。继续甲钴胺0.5mg/d肌注,加用左卡尼汀、叶酸、辅酶Q10、多种维生素等改善能量代谢、降同型半胱氨酸,以及巴氯芬对症治疗,患者症状稳定出院。
神经科主治医师(入院后首次查房)
定位诊断,双下肢无力,肌张力增高,双侧病理征阳性,定位于双侧锥体束,结合患者病程中有轻度小便障碍,双上肢未出现无力症状,双侧Hoffmann征(-),纵向定位于胸段脊髓可能性大。不持续水平眼震,双侧轮替笨拙,跟-膝-胫试验欠稳准,右侧小脑反击征可疑。行走步基较宽,直线行走不能,Romberg征可疑阳性,而深感觉未见异常,定位于小脑及其联系纤维。眼底检查显示左眼视神经萎缩,提示视神经受累。综合患者头颅MRI及肌电图检查结果,提示患者神经系统受累较广泛,双侧大脑半球、小脑、脊髓、视神经、肌肉均有累及,而临床则以锥体束以及小脑体征为突出。定性诊断:患者青少年男性,自幼运动较差,行走姿势异常,近2个月症状呈亚急性加重过程,查体提示神经系统多部位受累,头颅MRI提示大脑皮层、小脑萎缩,肌电图提示肌源性损害,血乳酸运动试验阳性,脑脊液乳酸偏高,定性诊断首先考虑:①遗传代谢性疾病,特别是线粒体脑肌病,该组疾病临床类型较多,常见如线粒体脑肌病伴高乳酸血症和卒中样发作(MELAS)综合征、慢性进行性眼外肌麻痹(CPEO)、肌阵挛癫痫伴破碎红纤维(MERRF)综合征、Kearns-Sayre综合征(KSS)、Leigh病等,各型之间症状可有重叠,但结合本例患者的特点,临床较难归于上述某种经典类型。随后进行的肌肉活检及线粒体基因筛查未能发现阳性证据,但据此仍不能完全除外该诊断,如能进行线粒体呼吸链相关酶学检查可进一步协助明确。②患者双侧锥体束损害及小脑体征较突出,需考虑脊髓小脑性共济失调(SCA),该病多为常染色体显性遗传,按基因分型多达20余型。临床除脊髓、小脑损害体征外,还可见多部位受累表现如锥体外系及周围神经损害、眼球运动障碍、视神经萎缩、视网膜色素变性等,影像学可见小脑萎缩,中国以SCA3型常见。但本患者无家族史,且其肌源性损害难以用SCA解释。SCA基因检测可协助明确诊断,本患者SCA3型基因检测为阴性。其他后天获得性脊髓病变如亚急性联合变性、脊髓炎、肝性脊髓病等需要考虑,但不能以此解释患者临床全貌。患者无相关基础疾病如胃病、肝病病史,血常规、肝肾功能、叶酸、维生素B12水平均未见明显异常,颈胸段MRI检查无明确异常发现,因此可以除外上述疾病。
神经科教授
患者青少年男性,实际病程应从幼年开始,近2个月亚急性加重。临床及影像提示神经系统多部位受累,结合血乳酸高等生化异常表现,应考虑遗传代谢性疾病可能,目前有关线粒体疾病的筛查未见阳性发现,还应考虑其他能导致多系统损害的先天代谢异常疾病,比如先天性有机酸代谢异常这一大组疾病,可以查尿有机酸分析进一步明确。
神经科主治医师(后续查房)
患者进一步的血酰基肉碱谱及尿有机酸分析提示甲基丙二酸血症,同时血同型半胱氨酸明显增高,提示甲基丙二酸血症合并同型半胱氨酸血症。患者曾于当地医院查血维生素B12浓度正常(维生素B12治疗前),亦无胃部疾患史、无挑食、偏食习惯,血内因子抗体阴性,因此也除外了因营养障碍性维生素B12缺乏所致的继发性甲基丙二酸血症。甲基丙二酸血症是先天性有机酸代谢异常中最常见的一组疾病,主要是由于甲基丙二酰辅酶A变位酶和辅酶钴胺素(维生素B12)代谢缺陷导致大量甲基丙二酸等代谢产物在体液和组织中的蓄积,引起神经系统、肝脏、肾脏、骨髓等多脏器损害。变位酶缺陷患者神经系统损害常较钴胺素代谢异常患者神经系统损害出现早,并且严重。少数钴胺素代谢异常所致甲基丙二酸血症患者可于青少年或成年后发病,为晚发型病例,多以神经系统损害为主要表现,病程相对为良性过程,对治疗的反应明显好于早发病例。结合本例临床,应考虑晚发型甲基丙二酸血症。甲基丙二酸血症神经系统损害可累及大脑皮层、锥体束、小脑、周围神经和视神经等多个部位,表现为进行性脑病、精神智能发育迟滞、惊厥、共济失调、亚急性联合变性、血栓栓塞性病变等,临床表现存在很大的异质性,缺乏特异性。甲基丙二酸血症患者脑CT、MRI扫描常见对称性基底节损害、弥漫脑萎缩,白质异常信号等,无特异性。本患者头颅MRI检查可见大脑皮层及小脑萎缩。综上所述,结合患者临床特点、神经系统影像表现以及尿有机酸分析、血生化检查结果,甲基丙二酸血症诊断明确。甲基丙二酸血症的治疗包括饮食治疗及药物治疗,低蛋白、高能量饮食,减少毒性代谢产物蓄积。甲钴胺肌注或口服能有效降低甲基丙二酸以及同型半胱氨酸的水平。左旋肉碱能促进甲基丙二酸和酯酰肉碱排泄,增加机体对天然蛋白的耐受性。甜菜碱、叶酸、维生素B6用于合并同型半胱氨酸血症患者。本例患者经上述治疗1个月余,症状略有好转,未再加重,还应长期随访疗效并监测尿中甲基丙二酸及血同型半胱氨酸含量变化。同时注意避免急性或间歇性发病诱因如发热、感染、饥饿、疲劳、外伤等应激状态,避免高蛋白饮食、输血或服用丙戊酸、大环内酯类药物等。
甲基丙二酸血症(methylmalonic acidemia,MMA)
甲基丙二酸血症(methylmalonic acidemia,MMA)是一种常见的有机酸血症,属于常染色体隐性遗传病,主要是由于甲基丙二酰辅酶A变位酶(methylmalonyl-CoA mutase,MCM)或其辅酶钴胺素(VitB12)代谢缺陷所致。MCM又分为无活性者为mut0型,有残余活性者为mut-型。辅酶钴胺素代谢障碍包括:腺苷钴胺素合成缺陷,即线粒体钴胺素还原酶缺乏(cblA)和钴胺素腺苷转移酶缺乏(cblB),以及3种由于胞质和溶酶体钴胺素代谢异常引起的腺苷钴胺素和甲基钴胺素合成缺陷(cblC、cblD和cblF),cblC、cblD和cblF这3种类型患者除有甲基丙二酸血症外,还伴有同型半胱氨酸血症,是中国甲基丙二酸血症患者中的常见类型。本患者同时合并同型半胱氨酸血症,应属于该3种类型中的一种,但具体分型仍有赖于基因检测。
甲基丙二酸血症常在婴幼儿起病,表现为喂养困难、发育迟滞、癫痫、视网膜色素变性、血液系统以及肾脏损害的症状,也可出现急性代谢危象。mut0型患者起病最早,80%在生后数小时至1周内发病,急性代谢紊乱,早期死亡率极高,预后不良。mut-及cb1A和cb1B型患者多在生后1个月后发病,cb1C和cb1D在新生儿期至成年发病者均有报道,cb1F报道较少。其中cblC型较常见,主要表现为巨幼红细胞贫血、生长障碍及神经系统症状。cblD型患儿发病较晚,无血液系统异常表现。cblF型患儿新生儿期出现口腔炎、肌张力低下和面部畸形,部分有血细胞形态异常。晚发患者多于4岁后发病,症状相对良性,对治疗的反应明显好于早发病例,多以神经系统症状表现为主,有时缺乏多系统损害以及代谢危象的特征性表现,很容易误诊。本例患者青少年起病,既往症状不明显,应属晚发型。其血气分析、血氨、肝肾功能等生化检查未发现代谢紊乱表现,无贫血,未发现其他器官系统受累证据,临床以神经系统症状为主要表现,符合晚发型病例的特点。
甲基丙二酸血症导致神经系统损害的机制目前认为与抑制线粒体能量代谢有关。甲基丙二酸是琥珀酸脱氢酶的竞争性抑制剂,后者为线粒体有氧代谢的关键酶,大量甲基丙二酸在体液和组织中的蓄积抑制线粒体能量合成,导致神经系统等多系统的损害。本例患者运动后血乳酸明显增高,考虑与线粒体能量代谢异常有关。有研究者报道MMA患者的头颅MRS可见病灶处及其附近部位N-乙酰天冬氨酸(NAA)水平降低,胆碱增加,可见异常乳酸峰,提示线粒体能量代谢异常引起神经细胞的损害。
甲基丙二酸血症神经系统表现多样,症状缺乏特异性,因此临床上需要与线粒体脑肌病等其他遗传代谢性疾病相鉴别。本例患者锥体束损害比较突出,这与文献报道一致。锥体束是遗传代谢性疾病常见受累的部位之一,尤其下肢明显,可能由于锥体束走行较长,远端对能量代谢异常较敏感。锥体束损害同时也可合并感觉平面和/或大小便障碍,表现类似亚急性联合变性,文献报道晚发型MMA中类似亚急性联合变性的症状是常见的临床表现。精神智能障碍也是晚发型MMA的常见神经系统症状,但部分患者也可能仅在急性应激情况下出现明显的智能损害。本例患者目前尚未发现明显的精神及智能障碍。本例患者眼底检查发现左眼视神经萎缩,视神经损害可以是MMA神经系统损害的一部分,这在以往报道的晚发型MMA患者中并非少见,所以在临床考虑甲基丙二酸血症时,应进行眼底检查,如发现视神经萎缩和视网膜色素变性等情况可协助诊断。反之若眼底检查发现上述异常,临床应怀疑甲基丙二酸血症等遗传代谢性疾病的可能性,进一步进行相关检查非常必要。
甲基丙二酸血症的头颅影像表现无特异性,晚发型MMA头颅MRI检查常表现为弥漫脑萎缩、脑室扩大、白质异常信号、基底节病变,亦可见小脑萎缩、胼胝体变薄或发育不良等改变,典型表现为双侧对称的苍白球异常信号。本例患者神经影像表现与文献报道类似,头颅MRI可见皮层及小脑萎缩,但未见基底节及深部白质病变。
采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)检测尿、血、脑脊液中有机酸和串联质谱(tandem mass spectrometry,MS/MS)检测血丙酰肉碱(propinoylcarnitine,C3)是目前确诊MMA的首选方法。本患者尿液中甲基丙二酸明显增加,血液中C3、C3/C0(游离肉碱)和C3/C2(乙酰肉碱)升高,符合MMA的诊断。基因检测是MMA分型最可靠的依据。其中MCM编码基因为MUT,定位于6p21.1;cb1A编码基因为MMAA,位于4q31.1-q31.2;cblB编码基因为MMAB,定位于12q24;cblC编码基因为MMACHC,位于1p34.1。通过基因检测可以明确分型,对于指导治疗及判断预后有重要意义。因条件限制本患者未能进行基因检测。
甲基丙二酸血症的治疗是长期性的,包括饮食治疗及药物治疗。饮食治疗原则是低蛋白、高能饮食,减少毒性代谢产物蓄积。限制天然蛋白质摄入量,以特殊配方奶粉或蛋白粉作为补充。应定期监测血液中蛋氨酸浓度,以防蛋氨酸缺乏。药物治疗中维生素B12是MMA最为重要的治疗药物,根据治疗反应,可分为维生素B12有效型及维生素B12无效型,cblC、cblD、cblF型多为维生素B12有效型,cb1A、cb1B型部分有效。维生素B12无效型是MMA新生儿期发病最常见的类型,多由于变位酶缺陷引起。对于维生素B12有效型患者,应予长期甲基钴胺素维持治疗,肌内注射1mg,每周1~2次,部分患者可口服甲基钴胺素500~1000μg/d。也有研究提出,肌注钴胺素较口服更能有效地降低同型半胱氨酸以及甲基丙二酸的水平。左旋肉碱可以促进甲基丙二酸和酯酰肉碱排泄,增加机体对天然蛋白的耐受性,常用剂量为50~100mg/(kg·d),急性期可增至300mg/(kg·d),口服或静脉滴注。对于合并同型半胱氨酸血症患者,可予甜菜碱(500~1000mg/d)及叶酸(10~30mg/d)、维生素B6(12~30mg/d)口服。对于维生素B12无效型且饮食控制治疗效果较差的患者可尝试肝脏移植治疗。研究表明肝移植仅能部分纠正MMA代谢缺陷,不能预防肾脏以及神经退行性病变的进展。肾移植可纠正肾衰并在一定程度上减少甲基丙二酸浓度。
甲基丙二酸血症患者的预后主要取决于疾病类型、发病早晚以及治疗的依从性。维生素B12有效型预后较好,其中cblA型预后最好,维生素B12无效型预后不佳,mut0型预后最差,晚发型患者临床进程较稳定且程度较轻,预后相对良性。
本例报道了1例以神经系统损害为主要表现的晚发型甲基丙二酸血症合并同型半胱氨酸血症患者,该病患者临床表现多样,症状体征缺乏特异性,易出现漏诊或误诊。在青少年或成人起病且神经系统多个部位受累,疑遗传代谢性疾病时,要考虑到甲基丙二酸血症的可能。对疑似病例应进行尿有机酸筛查,以利及早诊断和治疗,改善预后。
[1]Paulet A,Perennou D,Moreau T,et al.The adolescent and adult form of cobalamin C disease.J Neurol Neurosurg Psychiatry,2008,79(6):725-728.
[2]王宪玲,李存江.晚发型甲基丙二酸尿症的神经系统表现.中华内科杂志,2009,48(9):745-747.
[3]Sedel F,Fontaine B,Saudubray JM,et al.Hereditary spastic paraparesis in adults associated with inborn errors of metabolism:a diagnostic approach.J Inherit Metab Dis,2007,30(6):855-864.
[4]Pinar-Sueiro S,Martinez-Fernandez R,Lage-Medina S,et al.Optic neuropathy in methylmalonic acidemia:the role of neuroprotection.J Inherit Metab Dis,2010,33:S199-S203.
[5]Michel SJ,Given CA,Robertson WC Jr.Imaging of the brain,including diffusion-weighted imaging in methylmalonic acidemia.Pediatr Radiol,2004,34(7):580-582.
[6]Solomon LR.Oral pharmacologic doses of cobalamin may not be as effective as parenteral cobalamin therapy in reversing hyperhomocystinemia and methylmalonic acidemia in apparently normal subjects.Clin Lab Haematol,2006,28(4):275-278.
[7]周雁,彭琳,彭斌,等.双下肢无力行走不稳.中国现代神经疾病杂志,2012,12(3):375-378.













