患者男性,27岁。因“头痛4个月,发热、右侧肢体无力2个月”于2011年5月21日入院。
现病史
患者4个月前(2011年1月)无诱因出现头痛,不伴发热,不影响日常工作。于外院行头部CT检查无异常发现,亦未予治疗;1个月后(2011年2月底)头痛症状加剧,伴非喷射性呕吐,且间断出现发作性右侧肢体麻木无力,每次持续约15min(2011年3月初);发病后2个月时(2011年3月底)间断视物成双,外院增强MRI检查(2011年3月28日)显示双侧额上回、小脑半球异常信号,局部软脑膜异常强化(图1),遂至我院急诊(2011年3月31日)。体格检查:双眼视力0.90,双侧视盘水肿;颈强直可疑阳性。实验室检查:血白细胞计数11.56×109/L,中性粒细胞比例81%;腰椎穿刺脑脊液压力>330mmH2O,细胞计数460×106/L、白细胞计数180×106/L、单个核细胞比例95%,葡萄糖1.60mmol/L、氯化物117mmol/L、蛋白定量1g/L。急诊予甘露醇(250ml,1次/8h)、甘油果糖(250ml,1次/12h)静点(静脉滴注)降低颅内压治疗。急诊次日(2011年4月1日)出现发热,体温38℃,无其他伴随症状,加用静脉盐酸莫西沙星氯化钠注射液(0.4g,1次/d)抗感染并收入院。患者自发病以来主诉常咳嗽,但无痰,否认低热、盗汗、乏力等症状。入院前3个月体质量减轻10kg。
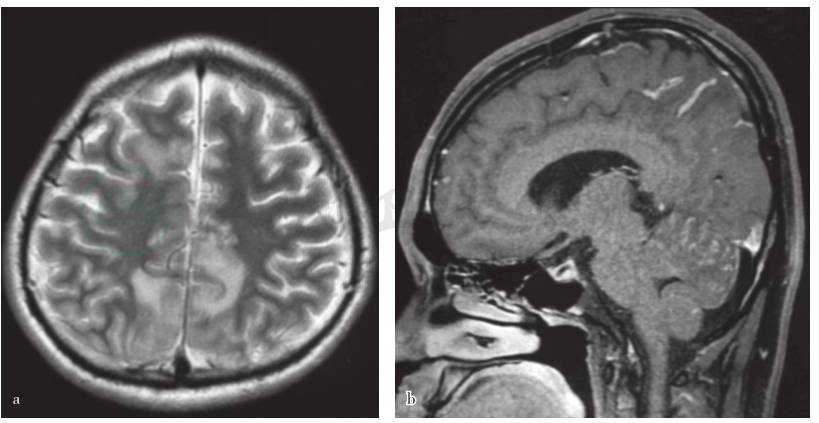
图1 发病后2个月时头MRI检查所见
a.横断面T2WI序列扫描显示双侧额、顶叶皮质长T2信号;b.矢状位增强T1WI序列扫描显示顶叶、小脑软脑膜异常强化
入院后完善血、尿、粪便常规、血清红细胞沉降率、超敏C反应蛋白(hsCRP)检测均于正常值范围;结核菌素纯蛋白衍化物(PPD)试验、痰液抗酸染色、血清结核感染T细胞斑点试验(T-SPOT.TB)均呈阴性反应;胸部CT检查显示左肺条索状影;入院后(2011年4月6日)再次行腰椎穿刺脑脊液压力>330mmH2O、外观呈淡黄色透明,白细胞计数200×106/L、单核细胞比例0.60、多核细胞比例0.40,蛋白定量3.12g/L、葡萄糖1.50mmol/L、氯化物115mmol/L,感染免疫检测梅毒螺旋体快速血浆反应素环状卡片试验、新型隐球菌抗原、抗酸染色、T-SPOT.TB均呈阴性反应。临床诊断“中枢神经系统结核感染”。予四联抗结核治疗:异烟肼0.3g(1次/d)、利福平0.45g(1次/d)、乙胺丁醇0.25g(3次/d)、吡嗪酰胺0.5g(3次/d)口服,并辅助泼尼松30mg(1次/d)口服抗炎及脱水降低颅压(2011年4月7日)。治疗近3周(2011年4月25日)时行头部MRI检查,显示病灶范围缩小,病灶强化程度减低(图2);复查腰椎穿刺(2011年4月27日)脑脊液压力>330mmH2O,白细胞计数180×106/L,单个核细胞比例90%,多核细胞10%,蛋白定量0.88g/L、葡萄糖1.50mmol/L、氯化物116mmol/L,T-SPOT.TB阴性。患者头痛症状明显好转,于2011年4月28日出院。出院后继续口服抗结核药物,自觉症状基本消失。2011年5月初无诱因出现阵发性眩晕,伴视物成双,数秒后症状自行消失,发作1次/d,2011年5月18日就诊于首都医科大学附属北京胸科医院,当天停用全部抗结核药物及泼尼松(20mg,1次/d),体温再次升高至39℃,并出现嗜睡、言语含糊、右侧肢体持续肌力减弱及阵发性不自主抖动,遂于2011年5月20日转入我院神经科。急诊检查:嗜睡,言语欠清;双眼活动自如,双侧外展均不及边、露白1mm;右侧鼻唇沟稍浅、伸舌右偏;右侧肢体肌力4+至5-级;病理征阴性,临床神经功能缺损评分(NIHSS)5分;头部CT无明显异常;眼科会诊:视盘水肿待查。临床拟诊“中枢神经系统感染,急性脑梗死,高血压病”。恢复抗结核药物异烟肼0.3g(1次/d)、利福平0.45g(1次/d)、乙胺丁醇0.25g(3次/d)、吡嗪酰胺0.5g(3次/d)口服治疗并加用头孢曲松(2g,1次/d)、莫西沙星(0.4g,1次/d)静脉滴注抗感染,口服阿司匹林、卡马西平、尼莫地平等,1天后(2011年5月21日)患者自觉嗜睡及右侧肌力有所好转,为进一步诊治再次收住入院。患者自发病以来精神尚可,食欲差,睡眠尚可,大小便无常,体重较上次出院时增加约3kg。否认光过敏、口腔溃疡及关节疼痛等病史。
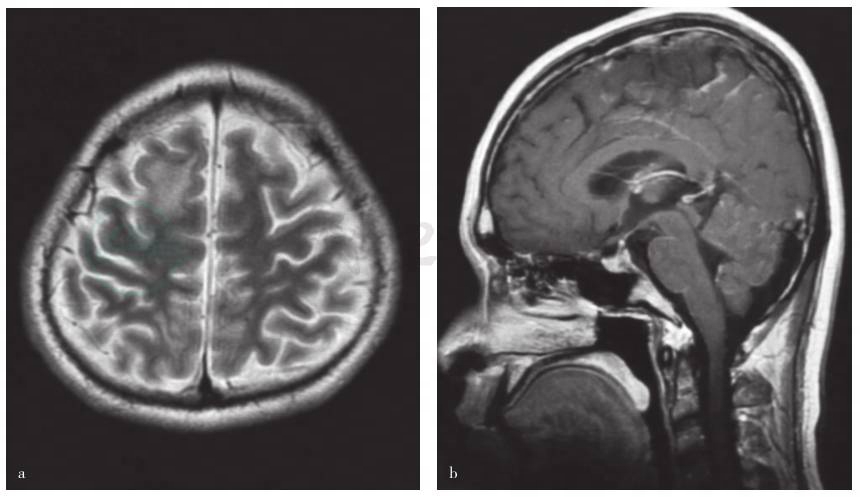
图2 首次入院抗结核辅助泼尼松治疗后MRI检查所见
a.横断面T2WI序列扫描显示双侧额顶叶病变范围缩小;b.矢状位增强T1WI序列扫描病变区域强化程度减轻
既往史
高血压病史10年,血压最高时达158/96mmHg,未治疗。
个人史
广东人,久居北京,否认鸽子接触史及宠物饲养史,无结核接触史。
家族史
无特殊。
入院后体格检查
神清,构音欠清楚,高级智能基本正常。双眼眼球外展露白,右侧鼻唇沟略浅,伸舌轻度右偏,余脑神经无异常。四肢肌张力基本正常,右侧上下肢肌力5-级,四肢腱反射对称引出,右侧共济运动稍差,感觉对称存在,双侧病理征阴性,脑膜刺激征阳性。
诊断与治疗经过
入院后继续接受四联抗结核药物治疗,异烟肼0.6g(1次/d)、利福平0.6g(1次/d)、乙胺丁醇0.75g(1次/d)、吡嗪酰胺0.5g(3次/d)口服治疗,以及泼尼松20mg(1次/d)口服、甘露醇250ml(1次/8h)静点抗炎及脱水降低颅内压;加用阿司匹林0.2g(1次/d)、尼莫地平30mg(3次/d)口服治疗脑梗死,加用卡马西平0.2g(2次/d)口服控制肢体不自主运动。入院后体温逐渐下降,右侧面瘫及肢体无力逐渐好转;实验室检查:血、尿、粪便常规、凝血功能试验、肾功能试验、感染免疫检测(四项)、红细胞沉降率(ESR)、血清抗结核分枝杆菌抗体、血清T-SPOT.TB、布鲁氏菌凝集试验、囊虫抗体等各项指标均于正常水平。血T、B细胞亚群分析:CD4+T淋巴细胞百分比为25.9%(38±8%)、绝对值 588/mm3(849±288),CD4/CD8 0.86(1.536±0.589),结论:CD4+T 细胞比例下降绝对值正常,CD4/CD8比例倒置;肝功能试验谷丙转氨酶(ALT)78U/L;血清超敏C反应蛋白3.36mg/L;脑电波正常范围;头部MRI(2011年5月26日)检查显示左侧基底节区片状亚急性梗死灶,右侧丘脑片状强化病灶,头MRA未见异常(图3)。再次入院(2011年5月23日)后腰椎穿刺检查,因脑脊液压力低而未测出,细胞总数2400×106/L、白细胞计数210×106/L、单核细胞比例0.98、多核细胞比例0.20;蛋白定量1.60g/L、葡萄糖1.20mmol/L、氯化物119mmol/L;墨汁染色阴性,隐球菌抗原呈阳性反应(1:8)。同期血液隐球菌抗原检测亦呈阳性反应(1:32)。此后连续两次(5月25日和6月1日)行腰椎穿刺术,脑脊液压力分别为100mmH2O、300mmH2O,脑脊液培养均见隐球菌生长(1CFU和3CFU),墨汁染色均呈阴性。停用四联抗结核药物治疗,改为两性霉素B(逐渐增量)静点及氟胞嘧啶(1.5g,3次/d)口服,两性霉素B逐渐增加剂量(第一天1g,第二天3g,第三天5g),同时继续予以甘露醇250ml(3次/d)静脉滴注降低颅内压,治疗3天(6月5日)后复查肝功能试验显示谷丙转氨酶112U/L,较前升高明显,由于患者原有较为严重的静脉炎疼痛严重,将治疗方案调整为:①诱导期,两性霉素脂质体B 200mg/d×5周静脉滴注,随后两性霉素B脂质体B 250mg/d×3周静脉滴注,同时口服氟胞嘧啶1.5g(3次/d);②巩固期,氟康唑400mg/d×6周。连续治疗2周后复查脑脊液隐球菌培养结果呈阴性。此后连续3次脑脊液细菌培养均未见隐球菌生长,蛋白定量及葡萄糖水平也基本恢复正常,外周血和脑脊液隐球菌抗原检测于治疗8周后转阴,脑脊液白细胞计数至患者出院前始终于较高水平(白细胞计数40×106/L、单核细胞比例1、多核细胞比例0)。住院近40天(6月29日)时头部MRI检查显示,左侧基底节和右侧丘脑异常信号演变为慢性期表现;右侧额叶、顶叶柔脑膜异常强化灶基本消失;左侧额叶及顶叶柔脑膜异常强化范围较前明显缩小(图4)。2011年7月29日患者临床症状完全消失出院。
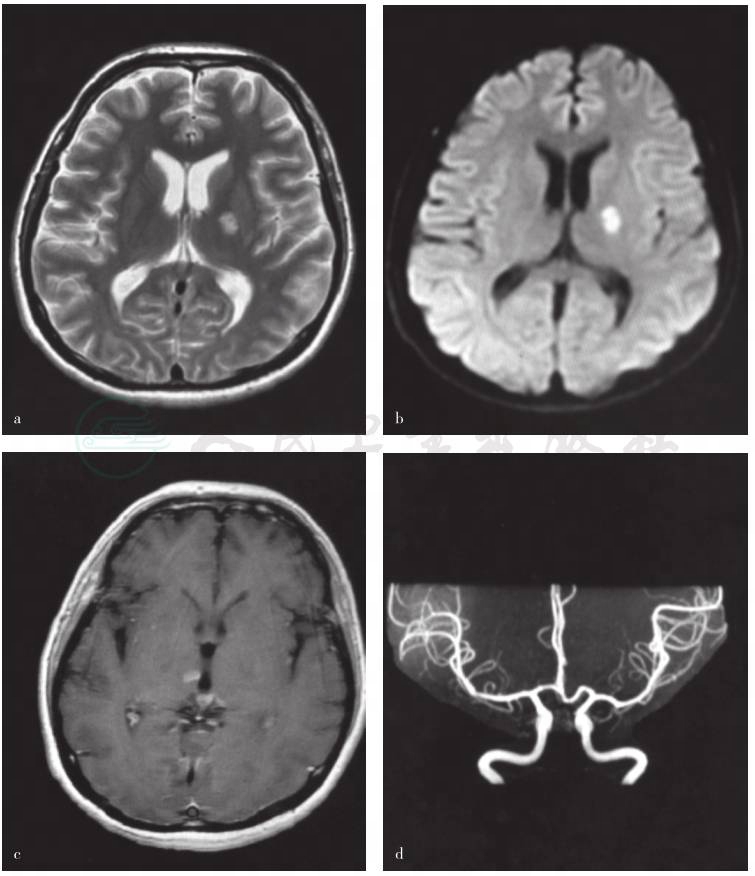
图3 患者持续右侧肢体力弱8天后头部MRI检查
a.横断面T2WI序列扫描可见左侧内囊后肢稍长T2信号;b.横断面DWI序列扫描显示左侧内囊后肢异常高信号;c.横断面T1WI增强扫描显示右侧丘脑异常强化型号;d. MRA检查未见明显异常
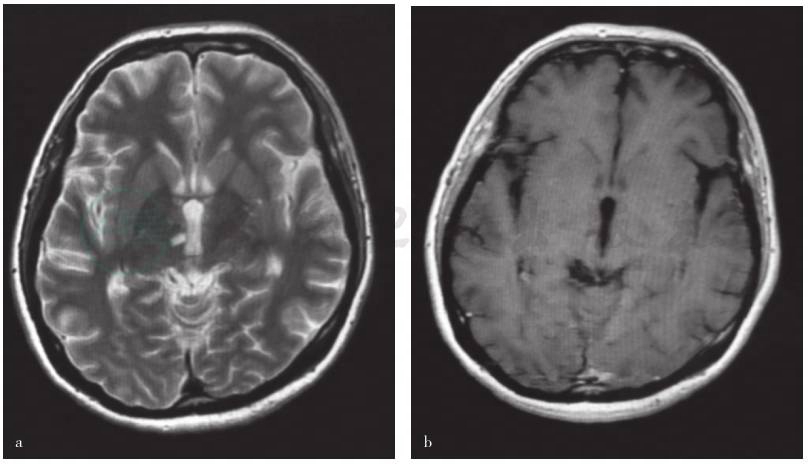
图4 患者接受抗真菌治疗后头部MRI检查
a.横断面T2WI序列扫描显示右侧丘脑陈旧性病变;b.横断面增强T1WI扫描可见底节异常强化灶消失
神经科主治医师
定位诊断,该患者右侧肢体肌力减弱,右侧中枢性面舌瘫,定位于左侧面神经核以上锥体束;颅内高压、脑膜刺激征阳性,定位于脑室脑膜系统;眩晕、复视,定位于后循环供血区脑干可能性大,但也不排除患者颅内高压致脑神经受累引起复视。综上,患者有脑实质、脑膜同时受累。定性诊断:该患者脑膜脑炎诊断明确,就辅助检查而言,目前尚无病原学直接证据,以脑膜受累为主,脑脊液检查显示以淋巴细胞为主的混合性细胞炎症反应,细胞计数中度升高,蛋白定量升高,葡萄糖和氯化物水平降低,首先应考虑结核性脑膜炎,首次入院抗结核药物治疗病情好转,院外停药后症状加重,再次入院急诊予以抗生素及抗结核药物后病情有一定好转,均支持结核分枝杆菌感染。此次呈急性发病,以局灶性神经功能缺损症状为主,结合影像学检查所见考虑缺血性脑血管病;结核性渗出物可影响流经的血管,继发血管炎性改变即结核性动脉炎,缺血性脑梗死是结核性动脉炎的常见并发症,特别是以位于颅底的大脑中动脉和豆纹动脉最易受累。但是该患者抗结核药物治疗过程中病情仍有反复,且颅底脑膜受累症状不突出、不典型,需警惕分枝杆菌中的其他种类或奴卡菌等非典型细菌,目前所用抗生素对其有一定覆盖,由于此类病原菌培养阳性率低,脑脊液培养阴性不能排除,必要时可行脑膜活检寻找病理学证据。鉴别诊断:①隐球菌性脑膜炎,隐球菌脑膜炎与结核性脑膜炎临床和脑脊液改变极为相似,因此较难区分,脑脊液墨汁染色及隐球菌抗原检测有助于鉴别诊断。若经上述检测仍不能鉴别,则治疗原则应首先考虑抗结核治疗。该患者脑脊液墨汁染色及隐球菌抗原检测均呈阴性,由于隐球菌抗原检测灵敏度高达90%,因此隐球菌感染的可能性较小,且未行抗真菌药物治疗病情即有所好转,故不支持隐球菌性脑膜炎,可多次复查血和脑脊液隐球菌抗原以排除诊断。②脑膜癌病,患者为年轻男性,无其他部位肿瘤证据,多次脑脊液细胞学检查均未发现肿瘤细胞,经抗感染治疗病情好转,基本可排除肿瘤性病变。③病毒性脑膜脑炎,患者以脑膜受累为主,病程相对迁延,多次脑脊液检测均表现为中性粒细胞比例增加,基本可以排除病毒性脑膜脑炎。
神经科教授
结合患者脑脊液显著炎症性改变,脑膜脑炎的诊断较为明确,就患者病程迁延及对抗结核药物治疗有效来看,病原学还是考虑结核分枝杆菌感染可能。不支持此诊断的证据为,病变以颅内凸面为主,非颅底最重;且抗酸染色、结核分枝杆菌培养甚至T-SPOT.TB、PPD试验均呈阴性,未发现直接的病原学证据,需考虑是否存在其他感染如新型隐球菌。鉴别诊断应注意脑膜癌病,脑脊液多次细胞学检测未见异常细胞,而且经抗结核药物治疗后患者病情确实有所好转,其临床症状较脑膜癌病偏良性。
神经科主治医师
该患者脑脊液隐球菌抗原检测及培养均呈阳性,隐球菌性脑膜炎诊断明确。隐球菌性脑膜炎为一类机会性感染,好发于免疫功能低下,尤其是细胞免疫功能低下的人群,AIDS患者疾病进展期CD4+T细胞绝对值<100×106/L为易感因素;其他还可见于系统性红斑狼疮、类风湿性关节炎、糖尿病、孕妇等免疫功能受损人群。国外自20世纪80年代以来隐球菌性脑膜脑炎发病率剧增,此与HIV流行有关,格特变种型隐球菌因其强致病性可感染免疫功能正常者,且患者多病情较重;而国内则多为免疫功能正常患者,其脑脊液隐球菌数量较少、抗原滴度低,但对抗真菌药物治疗效果良好。该患者早期隐球菌各项病原学检查均呈阴性,可能与其病原菌滴度较低有关。对于免疫功能正常的患者,隐球菌性脑膜脑炎的临床损害主要源于两方面:一方面为病原菌本身的致病性;另一方面为机体免疫损伤。该患者虽未给予抗真菌药物治疗,但在进行抗结核药物治疗的同时曾应用中等剂量的糖皮质激素治疗,症状有所好转可能是机体免疫损伤减弱所致。治疗方面,2000年及2010年美国颁布的隐球菌临床指南均推荐两性霉素B联合氟胞嘧啶,判断治疗有效的“金标准”为血及脑脊液隐球菌培养阴性,而抗原检测有一定滞后性,在指南推荐的治疗方案下,大多数患者脑脊液隐球菌培养可于2周内转阴,这与本例患者情况相符。脑脊液炎性细胞计数亦可作为反映炎症活动性的指标之一。该患者无获得性免疫抑制的实验室证据及临床表现,但其血CD4/CD8比例倒置,提示患者将可能存在一定的免疫功能异常。
随访
患者出院后继续口服氟康唑400mg/d,共治疗6周,出院约3个月时再次进行腰椎穿刺检查,脑脊液压力为200mmH2O,白细胞计数略高,蛋白定量、葡萄糖及氯化物均于正常值范围;各项隐球菌抗原指标亦在正常水平。出院后14个月行头部MRI检查显示,除右侧丘脑小软化灶外,均未见明显异常。否认头痛、发热、视物模糊及复视等症状,无肢体麻木、无力。
隐球菌性脑膜脑炎(cryptococcal meningocephalitis)
隐球菌广泛分布于周围环境,多达30余个种属,但仅少量种属具有致病性。新型隐球菌为最常见引起侵入性真菌疾病的带荚膜酵母菌,因其外覆一层多糖荚膜,一般染色不易发现,故被称为“隐球菌”。新型隐球菌通过呼吸道首先进入肺,大多数情况下可被肺的免疫系统所清除,故并不引起临床症状或仅表现出轻微临床症状;但当机体细胞免疫功能受损时,新型隐球菌可经血液循环进入全身各个系统并引起相应部位的感染,而中枢神经系统感染是隐球菌感染最常见表现类型之一。20世纪80年代之前,隐球菌感染十分少见,主要见于处于免疫抑制状态的患者,如血液系统肿瘤、晚期肝脏病变、肾功能衰竭等。20世纪80年代后,由于HIV感染流行以及器官移植技术的开展,使隐球菌感染发病率迅速上升,成为临床常见的条件致病菌。我们往往将隐球菌感染与免疫抑制状态相关联,但根据近期文献报道,免疫功能正常的人群亦可罹患隐球菌性脑膜脑炎。
新型隐球菌感染的严重性取决于病原体本身的毒性及机体免疫性双方面因素。外壁的荚膜多糖是新型隐球菌最主要的致病因子,其荚膜聚合物结构的不同是划分不同种属的抗原基础,根据不同的抗原性,新型隐球菌可分为新生隐球菌和格特变种型,新生隐球菌主要感染AIDS患者及处于免疫抑制状态的患者,而格特变种型则主要感染免疫功能正常的患者,同时也可感染AIDS患者,文献报道格特变种型更易导致播散性感染且病情比较严重。新型隐球菌感染可见于三大类人群,即获得性免疫缺陷患者、处于免疫抑制状态的患者(长期口服激素、免疫抑制剂、糖尿病、孕妇等),以及免疫功能正常的人群。Hong Nguyen等通过对3组隐球菌性脑膜脑炎患者临床表现及预后进行对比发现,免疫功能正常患者脑脊液炎性反应较其他组更为严重,而病情严重程度及病死率也显著高于其他两组(p=0.040),而且有部分患者可在抗真菌药物治疗后,脑脊液抗原滴度和病原菌培养均转阴的情况下出现病情恶化,提示宿主免疫功能在新型隐球菌感染的发病机制方面也扮演着一定角色。
新型隐球菌性脑膜脑炎临床表现多样,主要有三大类症状:脑膜炎症状(发热、头痛、恶心呕吐)、局部脑实质症状(癫痫、瘫痪、意识状态改变)及并发症(颅内高压、脑神经麻痹、脑梗死、脑积水),部分患者还可出现抗利尿激素分泌失调综合征(syndrome of inappropriate antidiuretic hormone secretion,SIADH)。脑梗死在隐球菌性脑膜脑炎患者较为多见,这是由于蛛网膜炎症引起相应部位穿支动脉的动脉炎,进而导致脑梗死,此为活动性脑膜脑炎常见并发症。梗死灶可以单发亦可为多发,大多位于基底节、内囊及丘脑等部位,与慢性脑膜脑炎颅底脑膜受累最重有关,而供应上述部位的穿支动脉均由此入颅,上述梗死部位的文献描述与本例患者脑梗死的部位相吻合。此外,脑积水也十分常见,除了炎性渗出和脑脊液蛋白定量升高导致脑脊液回流障碍外,Benesova等对13例新型隐球菌性脑膜脑炎患者进行尸检,其病理结果提示新型隐球菌大量聚集于蛛网膜下隙,免疫功能正常的患者可于蛛网膜颗粒中发现明显的肉芽肿组织,导致脑脊液回流不畅。颅内高压与该病病死率、病残率密切相关。刘正印等对北京协和医院1981—2001年诊断与治疗的26例新型隐球菌性脑膜脑炎患者进行总结显示,大多数患者的临床症状缺少特异性,合并基础病变使临床病情判断更加复杂,外院误诊率高达42%(误诊为结核性脑膜脑炎或狼疮性脑病复发)。因此,单纯依靠临床症状无法进行早期诊断,继而延误治疗,影响预后。
中枢神经系统新型隐球菌感染的影像学无特异性,可出现软脑膜和脑实质强化、脑水肿、脑积水、脑梗死和V-R间隙增宽等表现,脑脊液改变无特异性,常与结核分枝杆菌感染相混淆,本例患者初诊考虑为结核性脑膜脑炎。综上所述,新型隐球菌性脑膜脑炎的诊断需进行病原学检查,墨汁染色简单易行、特异性较高,但敏感性较差,文献报道的检测敏感性为5.20%~87%,如将脑脊液以500r/min离心10min后再行墨汁染色可增加检出的敏感性。新型隐球菌抗原乳胶凝集试验敏感度和特异度均可达90%,是目前较为常用的临床诊断方法。新型隐球菌血清或脑脊液培养是诊断的“金标准”。上述检查阳性与否均基于脑脊液含菌量,对于病变局限于脑实质的新型隐球菌肉芽肿性病变,因脑脊液中含菌量少,上述检查均不敏感,多需通过脑组织病理活检明确诊断,PCR技术对该病诊断可有较高的敏感性,但假阳性率较高。墨汁染色和抗原检测在脑脊液仅存有死菌时仍呈阳性,因此对治疗有效性的判断存在滞后性。
2000年美国过敏性疾病及传染病学研究所(National Institute of Allergy and Infectious Diseases,NIAID)颁布的临床指南仍将两性霉素B辅助氟胞嘧啶推荐为一线诱导治疗方案,可于最短的时间内清除病原菌,而且两性霉素B无论单药或联合用药均有较为显著的疗效;氟康唑可作为巩固或维持治疗的首选药物。无论中枢神经系统新型隐球菌感染是否合并其他系统播散性感染,治疗方案无变化。对于颅内团块样病变直径>3cm,由于对抗真菌药物反应欠佳,在条件允许的情况下,可采取外科手术治疗。由于颅内高压与患者病死及病残关系密切,指南推荐采取积极的降低颅内压治疗。基于新的研究及流行病学调查,美国感染病学会(Infectious Diseases Society of America,IDSA)在2010年发布了新的新型隐球菌病治疗指南(表1)。
表1 美国感染病学会2010年隐球菌性脑膜炎治疗指南
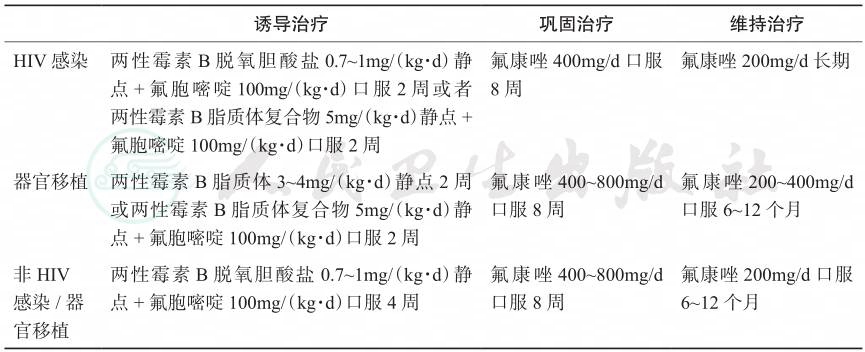
诱导治疗 巩固治疗 维持治疗 |
HIV感染 两性霉素B脱氧胆酸盐 0.7~1mg/(kg·d)静 氟康唑200mg/d长期 点 + 氟胞嘧啶 100mg/(kg·d)口服 2 周或者 两性霉素B脂质体复合物5mg/(kg·d)静点+ 氟胞嘧啶 100mg/(kg·d)口服 2 周 氟康唑400mg/d口服 8周 器官移植 两性霉素B脂质体3~4mg/(kg·d)静点2周 或两性霉素B脂质体复合物5mg/(kg·d)静 点 + 氟胞嘧啶 100mg/(kg·d)口服 2周 氟康唑400~800mg/d 口服8周 氟康唑200~400mg/d 口服6~12个月 非HIV 感染/器 官移植 两性霉素 B 脱氧胆酸盐 0.7~1mg/(kg·d)静 点 + 氟胞嘧啶 100mg/(kg·d)口服 4周 氟康唑400~800mg/d 口服8周 氟康唑200mg/d口服 6~12个月 |
两性霉素B为多烯类抗真菌药物,通过作用于细胞膜上的麦角固醇影响细胞膜通透性而发挥抑菌作用。有两种剂型,一种为两性霉素B脱氧胆酸盐,另一种为两性霉素B脂质体。两性霉素B脱氧胆酸盐价格便宜、应用广泛,但其肾脏等毒副作用较大,而两性霉素B脂质体相对不良作用较小,对不能耐受两性霉素B脱氧胆酸盐毒副作用者,推荐应用脂质体,但昂贵的价格在一定程度上限制了其临床应用。经研究证实,器官移植后罹患隐球菌感染的患者分别使用两性霉素B脂质体和两性霉素B脱氧胆酸盐治疗,90天病死率分别为10.9%和40%(p=0.007),具有明显差异。两性霉素B脂质体尚有独特的免疫调节作用,可通过抑制体内炎症因子激活信号,降低真菌感染过程中的炎性损伤。有些学者认为,糖皮质激素类药物可减轻水肿及炎性渗出,可用于病情较严重的患者,但目前尚存争议。
本例患者未发现基础病变,但其血液CD4/CD8细胞比值下降,可能存在潜在的免疫功能异常。该患者早期因临床症状不典型,实验室检查不特异,同时病原学检查呈阴性,被误诊为结核性脑膜脑炎,经反复复查脑脊液病原学最终确诊为新型隐球菌性脑膜脑炎,经规范的抗隐球菌治疗后,恢复良好。因此,对于临床疑似结核性脑膜脑炎但未发现病原学证据的患者,需进行反复多次的新型隐球菌病原学筛查。
[1]Ecevit IZ,Clancy CJ,Schmalfuss IM,et al.The Poor Prognosis of central nervous system Cryptococcosis among Nonimmunosuppressed Patients:A Call for Better Disease Recognition and Evaluation of Adjuncts to Antifungal Therapy.Clin Infect Dis,2006,42 (10):1443-1447.
[2]Nguyen MH,Husain S,Clancy CJ,et al.Outcomes of central nervous system cryptococcosis vary with host immune function:Results from a multi-center,prospective study.J of Infect,2010,61(5):419-426.
[3]刘正印,王爱霞,李太生,等.隐球菌性脑膜炎26例临床分析.中华内科杂志,2002,41(8):541-543.
[4]Sato Y,Osabe S,Kuno H,et al.Rapid diagnosis of cryptococcalmeningitis by microscopic examination of centrifuged cerebrospinal fluid sediment.J Neurol Sci,1999,164 (1):72-75.
[5]Perfect JR,Dismukes WE,Dromer F,et al.Clinical Practice Guidelines for the Management of Cryptococcal Disease:2010 Update by the Infectious Diseases Society of America.Clin Infect Dis,2010,50(3):291-322.
[6]Ben-Ami R,Lewis RE,Kontoyiannis DP.Immunocompromised hosts:immunopharmacology of modern antifungals.Clin Infect Dis,2008,47(2):226-235.
[7]李秀丽,卢强,马凌燕,等.发热,头痛,右侧肢体无力,言语含糊.中国现代神经疾病杂志,2013,13(1):85-91.













