患者女性,21岁。因“间断发热7个月余,意识不清伴肢体抽动6个月”于2007年11月9日入院。
现病史
2007年3月20日患者因“受凉”后出现发热,体温高达39~40℃,自服“感冒药”和阿莫西林后体温下降;但随之双手出现白色小水疱,米粒大小、呈透明状,伴疼痛、瘙痒,当地医院诊断为“过敏性皮炎”,予“外用药”涂于患处皮肤治愈。之后出现口腔溃疡,发热,体温38℃,自服感冒冲剂后体温下降。4月24日因被摩托车撞倒而出现鼻出血、左侧前额血肿,右上肢擦伤、臀部淤青,无意识障碍及喷射性呕吐,当地医院CT检查右侧下肢无明显异常,未行特殊处理。此后即出现情绪烦躁,言语逐渐减少,伤后3天出现言语不清、行走不稳、行为异常(如用筷子捞汤、两腿伸进同一裤管)等症状,当地医院脑电图检查呈现高度异常脑电活动,考虑脑炎予以治疗(具体不详),但病情无明显改善且呈渐进性加重,小便失禁、不能独立行走,遂于4月29日至当地医院就诊,头部CT和腰椎穿刺检查均无明显异常,而患者病情进一步加重,烦躁,喊叫,左侧肢体无自主活动。5月3日因发热(体温38℃)而至当地专科医院以明确诊断。入院时体格检查:嗜睡,双侧瞳孔直径3mm,对光反射存在,四肢肌张力正常,余项检查不配合。给予阿昔洛韦0.5g静脉滴注治疗4小时后体温下降,其余症状与体征无改善。并逐渐出现四肢不自主抽动,左上肢屈曲、其余肢体呈伸直状。5月5日腰椎穿刺检查白细胞计数20个/mm3,潘氏试验阳性,氯化物117.3mmol/L,细菌培养未见隐球菌生长,结核分枝杆菌抗体呈弱阳性(1:1);脑脊液细胞学检查显示细胞总数轻度增加,具体数值不详,以小淋巴细胞增加为主,可见单核细胞。考虑中枢神经系统感染,结核性脑膜脑炎待查。头部MRI未见异常。再次行脑电图检查,呈广泛重度异常脑电活动,双侧弥漫性慢波;继续采用阿昔洛韦静脉抗病毒治疗,病情仍无好转,并出现四肢僵硬症状。5月23日于该院复查常规MRI和DWI,显示枕叶及胼胝体压部异常信号,拟诊为病毒性脑炎致炎性脱髓鞘改变。予甲泼尼龙、丙种球蛋白IgG连续冲击治疗5天,治疗1周后病情好转,出院时理解能力略有改善,其余症状无变化。继续口服泼尼松,剂量减至30mg(1次/d),治疗7天后减为10mg(1次/d)。6月21日头部MRI检查显示,脑内多发异常信号,脑白质病变,6月25日再度进行甲泼尼龙0.5g/d冲击治疗5天,后口服泼尼松60mg(1次/d),1个月后减为10mg(1次/d),维持1个月后减至5mg(1次/d)。7月24日再次至当地专科医院复查,头部MRI显示脑白质病变明显加重,脑室扩大、皮质萎缩;颈、胸、腰部MRI未见异常。采用营养神经、改善微循环、抗癫痫、控制神经精神症状药物治疗,病情依旧;2007年10月20日发现患者骶尾部及左手小指皮肤破溃,伴发热(体温38~39℃,经抗炎药物治疗后体温降至正常范围,骶尾部皮肤逐渐愈合,左手小指仍有破溃;虽仍有间断性肢体抽动,但四肢无自主活动,仍不能与他人交流,可经口进食,恢复大小便意识,为求进一步诊疗转入我院。
患者自发病以来,无关节肿痛、口腔溃疡、眼干、口干、脱发、皮疹、光过敏、牙齿片状脱落等症状。
既往史
1.5岁时曾出现全身性皮疹,发病初期躯干部散在红色米粒大小皮疹,逐渐向全身蔓延,最后累及头面部,双眼上睑下垂,症状严重时自觉发热但未测体温,未予诊治,5~6天可自行缓解。7岁时罹患乙型肝炎。2001年行阑尾切除术。
个人史、月经及婚育史、家族史
无特殊。
入院后体格检查
恶病质体质,去大脑皮质状态,双侧上肢屈曲、下肢伸直、双手握拳,查体不能配合;骶尾部可见瘢痕形成,左小手指皮肤破溃。心、肺、腹部检查无异常发现。双眼左侧凝视麻痹、头向右侧转,强哭;双侧瞳孔等大、等圆,直径约为3.50mm,对光反射灵敏,双眼眼球运动检查不合作,鼻唇沟对称;四肢无自主活动,肌张力明显增高,左侧腱反射活跃;左侧病理征阳性;可见肌阵挛。
辅助检查
血、尿、粪便常规、凝血试验均正常。肝功能试验:碱性磷酸酶177U/L,余项正常。肾功能试验及电解质检测:肌酐31U/L,尿酸124U/L,余项正常。血清脂质水平于正常值范围。甲状腺功能:T3 3.93nmol/L、甲状腺素(T4)144.43nmol/L、游离 T3(FT3)7.62pmol/L、游离 T4(FT4)20.57pmol/L;促甲腺激素(TSH)0.381mU/L;β1C-球蛋白(C3)9720g/L、β1E-球蛋白(C4)2 920g/L。感染免疫检测:抗弓形虫抗体(toxo-IgG)阴性,风疹病毒抗体(RV-IgG,1:80)、巨细胞病毒抗体(CMV-IgG)和疱疹病毒抗体(HSV-IgG,1:64)阳性;toxo-IgM、RV-IgM、CMV-IgM 及HSV-IgM均呈阴性。血清红细胞沉降率(ESR)29mm/h,C反应蛋白(CRP)16.30mg/L。自身免疫反应检测:抗中性白细胞胞质抗体MPO-ANCA、PR3-ANCA、IIF-ANCA均呈阴性,抗核抗体(IgG型)、抗双链DNA抗体(IgG型)阴性。结核菌素试验(PPD)结果显示为2.50cm×1.00cm,血清抗ENA阴性。腹部B型超声检查提示肝脏局部回声增强。乙型肝炎病毒标志物检测(感染检测七项):表面抗原(HbsAg)、e抗体(HbeAb)、核心抗体(HbcAb)阳性,其余各项均呈阴性反应。血清蛋白电泳观察:α1球蛋白6.70%、α2球蛋白16.00%、β1蛋白5.20%、γ球蛋白11.80%。血清游离钙1.15mmol/L。T细胞亚群检测:CD4与T细胞比例、CD8与T细胞比例于正常值范围。脑脊液常规正常;蛋白定量0.48g/L、葡萄糖3.70mmol/L、氯化物123mmol/L。脑脊液细胞学检测无异常,细菌培养未见细菌生长,荧光抗酸染色阴性。脑脊液病毒和寄生虫抗体检测于正常范围,脑脊液寡克隆区带阳性,IgG合成率于正常值范围。血清和脑脊液麻疹抗体IgM阴性,IgG均阳性(1:800和1:20)。脑脊液14-3-3蛋白阳性,血清PRNP(朊粒蛋白)基因序列分析无突变,129位氨基酸多态性为M/M型。腰骶部正侧位X线检查显示左侧盆腔骶骨旁类圆形软组织密度影;腰骶部CT检查骶骨陈旧性粉碎性骨折,肌电图扫描未见周围神经源性损害,双侧下肢SSR异常。头部MRI检查显示双侧脑室旁大片状异常信号,脑组织萎缩(图1),与外院2007年7月26日比较脑组织萎缩程度更加明显,考虑亚急性硬化性全脑炎可能。胸腹部CT未见明显异常。脑电图扫描(2007年11月20)呈中度至高度不正常,各导联可见类周期样爆发高幅1.50~3.00cps大型慢波,每次约持续1秒,两次爆发间隔时间为2.5~5秒,间隔期各导联呈现较多低至中幅1.50~3.00cps慢波及慢脑电活动;次日(11月28日)复查脑电图基本同前。复查血清、脑脊液麻疹抗体IgM阴性、IgG阳性,血清滴度1:200,脑脊液1:20。
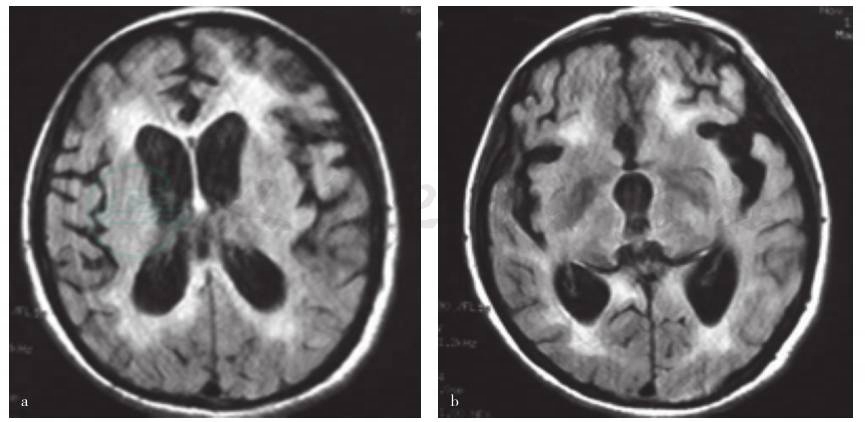
图1 患者头部MRI检查
a、b.发病16个月时,MRI表现为FLAIR像显示右顶叶皮层下白质高信号,双侧脑室旁白质高信号,皮质广泛性萎缩,脑室扩大
神经科主治医师
该患者定位诊断,去大脑皮质状态,双上肢屈曲、下肢伸直,考虑广泛性皮质受累;伴有双眼左侧凝视麻痹,考虑右侧额叶侧视中枢受累;左侧腱反射活跃、病理征阳性,定位于右侧锥体束;有强哭且掌颌反射阳性,考虑双侧皮质脑干束受损;头部影像学检查皮质、皮质下白质、枕部白质、胼胝体灶性异常信号,并逐渐出现白质异常信号融合为大片病灶,最终出现明显的皮质萎缩,与患者临床体征相符。定性诊断的考虑,呈急性起病,病情迅速达到严重程度,出现皮质、皮质下白质弥漫性病理改变,发病初期外院脑脊液检查存在淋巴细胞炎性反应证据,应考虑以下情况:①中枢神经系统病毒感染,常见的单纯疱疹病毒性脑炎,受累部位以颞叶、额叶底部、扣带回等为主,该患者临床表现及影像学征象与此病不相符。多灶性、进行性白质脑病多发生于成人,一般出现于机体免疫力下降时感染乳头多瘤空泡病毒所致。该患者既往身体健康,发病前无免疫抑制药物长期服用史,需进一步检查其T细胞亚群指标,以明确有无免疫力降低情况。亚急性硬化性全脑炎主要累及儿童和少年,由缺陷型麻疹病毒引起,发病初期表现为个性改变、言语困难,逐渐出现智力障碍,肌强直、阵挛。该例患者在发病初期可见手部皮疹,病程中间断性发热,虽然其皮疹由皮肤科就诊考虑季节性皮疹,不支持麻疹、皮疹表现,可行血清及脑脊液麻疹抗体检测阳性进一步明确有无麻疹病毒感染。HIV脑病也可导致痴呆、高级智能改变,但是该例患者无HIV感染证据,不支持诊断。慢病毒感染,如变异型克-雅病(CJD),一般呈亚急性、慢性病程,好发于中老年人群,可伴有共济失调、高级智能改变、肌阵挛,预后不良。该患者为青年女性,急性起病,约1周左右病情即迅速进入严重状态,亦不支持慢病毒感染性疾病。②弥漫性硬化,为炎性脱髓鞘疾病的一种危重类型,多见于青少年,表现为头痛、痴呆、同向性偏盲、皮质盲、失聪,不同程度偏瘫、四肢瘫痪、假性球麻痹等症状;影像学可见白质弥漫性损害。③中毒,有机物中毒如三氯乙烷、化疗药物、免疫抑制剂等。该例患者无相关毒物接触史,不支持中毒所致中枢症状。④代谢相关性疾病,卟啉病、高血压造成的可逆性后部白质脑病,但一般呈相对良性病程。⑤免疫相关性疾病,如系统性红斑狼疮可引起弥漫性脑白质损害,但是该患者无全身系统受累的相关表现,可进行血清免疫指标筛查。
经病毒病原学检查发现该患者血清、脑脊液麻疹病毒抗体阳性,结合临床、影像学、脑电图表现可诊断为亚急性硬化性全脑炎(subacute sclerosing panencephalitis,SSPE)。脑脊液麻疹病毒抗体IgG阳性是诊断SSPE的特异性实验室指标。
神经科教授
患者目前的大脑、去皮质状态均提示大脑功能严重受损,若此状态于1个月内好转即为短暂性损害、1个月后无改善则为持续性损害,而6个月后则为永久性损害,需考虑植物状态。引起植物状态生存的原因以炎症多见,其中最为常见的为病毒性脑炎如单纯疱疹性脑炎,但是腰椎穿刺结果及影像学表现不支持病毒性脑炎的诊断;患者既往无白血病及肿瘤病史,亦不支持进行性多灶性白质脑病。慢病毒感染,特别是CJD可有变异型,发病年龄较轻。而亚急性硬化性全脑炎需考虑,尽管其好发于儿童,但是亦有青年、成人暴发病例的报道,应重点完善病毒病原学方面的实验室检查。
患者影像学检查虽无特异性,但却反映了病毒性脑炎的演变过程:初期呈现脑灰质改变,之后轴索变性、白质脱髓鞘病变,最终脑组织广泛性萎缩;与此同时,血清和脑脊液麻疹抗体IgG检测阳性,支持SSPE的诊断。脑组织活检对于难以诊断的病例很有价值,可发现麻疹病毒抗原。该例患者已有病原学证据,故可不考虑行脑组织活检。脑脊液14-3-3蛋白及寡克隆区带无特异性,所有病毒性感染性疾病均可呈阳性反应。治疗原则以鞘内注射干扰素(IFN)、口服异丙肌苷以延缓病程进展,由于价格昂贵可考虑应用广谱抗病毒药物利巴韦林。
诊治经过
根据临床表现及头部MRI、腰椎穿刺、脑电图、血清及脑脊液麻疹病毒抗体等辅助检查结果,临床诊断“亚急性硬化性全脑炎”。给予口服利巴韦林0.3g(3次/d)抗病毒治疗,以及氯硝西泮1mg睡前口服,奋乃静2mg(2次/d)、巴氯芬5mg(2次/d)、丙戊酸钠250mg(2 次 /d)口服。
随访
患者出院后1年随访病情平稳,神经科检查无改善。腰椎穿刺检查脑脊液压力正常,白细胞计数2×106/L;蛋白定量0.27g/L,葡萄糖3.50mmol/L,氯化物122mmol/L;脑脊液细胞学检测无异常。血清抗麻疹病毒抗体IgM阴性,IgG阳性(1:800);脑脊液IgM阴性,IgG阳性(1:2)。脑电图仍显示周期样脑电活动,各导联呈中、高波幅2~3cps慢波,以1.50~4.00的间隔同期样出现,各周期之间表现为低波幅12~15cps快节律或5~6cps节律及活动,仍无正常节律、波形、调节均差;结论为普遍高度异常。头部MRI检查双侧脑室旁、额顶叶皮质下斑片状长T2信号,脑萎缩,与2007年12月27日比较无明显变化。
亚急性硬化性全脑炎(subacute sclerosing panencephalitis,SSPE)
亚急性硬化性全脑炎(subacute sclerosing panencephalitis,SSPE)为临床少见的由变异性麻疹病毒持续性中枢神经系统感染引起的炎性疾病。其发病年龄为6个月至35岁,但以儿童及青少年多见,大于85%发生于5~15岁,平均发病年龄为10~14岁,男女比例为(2~4):1。
该病早期病理改变以炎性病变和包涵体为主;中晚期则可有明显的白质髓鞘脱失,或脑灰质、白质弥漫性受累,表现为脑膜炎和脑炎症状与体征,累及皮质和皮层下灰质、白质,伴胶质细胞增生,血管周围可见浆细胞和淋巴细胞浸润。一般首先累及枕叶、顶叶和颞叶后部,随着病程的进展逐渐由后向前波及额叶。大脑皮质常最先受累,逐渐累及皮质下白质、基底神经节、脑干和颈髓上部,故称为“全脑炎”;胶质细胞增生形成结节,故称为“硬化性”。Anlar等对19例SSPE患儿行脑组织穿刺活检,采用DNA原位终末标记法检测细胞凋亡发生率,其结果显示各脑区神经元、少突胶质细胞、淋巴细胞和大胶质细胞均不同程度凋亡。
神经系统症状一般出现于麻疹病毒感染后7~11年。典型病例根据其特征可分为4期,Ⅰ期:行为及精神障碍期,主要表现为性格、行为和人格异常,包括嗜睡、情绪异常、学习困难等,此期持续时间约数周至数年。Ⅱ期:运动障碍期,本期的特征性症状是肌阵挛,发生于清醒期,肌阵挛的特点包括弥漫性、重复性和频发性。另外,还可发生舞蹈样动作、共济失调、癫痫发作,一般持续3~12个月。Ⅲ期:去大脑强直期,持续3~18个月。Ⅳ期:终末期,患儿呈植物状态生存,患儿常死于感染。但大多数病例无典型的临床分期,表现不典型。Arora等报告1例SSPE患者,呈急性起病,临床表现似急性播散性脑脊髓炎;Dimova等报告3例非典型性SSPE患者,其中1例急性起病,表现为卒中样发作,即右侧中枢性偏瘫、失语、癫痫发作,1例以右手运动性震颤起病,迅速进展为右侧额叶综合征(意向性失用症、运动性失语、左侧注视麻痹),余1例以左侧偏侧震颤性麻痹起病。亦有患者临床表现很难与一般病毒性脑炎相鉴别,可通过病原学检查和脑组织活检明确诊断。
头部MRI可辅助临床诊断,定期复查能够证实病变进展过程中的一些特征,例如逐渐发生并加重的皮质、皮质下及脑干病变,终至弥漫性脑萎缩。Tuncay等报告一组15例SSPE患儿的头部MRI改变,病程早期灰质和皮质下白质可见不对称性局灶性T1低信号、T2高信号,以大脑半球后部多见;病程<6个月者,MRI无明显异常征象;至中晚期,患儿MRI显示病变逐渐累及深部白质,最后呈广泛性脑萎缩。SSPE患儿的MRI表现与病程长短有关,而与病情程度无明显相关性。Anlar等对26例年龄为3~25岁的患者共进行34次MRI检查,发现异常信号常见于大脑皮质、皮质下白质、脑室周围白质、胼胝体、基底节、丘脑或脑干;其中绝大多数病例晚期呈弥漫性脑萎缩,个别可伴小脑萎缩,仅1例为孤立性大脑皮质(海马)损害,大脑皮质伴皮质下白质和脑室周围白质受累者较常见,白质受累可扩展至胼胝体,尤其是压部。MRI表现为病变呈弥漫分布,灰、白质均受累,具有一定特征性但缺乏特异性,主要需注意与进行性多灶性白质脑病、单纯疱疹病毒性脑炎等中枢神经系统炎性疾病相鉴别。进行性多灶性白质脑病MRI表现为皮质下多发性脱髓鞘斑,先从顶、枕叶出现向前扩散,呈长T1、长T2信号,无占位效应,脱髓鞘斑外缘锐利呈扇形或椭圆形,定期复查呈融合趋势。单纯疱疹病毒性脑炎的MRI表现,呈局限于一侧颞叶与岛叶的长T1、长T2信号,与正常信号的基底节形成良好的对比,于外侧裂周围有线条状强化,也可见病变区呈脑回状强化,常有明显的占位效应和病灶内点状出血,而对侧病变较轻。
脑电图在诊断中占据重要地位。在SSPE病程中,不同时期脑电图有着不同的特点:Ⅰ期可正常或仅出现非特异性慢波增多;Ⅱ期出现特征性改变,即周期性高幅尖波或尖-慢综合波爆发,或伴爆发后轻度抑制;Ⅲ期出现严重脑电图异常,主要表现为背景活动失节律和高波幅慢波;Ⅳ期脑电活动进一步恶化,节律更差,波幅下降。
对于SSPE的诊断,脑脊液麻疹病毒抗体阳性是明确诊断的必要条件,为了确保麻疹病毒抗体是由鞘内所合成而非血-脑脊液屏障破坏血清中抗体漏出的结果,因此需同时检测脑脊液其他病毒抗体,如单纯疱疹病毒、风疹病毒、巨细胞病毒等。综上,SSPE的诊断标准应符合以下条件。
(1)确诊条件
典型临床表现;脑脊液麻疹病毒抗体滴度升高(血凝抑制抗体>1:8)。
(2)支持诊断的条件
早期麻疹病史;脑电图异常的动态变化;血清麻疹病毒抗体滴度升高(血凝抑制抗体至少≥1:128);脑脊液球蛋白,特别是γ球蛋白表达水平升高。然而,许多SSPE患者的临床表现极为不典型,在诊断过程中应引起注意,可疑病例应及时行脑脊液麻疹病毒抗体。该例患者发病急骤,迅速进入去皮质状态,不是典型的亚急性脑炎表现,但是亦可有爆发型,而患者高级智能的改变、肌阵挛符合SSPE的临床表现,脑脊液、血清高滴度的麻疹病毒抗体IgG等项指标为明确诊断提供了有利的依据。该患者脑电图虽然未出现SSPE经典的爆发-抑制、周期性大慢波,但是可见类周期性爆发的大慢波,体现了脑电图对SSPE诊断的意义。
SSPE目前尚无疗效肯定、持久性治疗方式,据文献报道,采用IFN-2α鞘内或脑室内注射治疗或IFN-2β鞘内注射辅助口服异丙肌苷(isoprinosine)治疗有效。另外,亦可应用IFN-2α和利巴韦林联合鞘内治疗也有一定疗效的报道。但是SSPE患者预后不良,仅有37%的患者生存期超过1年。另外,对症治疗如加强营养、预防感染、控制癫痫发作、肌阵挛等也十分重要。
[1]Anlar B,Soyiemezoglu F,Elibol B,et al.Apoptosis in brain biopsies of subacute sclerosing panencephalitis patients.Neuropediatrics,1999,30(5):239-242.
[2]Dimova P,Bojinova V.Subacute sclerosing panencephalitis with atypical onset:clinical,computed tomographic,and magnetic resonance imaging correlations.J Child Neurol,2000,15 (4):258-260.
[3]Tuncay R,Akman-Demir G,Gökyigit A,et al.MRI in subacute sclerosing panencephalitis.Neuroradiology,1996, 38 (7):636-640.
[4]Anlar B,Saatci I,Kose G,et al.MRI findings in subacute sclerosing panencephalitis.Neurology,1996,47 (5):1278-1283.
[5]Honarmand S,Glaser CA,Chow E,et al.Subacute sclerosing panencephalitis in the differential diagnosis of encephalitis.Neurology,2004,63(8):1489-1493.
[6]Garg RK.Subacute sclerosing panencephalitis.J Neurol,2008,255(12):1861-1871.
[7]刘彩燕,李舜伟,崔丽英,等.发热意识不清四肢抽搐无力.中国现代神经疾病杂志,2012,12(1):93-97.













