作者:刘露露(住院医师 襄阳市中心医院消化二科)
指导者:韩晓颖(主任医师 襄阳市中心医院消化二科)
1.患者基本情况
患者:女性,60岁。
入院时间:2020年6月12日。
主诉:间断性腹胀8个月,加重1个月余。
现病史:8个月前因“上腹痛半年余”入住我院。当时除上腹部阵发性隐痛外,不伴有其他症状,也不影响饮食、睡眠和大小便,无体重减轻。患者嗜酒20年,40g/d左右。体格检查也未见明显异常。2年前行阑尾切除术,有“心肌缺血”和“肾结石”病史。血常规:白细胞计数2.55×109/L,中性粒细胞计数1.34×109/L,血红蛋白113g/L,血小板计数197×109/L;白蛋白 35.3g/L,其他肝酶正常;血清 CEA 21.93ng/mL,CA125Ⅱ 98.89U/mL,CA19-9 175.9U/mL;抗核抗体1∶1 000( +),D-二聚体5.64mg/L;乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)均阴性。腹部彩超:右侧腹、下腹部分别见前后径1.3cm、1.5cm的不规则液性暗区;CT提示肝硬化腹水和胰头体积稍增大;增强MRI提示肝硬化腹水、腹膜增厚强化。胃镜:糜烂性胃炎;肠镜:回盲瓣炎。给予对症治疗后腹水明显消退,腹痛症状缓解后出院。考虑到肿瘤标志物阳性和腹膜增厚原因不清,建议患者1个月后来医院复诊。由于经济原因,患者未坚持随访。患者近1个月觉腹胀不适,逐渐加重,外院仍以肝硬化腹水住院治疗。但CEA增至123.0ng/mL,增强CT提示肝脏多发持续强化结节,肝硬化,左卵巢形态不规范,考虑卵巢占位破裂、腹膜假黏液瘤可能。给予腹腔置管引流4d,患者觉腹胀症状改善不明显,再次转至我院。患者起病以来,精神、食欲欠佳,睡眠一般,体力下降、体重有所增加,大小便正常。
2.入院查体
一般生命体征:T 36.6℃,P 78次/min,R 18次/min,BP 115/72mmHg。神志清楚,皮肤、巩膜无黄染,肝掌(-),心肺听诊未闻及明显异常,腹平软,无压痛、反跳痛,肝脾肋下未及,腹水征(+),右侧中下腹部腹腔引流管脱落,双下肢无水肿。
3.入院辅助检查
血常规:白细胞计数2.55×109/L,中性粒细胞计数1.34×109/L,血红蛋白113g/L,血小板计数197×109/L;白蛋白35.3g/L,其他肝酶正常;血清CEA 21.93ng/mL,CA125Ⅱ 98.89U/mL,CA19-9 175.9U/mL;抗核抗体1∶1000(+),D-二聚体5.64mg/L;HBV、HCV均阴性。腹部彩超:右侧腹、下腹部分别见前后径1.3cm、1.5cm的不规则液性暗区;CT提示肝硬化腹水和胰头体积稍增大;增强MRI提示肝硬化腹水,腹膜增厚强化。胃镜:糜烂性胃炎;肠镜:回盲瓣炎。
4.初步诊断思维过程
患者因“腹胀8个月,加重1个月余”入院,有大量饮酒史;血小板计数正常,肿瘤标志物异常;影像学检查提示肝硬化并腹水,胰头体积稍增大,腹膜增厚强化;胃镜未见食管-胃底静脉曲张、肿瘤性病变,肠镜未见肿瘤性病变。患者是否存在肝硬化,腹水是否与肝硬化有关?
入院诊断:①腹水原因待查:肿瘤性腹水?②酒精性肝硬化失代偿期?
5.后续检查
(1)实验室检查
白细胞计数3.67×109/L,嗜碱性粒细胞占比0.011,淋巴细胞计数0.76×109/L,血红蛋白108g/L,血小板计数252×109/L;白蛋白36.1g/L;D-二聚体2.65mg/L;CEA 75.56ng/mL,CA19-9 530.81U/mL,CA125 98.1U/mL。
(2)影像学检查(图1)
①妇科彩超示子宫及双侧附件区声像图未见明显异常。②全腹部增强CT示肝脏表面欠规整,S7段稍低密度结节影,稍显强化;脾不大;腹水;肝外围及腹膜走行区多发结节状及条片状稍低密度影,与腹水分界欠清,下腔静脉近端局部受压明显变窄;胃腔扩张欠佳,壁厚,腹腔肠管走行结构紊乱;胰头钩突处体积增大,直径约3.1cm,强化密度较均;双侧附件区结构显示不清。③超声胃镜示腹腔多发低回声病灶,性质待定。
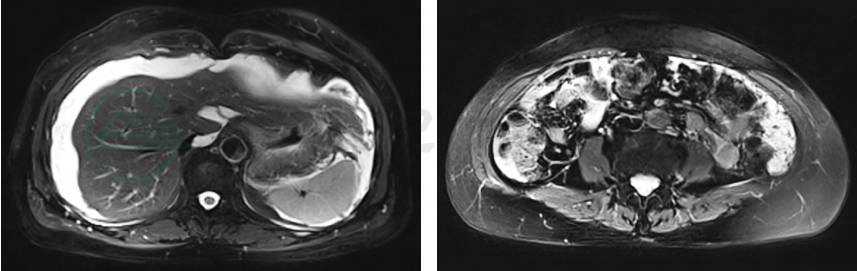
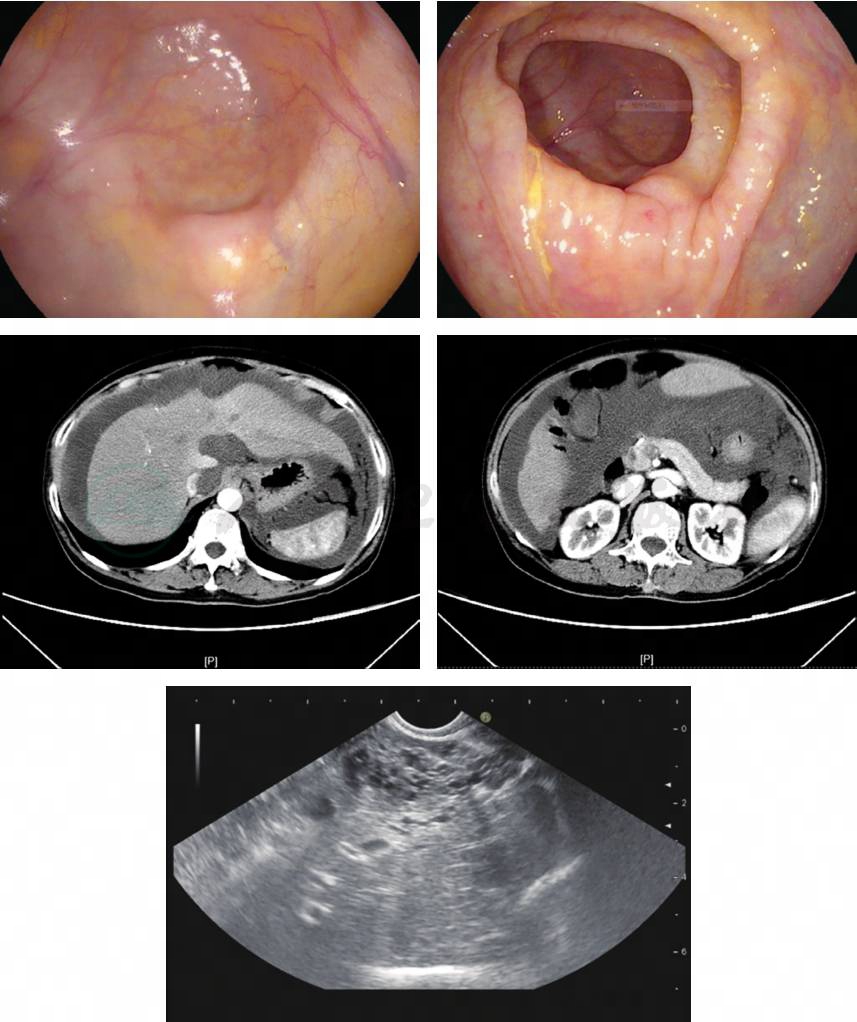
图1 影像学检查
(3)病理学
肝穿刺活检:轻微肝损伤,个别门静脉分支突入小叶。改良Scheuer评分:G0-1S1;METAVIR评分:A0F1。肝活检病变轻微,未见肝硬化,个别门静脉分支突入小叶,尚需除外非肝硬化门静脉高压的可能。
6.最终诊疗思维过程
患者,60岁,女性。2年前阑尾切除,1年前即出现上腹部阵发性隐痛,8个月前检查发现血清CEA、CA125和CA19-9升高,胃肠镜未见异常,超声检查提示肝硬化及腹腔“不规则液性暗区”,CT提示肝硬化腹水,MRI提示“腹膜增厚强化”。对症治疗后症状缓解出院。8个月后,因逐渐加重的腹胀和乏力再次入院,腹水明显增多,血清CEA、CA125和CA19-9明显升高,CT提示肝脏表面欠规整,腹膜多发结节状影;超声胃镜提示腹腔多发低回声病灶;超声检查引导下获得少量黄色(腹膜假黏液瘤特征性颜色)胶状黏液物质;肝活组织检查未提示肝硬化组织学改变;外科手术证实腹膜假黏液瘤(pseudomyxoma peritonei,PMP)的诊断。结合该病例,进行文献复习发现,腹膜假黏液瘤在诊断方面也有一些典型的特点。本病例一直误诊为肝硬化认真梳理后发现,患者的诸多表现难以用肝硬化来解释。患者没有发生肝病的原因,肝功能正常,没有门静脉高压的表现和低蛋白血症而出现腹水;不规则液性暗区;腹膜增厚强化;胶冻状腹水;腹膜走行区多发结节,等等。即使没有肝活检排除,也很难用肝硬化来解释。特别是有阑尾切除史和胶冻状腹水,应要想到腹膜假黏液瘤的可能。
最终诊断:阑尾黏液瘤。
1.概念和分类
腹膜假黏液瘤(PMP)是一种少见的腹膜继发性肿瘤。由于可用数据有限,PMP在人群中的真实发病率尚不清楚,估计每年约为百万分之二。
一般来说,原发性病变起源于腺瘤、黏液性阑尾腺癌或卵巢肿瘤,也有腹膜原发性PMP。随着分子诊断技术的发展,阑尾已被证实为PMP的主要影响器官,而卵巢通常是次要部位。本例PMP起源于阑尾。PMP主要是通过种植转移而不是淋巴转移或血行转移。原发性病变破裂,将肿瘤细胞释放到腹腔,从而发生播散。肿瘤细胞产生黏蛋白,并负责形成特征性的“果冻肚”。
根据Ronnett的分类,PMP在组织学上可分为3种类型:①播散性腹膜腺黏液蛋白病(disseminated peritoneal adenomucinosis,DPAM),一般认为是良性病变,腹膜病变由大量胞外黏液组成,含有少量的局灶性增生黏液上皮和小的细胞学异型性;②腹膜黏液蛋白癌病(peritoneal mucinous carcinomatosis,PMCA),易形成恶性肿瘤,腹膜病变由更丰富的黏液上皮组成,具有癌的结构和细胞学特征;③中间型,表现出DPAM和PMCA的混合特征。
根据组织发生、分子遗传学和临床行为的分类,PMP可分为低级别和高级别。①低级别PMP的特征是低细胞性的黏蛋白池(<10%),不明显的细胞学和非复层立方上皮;②高级别PMP的特征是具有高细胞性的黏蛋白池、中度/重度细胞学异型性和具有纤维增生间质的筛状或印戒状。
2.临床表现
PMP通常在初始阶段无症状,往往是非特异性症状,甚至不记得任何与肿瘤破裂相关的急性腹痛。随着黏液积聚的增加,PMP可表现为恶心、呕吐、贫血、疲劳、食欲减退、体重减轻、腹水和其他非特异性症状。本例患者8个月前即有“半年余”的腹部症状,但没有影响到生活就没有在意。持续1个月以上,患者才出现逐渐加重的腹部不适,精神、食欲欠佳,体力下降、体重有所增加(腹水)。据报道,PMP偶尔会有肠梗阻的表现。体格检查可表现为腹围增大、腹水征阳性、腹部触诊有揉面感、腹部压痛和腹部肿块。
3.辅助检查
PMP没有特异性肿瘤标志物。CEA、CA19-9和CA125可作为PMP的辅助诊断指标,反映PMP的严重程度和预后。CEA、CA19-9和CA125阴性患者的术后生存时间是3种肿瘤标志物阳性患者的2.6倍。与CA19-9阳性组相比,CA19-9阴性组不仅更容易接受足够的肿瘤细胞减灭术,而且显示出明显更长的中位复发时间。CEA常增高,目前已经有针对CEA增高的这种恶性肿瘤的靶向治疗方法。本例患者CEA、CA19-9和CA125均阳性,而且CEA和CA19-9持续升高,胃肠镜未见异常,更应该考虑本病的可能。免疫组化可根据以下特征帮助诊断 PMP:CK7(+)、CK20(+)、CDX2(+)、MUC2(+)、MUC5AC(+)、ER(-)和PR(-);下一代测序(GNAS)对预后也有一定作用,GNAS突变的患者在无进展生存率方面表现出明显较差的预后。
PMP超声检查表现为中等量的腹水,包括间隔和回声、浸润性实质性结节和腹膜肿块,肝、脾、子宫和其他腹部器官周围有锯齿状或扇贝状改变。最具体的迹象是在增厚的腹膜中存在低回声区,在超声检查通常有蛋糕状外观。本例患者8个月前的超声检查,已经提示“右侧腹、下腹部分别见前后径1.3cm、1.5cm的不规则液性暗区”,这是区别于肝硬化腹水的特征性表现,很遗憾没有引起临床的注意。据报道,高频超声检查能清楚显示腹部器官的压力痕迹,偶尔也能显示原发性PMP病变,有时还能显示通过肿块的分支或网状血管,还可以在超声检查引导下获得胶状黏液物质和增厚的腹膜或结节活检。本例患者在超声检查引导下获得少量黄色(PMP特征性颜色)胶状黏液物质。
CT能显示原发性PMP病变的分布、浸润范围以及腹水密度的异常,目前已经作为该病的首选。其他特征包括肝脏和脾脏表面的贝壳状压力痕迹、大网膜增厚、腹膜浸润、肠系膜和网格状改变。低密度区的钙化也是腹膜假黏液瘤的一个特殊发现。当被肿瘤严重侵犯时,大网膜将成为典型的“ 网膜饼”样密度影。由于大量黏液腹水向脊柱一侧或两侧挤出,小肠在CT重建中可显示“隐匿征”。以上征象反映了PMP的CT特征,对诊断有一定帮助。本例患者在8个月前CT提示肝硬化,实际上是肿瘤压迫(贝壳状压力)导致肝脏变形,后来的肝脏活组织检查也证明没有肝硬化。
MRI可以显示与CT相似的特征,但MRI可以识别肠壁和肿瘤边界。显示肿瘤与器官受累之间的关系,代表了MRI的另一个优势。8个月前,“增强MRI提示肝硬化腹水,腹膜增厚强化”仍然没有引起临床的重视,因为肝硬化不会出现腹膜增厚的征象。
PET/CT是最常用于寻找肿瘤的工具,而且对PMP还可以预测腹膜播散和评估术前病理分级;腹腔镜技术用于病理检查时的选择性活检,还可以收集腹水,识别肿瘤细胞,从而提高诊断准确率。如果肿瘤广泛移植,可以在腹腔镜的指导下通过腹膜导管立即进行进一步治疗。由于经济的原因,患者没有能够进行这两项检查。
4.治疗
肿瘤细胞减灭术(cytoreductive surgery,CRS)和腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)被推荐为PMP的标准治疗方法。手术结束时评估完全细胞减灭(complete cytoreduction,CC)的完整性。通过测量最大残留肿瘤病灶的直径,可将手术分为CC0(完全切除所有可见病灶)、CC1(最大残留病灶直径<0.25cm),CC2(0.25cm≤最大残留病灶直径<2.5cm)和CC3(最大残留病灶直径≥2.5cm)。CC0和CC1被认为是完全细胞减灭,这是PMP最重要的预后因素之一。本例患者在上级医院进行了CRS治疗,具体方法不详。
虽然完全切除在某些情况下是不可能的,最大肿瘤去除仍然提供了显著的生存优势和生活质量的显著改善。一旦细胞减灭完成,就应该交付HIPEC。HIPEC可作为CRS的治疗辅助物,药物敏感性的预处理评估可有助于HIPEC的个体化。一项研究调查了接受CRS和HIPEC联合治疗的PMP患者的生活质量,发现79%的患者会再次接受这种联合治疗,因为它改善了他们的生活。此外,他们的生活质量并没有因为重复治疗而降低。
5.预后
一项对2298例经CRS+HIPEC治疗的PMP患者调查显示,中位生存时间为196个月(16.3年),中位无进展生存期为98个月(8.2年),3年生存率为80%,5年生存率为74%,10年生存率为63%,15年生存率为59%。另一项242例无HIPEC的CRS患者的治疗结果,5年生存率为40%,10年生存率为27%。CRS联合HIPEC治疗似乎具有良好的长期疗效和保护性预后。













