作者:张思寒(主任医师 福建省消化系统肿瘤与上消化道疾病临床医学研究中心)
指导者:陈丰霖(主任医师 福建医科大学附属协和医院消化科)
原发性胃淋巴瘤(primary gastric lymphoma,PGL)是以胃为原发部位的恶性肿瘤,占所有非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)的4%~20%,占所有胃肿瘤的5%,是最常见的淋巴结外非霍奇金淋巴瘤。病理类型以弥漫大B细胞淋巴瘤及黏膜相关淋巴组织(mucosal-associated lymphoid tissue,MALT)淋巴瘤多见,少见T细胞淋巴瘤、伯基特淋巴瘤、套细胞与滤泡型淋巴瘤等。PGL常见的临床症状包括上腹痛、腹胀、呕血、黑便、腹部肿块、贫血等,偶可并发急性消化道大出血、消化道穿孔等,临床表现常难与胃癌、胃炎相鉴别。
伯基特淋巴瘤(Burkitt lymphoma,BL)是一种罕见且具有高度侵袭性的B细胞非霍奇金淋巴瘤,占成年人淋巴瘤的1%~2%,好发于青少年和儿童,疾病进展快,常规化疗效果不佳,在成年人中少见且预后相对较差。伯基特淋巴瘤是起源于生发中心或生发中心后B细胞的高度侵袭性成熟B细胞淋巴瘤,恶性度高,常伴有结外侵犯。伯基特淋巴瘤分为以下3个变异型。①地方型伯基特淋巴瘤:主要见于中非国家,地域分布与疟疾相一致,发病高峰年龄为4~7岁,男女比为2∶1,EB病毒阳性率达95%以上,最常见的临床表现是下颌、眶周肿胀,其次为腹部累及表现,骨髓和中枢神经系统累及表现少见;②免疫缺陷相关型伯基特淋巴瘤:常见于人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者,也见于器官移植而长期服用免疫抑制药的患者,少见于先天性免疫缺陷者,常累及淋巴结和骨髓;③散发型伯基特淋巴瘤:没有明显的地域分布或气候特征,世界各地均有发病,EB病毒阳性见于15%~30%或更少的病例。儿童较成人常见,占成人淋巴瘤的1%~2%,占儿童非霍奇金淋巴瘤的30%~40%。成年人伯基特淋巴瘤常以腹部肿块、B症状(发热、盗汗、体重减轻)以及肿瘤溶解综合征的形式起病,腹部尤其回盲部是最常见的累及部位,并可累及卵巢、肾、网膜、Waldeyer环和其他部位。淋巴结累及在成年人比儿童更为常见。伯基特淋巴瘤亦可表现为恶性胸膜渗出或腹水,少数病例表现为白血病。本例患者以腹痛、黄疸为主要表现,后淋巴瘤破溃合并消化道出血,并无明显的B症状及腹部肿块,具有一定的隐匿性。
诊断伯基特淋巴瘤必须依据特征性组织学改变并结合免疫组织化学标记。组织学上,伯基特淋巴瘤分化程度很低,恶性程度很高,显微镜下观察可见均匀淡染的巨噬细胞背景下均匀散布着肿瘤细胞,表现为特有的“星空”现象。本病例具有伯基特淋巴瘤典型免疫组织化学标记,瘤细胞表达成熟B细胞分化抗原,CD20(+);表达滤泡生发中心细胞标记CD10(+)和bcl-6(+);bcl-2部分阳性,c-myc约85%阳性,Ki-67接近100%。形态学表现为肿瘤细胞中等大,核圆形、卵圆形,可见小核仁,核分裂象多见,可见星空现象。
成人伯基特淋巴瘤发病率低,前瞻性临床研究极少,尚无确定的最佳治疗方案。过去,对于伯基特淋巴瘤采用CHOP[C指环磷酰胺(cyclophosphamide),H指阿霉素(hydroxyldaunorubicin),O指长春新碱(oncovin),P指泼尼松(prednisone)]等低强度化疗方案,预后较差。目前多采用多药联合、高强度、短疗程的化疗方案,联合鞘内注射等措施加强对中枢神经系统疾病的预防,治愈率较过去的治疗方案明显升高,对于部分患者已为可治愈的疾病。伯基特淋巴瘤的治疗以化疗为主,包括全身治疗和中枢神经系统预防/治疗两方面。化疗联合利妥昔单抗治疗能有效提高对伯基特淋巴瘤的疗效。化疗方案包括高剂量环磷酰胺(或异环磷酰胺)、中枢神经系统预防,鞘内注射治疗(氨甲蝶呤和/或阿糖胞苷),高剂量氨甲蝶呤和/或阿糖胞苷;主要推荐CODOX-M/IVAC+利妥昔单抗方案、Hyper-CVAD/MTX-Ara-C+利妥昔单抗方案、DA-EPOCH+利妥昔单抗方案等。
1.患者基本情况
患者:男性,45岁,汉族,已婚,福州人,职员。
入院时间:2019年12月6日。
主诉:腹痛2d。
现病史:入院前2天无明显诱因出现左下腹闷痛,程度不剧,呈持续性,后转为左中上腹持续性闷痛,程度尚可,无向他处放射,改变体位无缓解。自觉尿黄。无发热,无畏冷、寒战,无恶心、呕吐。
既往史:否认肝炎、结核等传染病史,否认药物过敏史。
个人史:否认吸烟史,机会性饮酒史。
家族史:无特殊。
2.入院查体
一般生命体征:T 37.0℃,P 80次/min,R 19次/min,BP 106/80mmHg。神志清楚,皮肤、巩膜轻度黄染。全身浅表淋巴结无肿大,心肺查体无特殊。腹软,左中上腹压痛,无反跳痛,墨菲征阴性,肝脾肋下未触及,肝区无叩击痛,移动性浊音阴性。肠鸣音4次/min。双下肢无水肿。
3.入院辅助检查
实验室检查(2019-12-06):淀粉酶826.0U/L,脂肪酶12109U/L;白细胞计数11.0×109/L,血红蛋白153.0g/L,血小板计数342×109/L,C反应蛋白91.06mg/L;降钙素原0.106ng/mL;总胆红素(TBil)71.5μmol/L,直接胆红素(direct bilirubin,DBil)40.6μmol/L,间接胆红素(indirect bilirubin,IBil)30.9μmol/L,谷丙转氨酶357U/L,谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)109U/L,γ-谷氨酰转肽酶(gamma-glutamyl transferase,GGT)872U/L,碱性磷酸酶(alkaline phosphatase,ALP)307U/L,乳酸脱氢酶(lactate dehydrogenase,LDH)348U/L。
全腹CT平扫(2019-12-06):①胰腺周围渗出,考虑急性胰腺炎可能,待结合临床诊断;②脂肪肝,肝左叶小钙化灶(图1)。
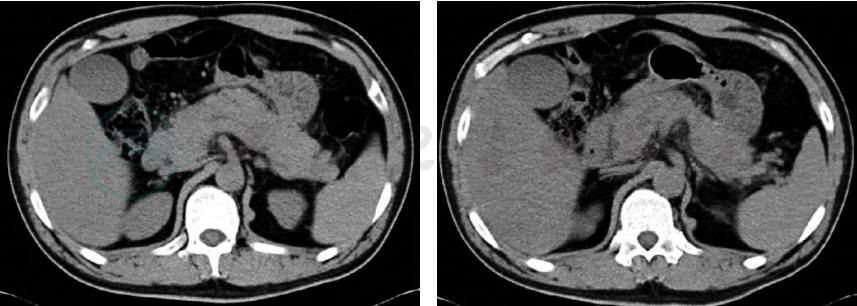
图1 急诊全腹CT(2019-12-06)
4.入院诊断思维过程
(1)入院时病情总结
患者中年男性,以“腹痛2d”为主诉入院,查体中上腹轻压痛,无反跳痛,急诊检查示血白细胞及C反应蛋白升高,淀粉酶大于3倍正常值,腹部CT提示胰腺渗出改变。虽然患者腹痛部位及性质不典型,但结合淀粉酶及CT表现,考虑急性胰腺炎。
(2)入院时诊疗思路
患者腹痛,还应考虑消化性溃疡、肠梗阻及消化道穿孔等病,但结合患者门诊查CT结果及无停止排气、排便等,考虑肠梗阻及消化道穿孔可排除;患者无慢性、节律性腹痛,目前消化性溃疡证据不足。患者急性胰腺炎诊断明确,因门诊查肝功能提示胆红素及转氨酶升高,且胆道酶升高,考虑胰腺炎原因为胆源性可能性大,需进一步完善后续相关检查。
(3)入院初步诊断
急性胰腺炎(轻型,胆源性)。
5.后续检查
(1)第一次入院辅助检查
2019-12-07:白细胞计数8.73×109/L,血红蛋白145.0g/L,血小板计数317×109/L,中性粒细胞占比0.7380,CPR 104.95mg/L;总胆固醇6.10mmol/L,低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)4.84mmol/L;血淀粉酶 468U/L;纤维蛋白原(fibrinogen,FIB)6.53g/L,D-二聚体1.15μg/mL;乙型肝炎表面抗体(hepatitis B surface antibody,HBsAb)18.81S/C.O,乙型肝炎e抗体(hepatitis B e antibody,HBeAb)0.04S/C.O,乙型肝炎核心抗体(hepatitis B core antibody,HBcAb)0.02S/C.O。尿常规、大便检查+隐血均阴性。
2019-12-09:糖类抗原(carbohydrate antigen,CA)19-9、CA242、CA125、癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(α-fetoprotein,AFP)、游离前列腺特异抗原、前列腺特异抗原、Cyfra21-1、神经元特异性烯醇化酶、游离前列腺特异性抗原(free prostate specific antigen,fPSA)/前列腺特异性抗原(prostate specific antigen,PSA)均正常。心电图大致正常。
2019-12-10:脂肪酶1567U/L;白细胞计数7.23×109/L,血红蛋白151.0g/L,血小板计数333×109/L,C反应蛋白63.26mg/L。谷丙转氨酶278U/L,谷草转氨酶143U/L,碱性磷酸酶378U/L,γ-谷氨酰转肽酶1117U/L,总胆红素99.2μmol/L,直接胆红素73.1μmol/L,间接胆红素26.1μmol/L,总胆汁酸106.4μmol/L,总胆固醇7.28mmol/L,甘油三酯(triglyeride,TG)1.92mmol/L,低密度脂蛋白胆固醇5.56mmol/L。
2019-12-13:白细胞计数7.88×109/L,血红蛋白147.0g/L,血小板计数340×109/L,C反应蛋白21.64mg/L;谷丙转氨酶307U/L,谷草转氨酶147U/L,碱性磷酸酶478U/L,γ-谷氨酰转肽酶1321U/L,总胆红素132.4μmol/L,直接胆红素101.2μmol/L,间接胆红素31.2μmol/L,总胆汁酸169.0μmol/L;葡萄糖(glucose,Glu)7.45mmol/L,淀粉酶241U/L;脂肪酶8011U/L;降钙素原0.134ng/mL。
磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)(图2):①胰腺异常改变,考虑急性胰腺炎可能;②肝内外胆管扩张,胰管扩张;③胆囊炎症;④脂肪肝。上腹部CT平扫(图3):①胰腺周围渗出,考虑急性胰腺炎可能,较前相仿;②脂肪肝,肝左叶小钙化灶;③肝内、外胆管稍扩张,较前新增,待结合临床诊断;④胆汁淤积可能。

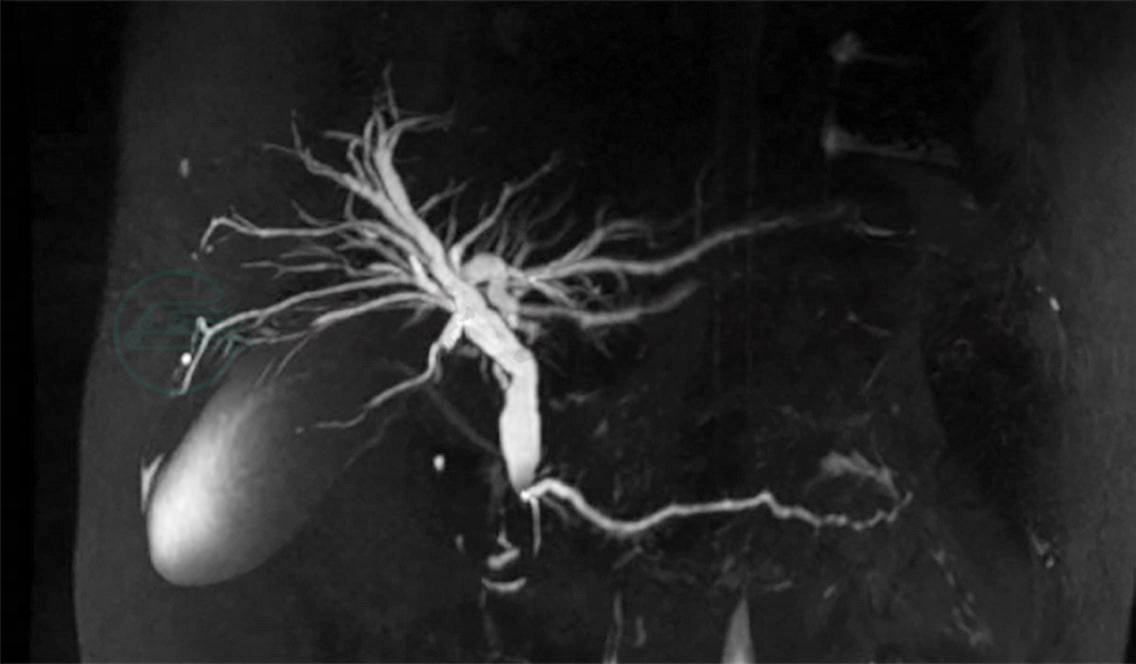
图2 磁共振胰胆管成像
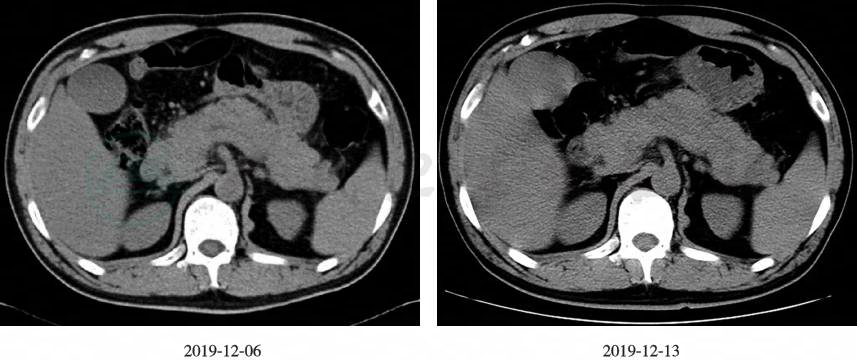
图3 上腹部CT
2019-12-15:胰腺磁共振(magnetic resonance,MR)平扫+增强(图4)示①胰腺异常改变,考虑急性坏死性胰腺炎可能性大,待结合临床诊断;②胰管轻度扩张;③扫及脂肪肝,肝内外胆管轻度扩张;④急性胆囊炎,胆囊少许沙砾样结石可能性大;⑤腹膜后、门腔间隙多发轻度肿大淋巴结。
2019-12-16:白蛋白38.7g/L,谷丙转氨酶306U/L,谷草转氨酶 158U/L,碱性磷酸酶589U/L,γ-谷氨酰转肽酶1725U/L,总胆红素179.6μmol/L,直接胆红素114.2μmol/L,间接胆红素65.4μmol/L,淀粉酶142U/L,脂肪酶2932U/L。
2019-12-17:C反应蛋白10.30mg/L。
结合上述入院后辅助检查结果,经抑制胰蛋白酶、抑制胰液分泌、禁食、抑酸、抗感染、保肝等处理,患者腹痛症状较前好转,淀粉酶下降,血常规及炎症指标好转,转氨酶较前下降,但住院期间胆红素呈进行性上升,完善MRCP及胰腺MR平扫+增强及上腹部CT,均未见明显胆总管结石证据,告知患者目前病情,建议其行诊断性ERCP进一步明确,但患者及其家属拒绝,予办理出院。后因黄疸仍未好转,患者再次入院。
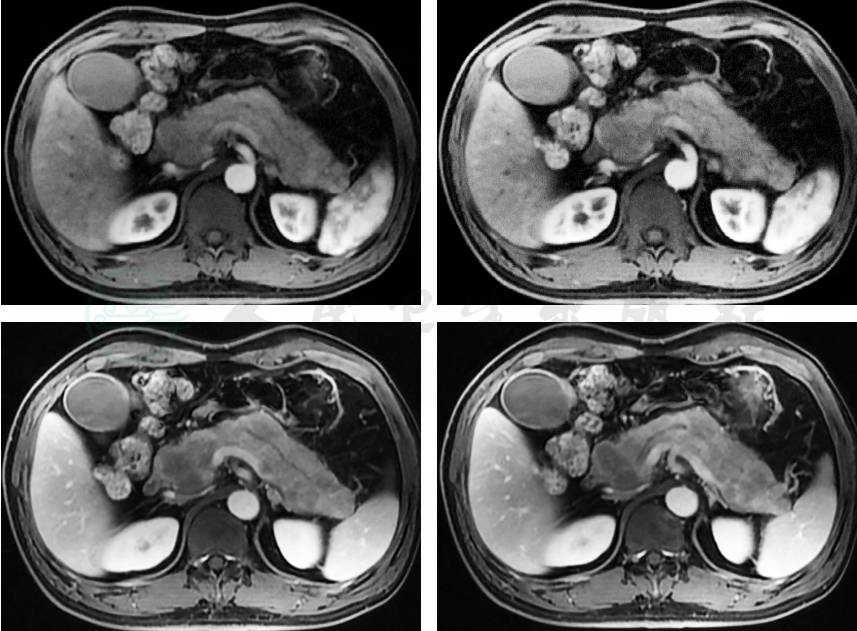
图4 胰腺MR平扫+增强(2019-12-15)
(2)第二次入院辅助检查
2019-12-23:脂肪酶3336U/L;大便隐血(单克隆法)阳性;谷草转氨酶160U/L,总胆固醇7.92mmol/L,甘油三酯4.38mmol/L,高密度脂蛋白胆固醇0.37mmol/L,乳酸脱氢酶256U/L;尿常规(干化学)+尿沉渣定量:比重1.034,尿蛋白(++),尿胆红素(+++),尿酮体(+);ABO血型为B型,Rh(D)血型阳性;血常规:白细胞计数7.99×109/L,中性粒细胞占比0.72,红细胞计数3.37×1012/L,血红蛋白100.0g/L,血小板计数374×109/L。
胃镜检查:见胃腔内大量暗红色血凝块。反复清洗及清理胃腔,于胃体中段前壁近大弯侧见一巨大隆起性病灶,表面溃疡形成,有活动性出血。予活检,并加1支去甲肾上腺素于盐水给予局部喷洒后,不见活动性出血后退镜。其余未见明显异常(图5)。送检活检组织镜下见侵袭性B细胞淋巴瘤(图6):肿瘤细胞中等大,核圆形,卵圆形可见小核仁,核分裂象多见,可见星空现象,结合免疫组化及荧光原位杂交(fluorescence in situ hybridization,FISH)检测结果,符合伯基特淋巴瘤(Burkitt lymphoma,BL),待结合临床诊断。免疫组化结果:肿瘤细胞分化簇(cluster of differentiation,CD)20、CD19、CD10、Bcl6阳性,Bc12部分弱阳性,C-myc约 85%阳性,Ki-67近100%阳性,CD3、CD5、MUM1、CyclinD1、CD30、ALJ、肌酸激酶(creatine kinase isomer,CK)、CD21阴性。原位杂交结果:EBER阴性。FISH检测结果:存在C-MYC基因断裂分离,不存在BCL-6、BCL-2基因断裂分离。
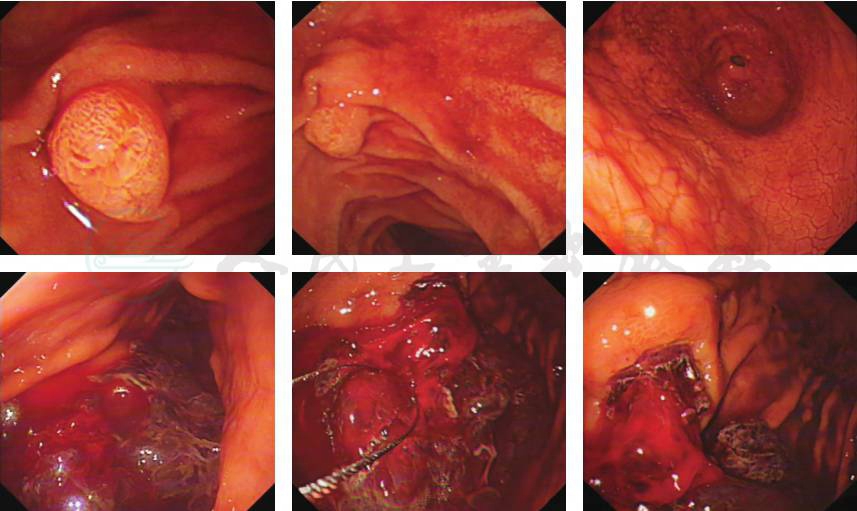
图5 胃镜检查
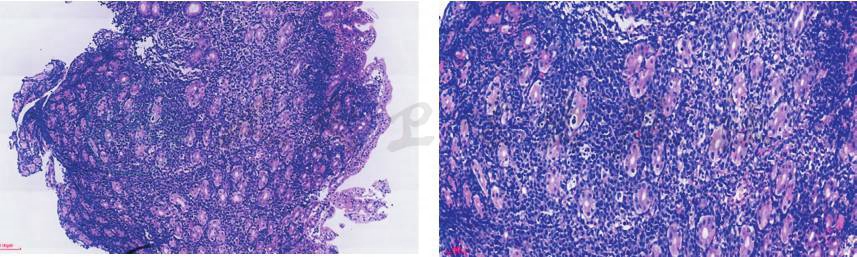
图6 胃组织活检病理结果(HE染色,50×)
2019-12-24:血红蛋白90.0g/L,血小板计数335×109/L。
2019-12-25:活化部分凝血活酶时间(activated partial prothrombin time,APTT)27.8s,纤维蛋白原5.22g/L;总蛋白51.3g/L,白蛋白31.8g/L,球蛋白19.5g/L,谷丙转氨酶136U/L,谷草转氨酶127U/L,碱性磷酸酶530U/L,γ-谷氨酰转肽酶1 167U/L,总胆红素212.2μmol/L,直接胆红素159.7μmol/L,间接胆红素52.5μmol/L,总胆汁酸239.7μmol/L,葡萄糖8.45mmol/L,钠131.1mmol/L,氯95.9mmol/L,钙2.09mmol/L。
2019-12-26:血氨55μmol/L;红细胞计数3.29×1012/L,血红蛋白97.0g/L,血细胞比容27.3%,血小板计数322×109/L;C反应蛋白26.25mg/L;急诊肝功能+电解质:白蛋白33.7g/L,钠123.0mmol/L,钙2.03mmol/L,氯87.6mmol/L,非结合胆红素28.5μmol/L,结合胆红素126.7μmol/L,总胆红素228.4μmol/L,谷丙转氨酶178U/L,谷草转氨酶155U/L,碱性磷酸酶631U/L,γ-谷氨酰转肽酶914U/L;肌钙蛋白I 0.001μg/L;凝血:纤维蛋白原5.85g/L;肌酸激酶(CK)同工酶MB质量测定正常。
2019-12-31:总蛋白57.4g/L,白蛋白29.6g/L,白球比例1.06,前白蛋白169mg/L,谷丙转氨酶123U/L,谷草转氨酶 68U/L,碱性磷酸酶805U/L,γ-谷氨酰转肽酶1311U/L,总胆红素241.4μmol/L,直接胆红素178.9μmol/L,间接胆红素62.5μmol/L,总胆汁酸242.1μmol/L,尿素1.9mmol/L,尿酸81μmol/L,葡萄糖10.67mmol/L,钠129.9mmol/L;IgG4 1.060g/L。
2020-01-01:白细胞计数10.73×109/L,中性粒细胞占比0.808,中性粒细胞绝对数8.67×109/L,血红蛋白105.0g/L,血小板计数583×109/L。EB病毒阴性。β2微球蛋白正常。骨髓象大致正常。骨髓病理:骨髓增生活跃(45%);粒细胞红细胞比值大致正常,中幼红细胞以下阶段为主;巨核细胞不少,分叶核;淋巴细胞、浆细胞、组织细胞散在;MF-0级。免疫组化:CD20(±)、PAX5(±)。送检骨髓活检组织未见肿瘤。
正电子发射计算机体层显像(positron emission tomography and computed tomography,PET/CT):①胃底、胃体、胰腺、小肠、全身骨骼多发高代谢病变,腹腔肠系膜数枚稍高代谢淋巴结,考虑恶性病变,淋巴瘤多器官浸润可能性大,需与胃癌多发转移鉴别,建议胃镜活检;②右侧上颌窦炎;③双肺散在慢性炎症及炎性结节可能,其中右肺上叶稍大结节灶,建议随访,除外转移;④肝内外胆管明显扩张,肝左叶肝内胆管小结石,胆泥淤滞;⑤体部其他部位18F-FDG PET/CT显像未见明显异常。
6.最终诊疗思维过程
(1)最终诊断思路
患者入院后,考虑急性胰腺炎诊断明确,给予抑酸、抑制胰液分泌、抑制胰蛋白酶、抗感染、补液等处理后患者腹痛好转,给予开放饮食,但胆红素仍进行性上升,胰腺及胆道影像学检查未见胆道结石证据,建议完善诊断性经内镜逆行胰胆管造影(endoscopic retrograde cholangio-pancreatography,ERCP)明确胆道情况,但患者一开始拒绝并办理出院。之后随访中,患者胆红素情况仍未改善,再次入院,入院当天排了一次黑色成形便,量约200g,第2天即完善ERCP。十二指肠镜进入过程中发现胃体可见大量血迹,反复冲洗后,可见胃体中段前壁近大弯侧见一巨大隆起性病灶,表面溃疡形成,可见活动性出血,给予活检,最终结合病理结果,考虑伯基特(Burkitt)淋巴瘤。
(2)最终诊断
伯基特淋巴瘤(ⅣB期,IPI=3分,中高危)合并出血,梗阻性黄疸、急性胰腺炎(轻型)。
(3)治疗方案
转血液科行R-DaEDOCH方案(美罗华、依托泊苷、长春地辛、多柔比星、地塞米松)化疗(本部分完稿时已行2个周期化疗,尚未进行疗效评估)。
1.本例患者以腹痛为首要表现,结合腹部影像学结果,提示胰腺渗出,考虑胰腺炎,后黄疸逐渐加深。其起病方式及临床表现均不是伯基特淋巴瘤的好发部位与常见临床表现,查体也未见腹腔肿块及浅表淋巴结肿大,具有一定的隐匿性。
2.伯基特淋巴瘤多发于青少年及儿童,在成年人中少见,且本例患者临床表现与实验室检查并无明确的指向性,故在疾病初期并没有考虑该病。
[1]AL-AKWAA AM,SIDDIQUI N,AL-MOFLEH IA.Primary gastric lymphoma[J].World J Gastroenterol,2004,10(1):5-11.
[2]EL-MALLAWANY NK,DAY N,AYELLO J,et al.Differential proteomic analysis of endemic and sporadic Epstein-Barr virus-positive and negative Burkitt lymphoma[J].Eur J Cancer,2015,51(1):92-100.
[3]MARUYAMA D,WATANABE T,MAESHIMA AM,et al.Modified cyclophosphamide,vincristine,doxorubicin,and methotrexate(CODOX-M)/ifosfamide,etoposide,and cytarabine(IVAC)therapy with or without rituximab in Japanese adult patients with Burkitt lymphoma(BL)and B cell lymphoma,unclassifiable,with features intermediate between diffuse large B cell lymphoma and BL[J].Int J Hematol,2010,92(5):732-743.
[4]JAFFE ES. The 2008 WHO classification of lymphomas:implications for clinical practice and translational research[J].Hematology Am Soc Hematol Educ Program,2009(1):523-531.
[5]BURMEISTER T,SCHWARTZ S,HORST HA,et al.Molecular heterogeneity of sporadic adult Burkitt-type leukemia/lymphoma as revealed by PCR and cytogenetics:correlation with morphology,immunology and clinical features[J].Leukemia,2005,19(8):1391-1398.
[6]MBULAITEYE SM,BIGGAR RJ,BHATIA K,et al.Sporadic childhood Burkitt lymphoma incidence in the United States during 1992-2005[J].Pediatr Blood Cancer,2009,53(3):366-370.
[7]BOERMA EG,VAN IMHOFF GW,APPEL IM,et al.Gender and age-related differences in Burkitt lymphoma--epidemiological and clinical data from The Netherlands[J].Eur J Cancer,2004,40(18):2781-2787.
[8]REN G,CHENG A,REDDY V,et al.Three-dimensional fold of the human AQP1 water channel determined at 4 A resolution by electron crystallography of two-dimensional crystals embedded in ice[J].J Mol Biol,2000,301(2):369-387.













