 幼年特发性关节炎(JIA)反复发热,治疗过程中出现肝损伤和全血细胞减少,进展为肝衰竭。
幼年特发性关节炎(JIA)反复发热,治疗过程中出现肝损伤和全血细胞减少,进展为肝衰竭。
 CRP升高、铁蛋白升高、纤维蛋白原下降、全血细胞减少、血sCD25升高、NK细胞活性降低及反复骨髓穿刺后发现噬血现象。
CRP升高、铁蛋白升高、纤维蛋白原下降、全血细胞减少、血sCD25升高、NK细胞活性降低及反复骨髓穿刺后发现噬血现象。
 3次血浆置换效果不佳,应用糖皮质激素、依托泊苷、环孢素及丙种球蛋白治疗有效,预后好。
3次血浆置换效果不佳,应用糖皮质激素、依托泊苷、环孢素及丙种球蛋白治疗有效,预后好。
患者,男,16岁,主诉“间断发热、关节肿痛4个半月,皮肤巩膜黄染2周”入院。
患者4个半月前无明显诱因出现反复发热,体温最高39℃,伴多关节肿痛,累及左肘、双腕和双膝,曾有一过性背部淡红色片状皮疹。外院完善多种病原学检查均为阴性,ANA 1∶320~1∶100,外周血白细胞升高,最高15.77×109/L,ESR最高117mm/h,CRP最高150mg/dl,ALT、GGT、ALP轻度升高,铁蛋白571ng/ml。外院间断给予多种抗生素、抗病毒治疗无效,曾加用地塞米松1.5mg qd口服5天及洛索洛芬钠治疗后体温恢复正常,停用地塞米松后再次出现发热,最高39.5℃,症状基本同前。入院后完善相关检查无感染证据,骨髓形态学检查、骨髓活检、WT1基因无异常,胸部CT、腹部超声、超声心动图均无异常,诊断为幼年特发性关节炎全身型,给予甲泼尼龙40mg qd治疗后体温正常,关节肿痛缓解,炎性指标显著下降(ESR 40mm/h,CRP26.2mg/L),改为泼尼松50mg qd+10mg qn治疗,改用口服激素当日出院,出院再次发热,夜间为主,静脉滴注头孢类抗生素无好转,间断服用多种退热药物(布洛芬缓释胶囊、洛索洛芬钠和酚麻美敏等),体温仍间断升高。
2周前复查发现肝损伤,谷丙转氨酶346U/L,谷草转氨酶97U/L,总胆红素53.7μmol/L,结合胆红素22.4μmol/L,转肽酶688U/L,予保肝治疗转氨酶无下降,并出现巩膜及皮肤黄染,再次入院。
既往史:体健。家族史:父亲患强直性脊柱炎。
皮肤巩膜黄染;脾大,肋下2指;肝大,肋下2指;胆囊点压痛,余查体无异常。
血常规:白细胞升高(最高24×109/L),血红蛋白正常,血小板减低,最低8×109/L。肝功能:转氨酶及胆红素进行性升高(谷丙转氨酶最高1112U/L,谷草转氨酶最高1130U/L,总胆红素最高310.1mol/L,结合胆红素最高242.8mmol/L),甘油三酯升高,C反应蛋白107mg/dl,铁蛋白显著升高(14050ng/ml),纤维蛋白原(最低149mg/dl)、凝血酶原活动度进行性下降(PTA最低40%),多种病原学相关检查阴性,血培养阴性。
骨髓穿刺(第2次):骨髓形态学检查未见异常,免疫分型未见异常,WT1基因及PRAME基因阴性,骨髓活检提示增生性改变。第3次骨髓穿刺找到噬血细胞(图1)。NK细胞活性降低(13.5%,参考值为15.11%~26.91%),sCD25 29009.4pg/ml(正常<6400pg/ml)。
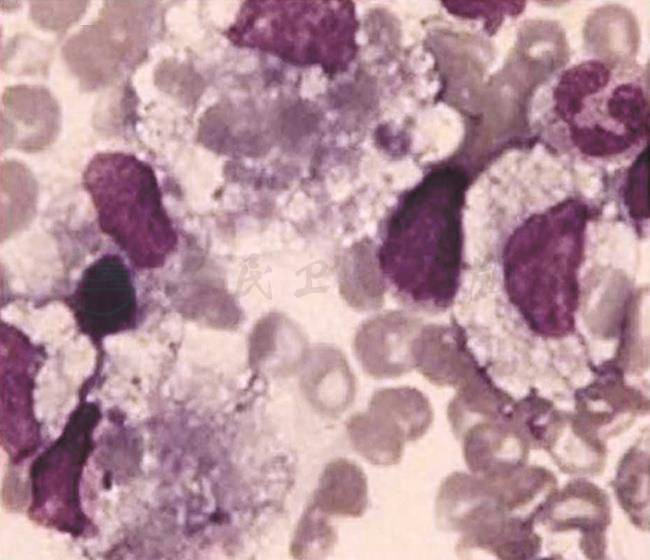
图1 为治疗前骨髓形态学检查,可见噬血现象
引自:主编:.风湿免疫性疾病疑难病例解析.第1版.ISBN:978-7-117-28376-2
超声心动图及肺部CT无异常,PET-CT未见肿瘤征象,腹部CT提示胆囊水肿、肝大及脾大。
1.幼年特发性关节炎
2.巨噬细胞活化综合征
给予甲泼尼龙40mg qd静脉滴注+泼尼松10mg qn口服、保肝利胆及抗感染等治疗,体温有所控制,结合肝损伤、血小板下降、凝血异常、血脂升高、NK细胞活性下降及可溶性CD25升高,诊断为噬血细胞综合征、亚急性肝衰竭,积极给予输注血浆、血小板及纤维蛋白原,患者体温仍然不能控制,甲泼尼龙加量至80mg q12h、加用丙种球蛋白20g qd输注、并进行3次血浆置换,经过上述治疗后凝血逐渐改善,血小板逐渐上升,总胆红素及转氨酶下降不明显,治疗过程中出现白细胞减少。
此时进行第3次骨髓穿刺,发现噬血现象(见图1),加用依托泊苷化疗2次,环孢素100mg q12h,转氨酶、胆红素逐渐下降,化疗后近2周患者持续粒细胞缺乏状态,血CMV-DNA拷贝数增高,暂停依托泊苷化疗,予预防细菌、真菌及抗病毒感染后好转,后血象逐渐改善、铁蛋白逐渐下降,依托泊苷改为口服,每2周1次,根据血药浓度调整环孢素剂量,糖皮质激素逐渐减量,随访至今。
自首次化疗至今治疗共1年半,泼尼松减量为5mg qd维持,环孢素减量为75mg qd(血药浓度维持在150ng/ml左右),复查血常规、肝功能、凝血、铁蛋白、CRP及红细胞沉降率全部恢复正常,骨髓形态学未见噬血现象(图2),目前继续随访中。
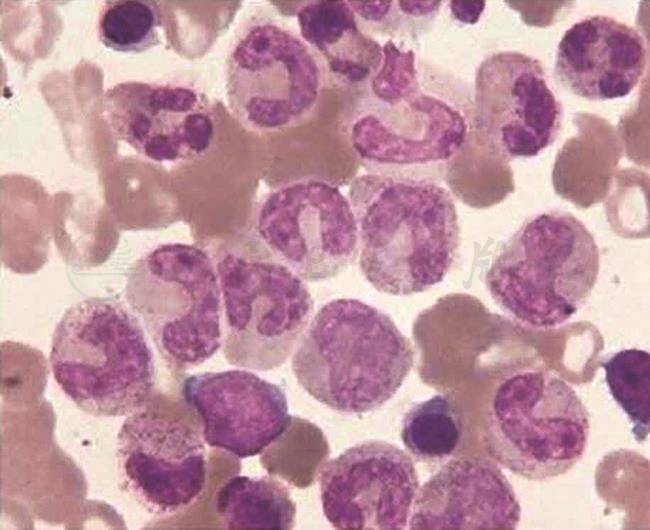
图2 为治疗后复查,骨髓形态学检查未见噬血细胞
引自:主编:.风湿免疫性疾病疑难病例解析.第1版.ISBN:978-7-117-28376-2
噬血细胞综合征(hemophagocytic syndrome,HPS)又称噬血细胞性淋巴组织细胞增多症(HLH),是由多种潜在病变引起淋巴细胞和组织细胞非恶性增生,产生细胞因子风暴所导致的一种临床综合征。根据发病原因的不同,HPS分为原发性HPS和获得性HPS两大类。原发性HPS常见于2岁以内儿童,多伴有常染色体或性染色体遗传。获得性HPS多见于成人,常继发于感染、恶性肿瘤、风湿性疾病和器官移植术后等,其中风湿性疾病相关HPS也称为巨噬细胞活化综合征(macrophage activation syndrome,MAS),儿童最常并发于全身型幼年特发性关节炎,成人中主要见于系统性红斑狼疮(SLE)、成人斯蒂尔病,其他包括类风湿关节炎、干燥综合征及系统性硬化症等也可发生。风湿病相关HPS的确切发病机制尚未完全明确,多发生在疾病早期或活动期,诱发因素包括风湿病活动、继发感染或者与用药有关包括使用免疫抑制剂、阿司匹林、非甾体类抗炎药物及生物制剂的使用,均是HPS的高危因素。
该病例中患者16岁前发病,关节炎、反复发热、皮疹,无感染及肿瘤证据,诊为幼年特发性关节炎全身型,经全身应用糖皮质激素治疗效果欠佳,反复发热,炎性指标包括红细胞沉降率、C反应蛋白及铁蛋白进行性升高,并出现严重肝损伤,最终因NK细胞活性下降、血清中可溶性CD25升高及反复骨髓穿刺最终找到噬血细胞而确诊继发HPS。其危险因素包括JIA活动期、治疗过程中曾使用多种非甾体抗炎药物。
风湿病继发HPS目前缺乏统一的诊断标准,在确诊原发病的基础上主要依据HLH-2004诊断标准,分类标准中的8条指标符合5条即可诊断。2016年发表在Arthritis & Rheumatology上的sJIA并发MAS的新分类标准如下:确诊或疑似sJIA的发热患者,符合以下标准可以诊断为MAS:①铁蛋白>684ng/ml;②血小板≤181×109/L;③谷草转氨酶>48U/L;④甘油三酯>156mg/dl;⑤纤维蛋白原≤360mg/dl。诊断条件:①为必备条件,②~⑤满足任意两条或两条以上。实验室数据异常需排除伴发免疫介导的血小板减少症、传染性肝炎、内脏利什曼病或者家族性高脂血症等疾病。
该例患者治疗过程中反复发热,应用糖皮质激素反复不能控制体温,后来出现肝大、脾大、肝衰竭、炎性指标包括C反应蛋白及红细胞沉降率进行性升高、铁蛋白进行性升高(14050ng/ml),但此时患者骨髓穿刺仍未发现噬血细胞,最终经3次骨髓穿刺才发现噬血细胞。因此针对该患者,骨髓穿刺找到噬血细胞对于诊断并非早期敏感指标,而反复发热及铁蛋白升高在患者出现血象异常及严重凝血功能异常之前即已出现,因而临床上若出现不能用其他原因解释的铁蛋白升高、反复发热及肝功能损伤时,应警惕噬血细胞综合征的可能。
继发性噬血细胞综合征的治疗目前无统一的治疗方案,缺乏随机对照研究,主要参考原发性噬血细胞综合征的治疗。主要治疗包括去除诱因治疗原发病、支持治疗及免疫抑制治疗。免疫抑制治疗包括应用糖皮质激素、环孢素(抑制T细胞)及依托泊苷(细胞毒药物,抑制单核巨噬细胞系统,促进细胞凋亡),若出现神经系统症状,可用地塞米松联合甲氨蝶呤鞘内注射,丙种球蛋白是重要的辅助治疗。前8周为诱导期,8周后是否需要继续针对噬血治疗取决于原发病。
风湿病继发者还可根据原发病应用生物制剂。有文献认为在血清铁蛋白达到高峰2天内使用丙种球蛋白是预测其疗效的指标。该患者病程中出现亚急性肝衰竭,肝酶及胆红素升高,血小板下降,凝血酶原活动度为40%,符合亚急性肝衰竭,在积极应用糖皮质激素、丙种球蛋白的同时,进行了3次血浆置换,有效改善了凝血功能,血小板上升,为之后应用依托泊苷进行化疗及环孢素治疗创造了时机。
在治疗过程中值得注意的是:①噬血细胞综合征出现肝酶升高并非化疗及应用环孢素的禁忌,在除外其他原因引起肝损伤的情况下考虑为噬血相关,应尽早化疗及应用环孢素治疗。该患者在化疗后1周肝酶及铁蛋白即逐渐下降。②依托泊苷化疗后可出现粒细胞缺乏期,需要积极防控感染,应用预防感染药物尤其是机会性感染包括巨细胞病毒、真菌等,若条件允许可考虑住层流间。
噬血细胞综合征没有统一的缓解标准,主要依靠实验室指标的改善,红细胞沉降率、C反应蛋白、铁蛋白是监测疗效及复发的敏感指标。噬血细胞综合征的死亡率为41%,肿瘤继发者预后差,风湿病继发噬血细胞综合征预后良好。诊断时的年龄及血小板减少是预测死亡的因素。该患者诊断时16岁,为风湿病继发HPS,为其预后的有利因素。该患者随访至目前,仍继续应用环孢素、糖皮质激素,随访期间未出现感染及化疗相关不良反应,目前血象、肝酶、铁蛋白、C反应蛋白及红细胞沉降率全部恢复正常。
本例启示
 风湿病继发巨噬细胞活化综合征不少见,儿童患者以幼年特发性关节炎多见。
风湿病继发巨噬细胞活化综合征不少见,儿童患者以幼年特发性关节炎多见。
 反复发热、铁蛋白进行性升高、肝损伤者需高度警惕巨噬细胞活化综合征。
反复发热、铁蛋白进行性升高、肝损伤者需高度警惕巨噬细胞活化综合征。
 风湿病继发巨噬细胞活化综合征,预后良好。
风湿病继发巨噬细胞活化综合征,预后良好。
(姚海红)













