 中年女性,慢性病程。
中年女性,慢性病程。
 以反复口腔溃疡和一过性外阴溃疡为主要临床表现,近期出现鼻塞及明显消耗症状。
以反复口腔溃疡和一过性外阴溃疡为主要临床表现,近期出现鼻塞及明显消耗症状。
 近期化验检查提示严重贫血及血小板减少、血EBV-DNA阳性及多种EBV抗体阳性。
近期化验检查提示严重贫血及血小板减少、血EBV-DNA阳性及多种EBV抗体阳性。
 病程后期出现发热、纤维蛋白原减低、铁蛋白明显升高、血清sCD25升高及NK细胞活性减低,骨髓涂片见噬血现象。
病程后期出现发热、纤维蛋白原减低、铁蛋白明显升高、血清sCD25升高及NK细胞活性减低,骨髓涂片见噬血现象。
患者,女,42岁,主因“反复口腔溃疡5年、一过性外阴溃疡2年,鼻塞半个月”入院。
5年前患者无明显诱因出现口腔溃疡,每次数个,溃疡面可见白苔,疼痛明显,服用中药(具体不详)后可愈合。
2年前患者无明显诱因出现咽喉疼痛,疼痛明显时进食较少,其间曾出现一次外阴溃疡,中心凹陷伴疼痛,服用中药2天后基本愈合,无关节肿痛、皮疹。于我院门诊查CRP 92mg/L、ESR 83mm/h,考虑“白塞病可能”,继续自行服用上述药物治疗。此后口腔溃疡间断发作,劳累、受凉后易出现,最多时3~5次/年。患者坚持服用中药,服药时有效,但停药后口腔溃疡可再次出现。
半年前患者再次出现口腔溃疡,疼痛明显,进食减少,自服布洛芬缓释胶囊(芬必得)及消炎药治疗无明显好转,于我院门诊耳鼻喉科就诊,予头孢曲松钠静脉滴注,5~7天一疗程,每次间隔2~3天,持续使用2~3个月,口腔溃疡有减轻。
2个月前患者劳累后口腔溃疡加重,伴咽喉疼痛,只能进食少许流质饮食,我科门诊予加用泼尼松30mg qd、艾拉莫德25mg bid口服,服药10天后因口腔溃疡控制欠佳,泼尼松加量至40mg qd。患者服用艾拉莫德2周后因吞咽疼痛自行停用,半个多月前激素减量至泼尼松35mg qd,并予沙利度胺50mg qn(每晚1次)口服,沙利度胺服用2天后出现颜面及眼睑红肿,考虑过敏予停用,停药1周后颜面及眼睑肿胀稍减退。
半个月前患者泼尼松减到30mg qd口服维持,自觉左侧鼻腔阻塞感明显,于我院眼科及耳鼻喉科就诊,考虑“结膜炎”“左侧鼻腔肿物伴积液”,予抗生素滴眼液、呋麻滴鼻液及莫西沙星0.4g qd静脉滴注治疗共10天,颜面及眼睑肿胀减轻,左侧鼻塞未见明显好转,伴黄白色积液流出。耳鼻喉科随诊考虑肿物表面糟脆感,建议活检明确性质但存在出血风险,患者不同意活检。
1周前患者全身乏力,不能行走,四肢皮肤出现散在瘀斑。后患者出现咳嗽、咳黄绿痰,左侧鼻腔可见棕色液体混有血丝,无发热。我院急诊就诊查血常规Hb 49g/L,PLT 76×109/L,鼻窦CT示左侧上颌窦、筛窦、蝶窦及鼻道内病变。给予甲泼尼龙20mg qd静脉滴注、莫西沙星抗感染、输注红细胞及营养支持等治疗,为进一步诊治收入我科。患者体重近半年减轻20kg。
既往史、个人史、家族史:先天右肾缺失。20年前患者因“右鼻窦囊肿”行“开放术”(具体不详)。10多年前患者无明显诱因出现右眼视力减退、疼痛,考虑“多发性后极部鳞状上皮细胞病变”,曾予激素口服治疗约半年,不定期行右眼球后复方倍他米松注射,注射后视力可暂时好转;激素应用期间腿部出现“疱疹”一次(具体不详)。G3P1(第二次流产为自然流产,具体月份不详。人工流产一次)。
T 37.3℃、BP 150/96mmHg,营养不良,慢性病面容,情绪低落。四肢皮肤可见散在瘀斑,双侧视力下降,左侧鼻窦阻塞,可见黄色分泌物伴血丝,无压痛。口腔内可见2个溃疡面,0.2cm×0.5cm,表面有黄灰色分泌物,右侧扁桃体Ⅰ度肿大。心肺未见明显异常。
外周血涂片:成熟红细胞大小不等,可见畸形红细胞,未见异常淋巴细胞或破碎红细胞。生化:ALT 42U/L、GGT 50U/L、其余基本正常。凝血检查:D-dimer 1022ng/ml、FDP 9.7μg/ml、余正常。
贫血相关检测:血清铁3.55μmol/L↓,总铁结合力49.79μmol/L↓,铁蛋白334.4ng/ml↑,维生素B12和叶酸正常,甲状腺功能符合低T3综合征。免疫相关:ESR 17mm/h、CRP 29.50mg/L、IgG 5.9g/L↓,ANA、抗ENA抗体、抗dsDNA抗体、抗磷脂抗体、ANCA、抗内皮细胞抗体(AECA)、补体、RF均阴性。
肿瘤标志物:CA125 57.30U/ml↑、CA15-3 27.50U/ml↑、骨胶素CYFRA21-1 3.33ng/ml↑。副肿瘤综合征相关检查:CV2/CRMP5、PNMA2、Ri、Yo、Hu、Amphiphysin 均阴性。感染相关检查:乙肝、丙肝、梅毒、HIV、T-SPOT.TB、血CMV-DNA、G试验均阴性,血EBV-DNA 2.29×104copies/ml↑;鼻腔分泌物涂片+染色:G+球菌成对偶见;痰涂片+染色:G+球菌成对偶见,痰培养经鉴定生长正常菌群。
骨髓相关检查:骨髓涂片见骨髓增生Ⅲ级、粒红比1.63∶1;红系:原红以下可见,中晚幼红比值偏高,红细胞大小不等,可见核间桥、核出芽、花瓣红、双核红。成熟红细胞大小不等,可见棘形红细胞、靶形红细胞、破碎红细胞。可见单核细胞、浆细胞、吞噬细胞,可见噬血现象。
流式细胞学:淋巴细胞占5.62%,CD7+淋巴细胞占88.66%;髓细胞占76.34%,比例正常,CD10+成熟粒细胞比例偏低(12.15%),CD11b−早期髓细胞比例增高(23.1%);单核细胞占5.67%,比例正常,CD36dim+;有核红细胞占12.73%,比例增高,CD36和CD71表达减低,表型异常;CD34+CD117+幼稚髓细胞占0.15%,比例正常,其中0.26%细胞CD33−CD34st+CD38−,表型异常;CD34+细胞中CD19+B细胞占1.25%,比例减低。红系表型异常,可疑MDS。骨髓活检:造血组织红系、粒系灶状增生。红系原、早以下各阶段细胞散在或成堆可见。粒系前体细胞可见,中、晚以下各阶段细胞散在或可见小堆。巨核细胞偶见。淋巴细胞、嗜酸细胞、成纤维细胞可见。Gomori:+~++。
基因检测:WT1、PRAME、EV1表达正常,CALR基因、JAK2-617位点V/F突变检测阴性。G显带:46,XX[20]。
胸部X线、心电图、妇科彩超、乳腺彩超未见明显异常。
超声心动图:少量心包积液。
腹部CT:食管周围及腹膜后多发肿大淋巴结。
鼻窦CT:双侧上颌窦、筛窦、蝶窦内黏膜增厚;右侧上颌窦腔内可见高密度影,CT值约10~20Hu;左侧上颌窦、部分筛窦、蝶窦、左侧鼻道内可见软组织影,CT值约35~45Hu;左侧上颌窦、筛窦骨质吸收略变薄,双侧窦口鼻道复合体及左侧鼻道堵塞,左侧上鼻甲、中鼻甲骨质吸收。鼻中隔左偏。印象:①鼻窦炎症;②左侧上颌窦、筛窦、蝶窦、鼻道内病变,应鉴别炎性息肉或其他占位性病变(图1)。
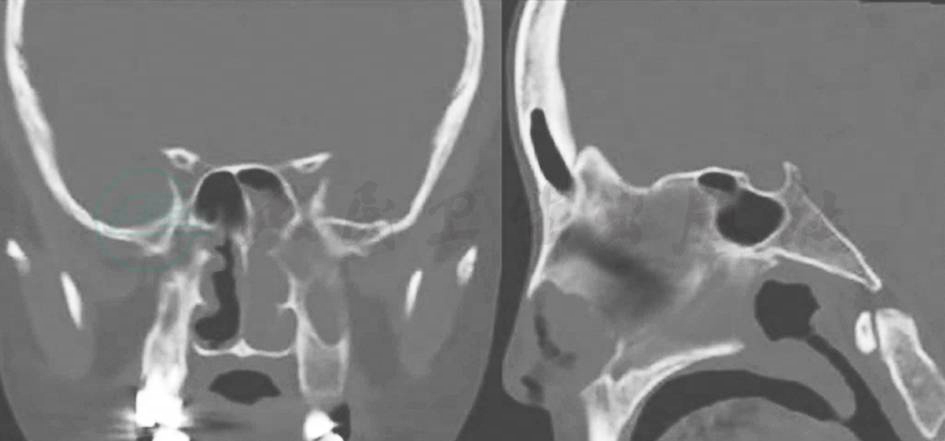
图1 鼻窦CT(左侧上颌窦、筛窦、蝶窦和鼻道内病变)
引自:主编:.风湿免疫性疾病疑难病例解析.第1版.ISBN:978-7-117-28376-2
针对患者的临床表现及实验室检查异常,我们的鉴别诊断主要集中在以下几种疾病:
1.白塞病(BD)
①支持点:反复口腔溃疡、外阴溃疡、眼炎,多发性后极部鳞状上皮细胞病变是一种脉络膜病变;②不支持点:严重贫血+血小板减少、鼻咽部占位、四肢皮下瘀斑及严重的消耗症状。
2.肉芽肿性多血管炎(GPA)
①支持点:口腔溃疡、鼻咽部占位;②不支持点:无下呼吸道、肾脏受累,ANCA阴性。
3.系统性红斑狼疮(SLE)
①支持点:口腔溃疡、贫血+血小板减少、心包积液;②不支持点:鼻咽部占位、无自身抗体阳性。
4.骨髓增生异常综合征(MDS)
①支持点:贫血+血小板减少、骨髓涂片及流式细胞术有红系病态造血提示;②不支持点:骨髓染色体核型、基因表达谱及点突变分析均无异常。
5.肿瘤
①支持点:鼻咽部占位、消耗症状明显;②不支持点:慢性病程无法完全用肿瘤解释。
入院后考虑到系统性血管炎可能性大,在与患者及家属充分沟通后给予甲泼尼龙20mg qd静脉滴注治疗。患者的口咽部症状无明显好转,鼻腔肿物处间断少量出血。并于入院1周后出现发热,体温最高38.7℃,血培养回报阴性,加用广谱抗生素治疗无效。其间监测血象,血红蛋白及血小板呈进行性下降趋势。为明确鼻咽部占位性质,再次建议患者完善鼻咽部肿物活检。患者因顾虑血小板少、出血风险高拒绝。
患者10年前曾经出现视力下降,我院诊断“多发性后极部鳞状上皮细胞病变(APMPPE)”,激素治疗有效。APMPPE由Gass等学者于1968年首先报道,病毒感染可能为首要致病因素,其机制可能为以病毒为抗原所致的免疫性反应引起全身某些血管的病变(如脉络膜毛细血管炎症性阻塞),从而影响视网膜色素上皮层的正常功能。此外,既往亦曾有GPA相关APMPPE的报道。结合本例患者口腔溃疡、鼻咽部肿物和血EBV-DNA阳性,主要需鉴别GPA和病毒感染两方面。再次向患者及家属反复询问病史得知:10多年前患者自觉易“感冒”而外院就诊,检查发现EB病毒IgM抗体阳性,EBV-DNA情况不详。此后患者先后接受更昔洛韦抗病毒、血浆置换等多种治疗。
我们的思路逐渐清晰:患者存在EBV感染、发热、贫血及血小板减少的加重、骨髓中可见噬血现象,尽快完善噬血细胞综合征的相关检查,结果显示sCD25活性>44000pg/ml↑,NK细胞活性减低,复查FIB-c持续降低≤1.5g/L、血清铁蛋白2473ng/ml。EBV抗体回报:EBNA IgG、IgA,VCA IgA、IgG(+)。
至此,患者的诊断基本明确:慢性活动性EB病毒感染(CAEBV)、噬血细胞综合征。参照原发性噬血细胞综合征(HLH)-2004治疗方案,予患者加用地塞米松+环孢素A(CsA)方案,因其血小板严重减低暂未加用依托泊苷(VP),同时联合IVIG及间断输注血浆及抗生素的治疗。而针对CAEBV,目前仍然缺乏规范而有效的治疗方案,很少有彻底根治的病例。抗病毒治疗、CD20单抗等都未被证实存在确切的治疗作用。CAEBV治疗原则应为重建机体对EB病毒的有效免疫,彻底消除被EB病毒感染或克隆增殖的淋巴细胞。因此输注自体或供体EB病毒特异性T细胞或造血干细胞移植应为有前景的治疗。但因此患者已出现噬血细胞综合征,鼻咽部占位为肿瘤的可能性极大,干细胞移植已非合适时机。
患者最终因弥散性血管内凝血(DIC)、多脏器衰竭(MODS)去世。
本病例十分复杂,诊治过程曲折,经后期多项补充检查及鉴别最终确诊:慢性活动性EB病毒感染;噬血细胞综合征;弥散性血管内凝血;多脏器衰竭。
在最初接诊这位患者时,她留给我们几个突出的印象:中年女性、慢性病程,整个病程中最突出的特点是反复的口腔溃疡,曾经有过一次明确的外阴溃疡。10年前曾经有过一次单侧眼的视力问题,我院眼科诊断“APMPPE”。“口-眼-生殖器”这一受累部位的组合,CRP、ESR升高提示的炎症反应,我们首先想到的还是患者在门诊最初的诊断——“白塞病”。但患者似乎还有诸多问题用这一诊断无法很好解释:①患者近2个月来病情发展迅速,很快出现全身乏力、无力行走、消瘦明显,这仅仅是免疫病的炎症消耗症状,还是另有他因?②1周来患者的不适发展到最高峰,这时血常规发现的严重贫血和血小板减少怎么解释?③近期发现的左侧鼻腔内肿物是什么性质?④除此以外,我们对患者最突出的一个印象,是其叙述病史时的自怨自艾——“活过这多半辈子净看病了”和病史叙述时的敷衍——“我太累了,差不多就这些吧”。这让我们对患者病史叙述的完整程度产生了一定程度的质疑。
基于以上病史,我们主要从系统性血管炎包括白塞病(BD)和肉芽肿性多血管炎(GPA)、结缔组织病[主要是系统性红斑狼疮(SLE)]、感染、血液病及肿瘤几方面对患者进行了筛查。最终剥茧抽丝得到了CAEBV的诊断。
EB病毒(即Epstein-Barr病毒)属于疱疹病毒γ亚科,1964年由Epstein、Archong和Barr首次在建立的伯基特淋巴瘤细胞株中发现。该病毒通过唾液传播,在免疫功能正常的个体,原发感染EB病毒在口咽上皮细胞复制,最后潜伏在B淋巴细胞,可无症状或出现传染性单核细胞增多症,具有自限性,数周后症状减轻直至消失。个别情况下,EB病毒感染后可出现慢性或复发性传染性单核细胞增多症症状,伴随EB病毒抗体异常改变,称为慢性活动性EB病毒感染(CAEBV)。目前认为该病是一种易发展为淋巴瘤、鼻咽癌、病毒相关噬血细胞综合征、间质性肺炎、中枢神经系统病变,进而发展为多脏器衰竭的淋巴组织增生性疾病。CAEBV的诊断标准有1988年的Straus标准及在此基础上由美国国立健康研究所修订的标准。主要包括以下几部分:
1.下述情况持续6个月以上
(1)从EB病毒原发感染开始,症状持续。
(2)EB病毒抗体滴度异常:抗VCA-IgG≥1∶5120、抗EA抗体≥1∶640或EBNA抗体<1∶2。
2.主要脏器受损的组织学标志
(1)淋巴结炎
(2)噬血现象
(3)脑膜脑炎
(4)持续性肝炎
(5)脾大
(6)间质性肺炎
(7)骨髓增生不良
(8)视网膜炎
3.证实受损组织或外周血中EB病毒数量增多
(1)受损组织中EB病毒DNA、EB病毒RNA或蛋白增多。
(2)外周血中EB病毒DNA水平增高。
诊断CAEBV需满足上述每一项中的至少一条,并排除任何已知的免疫功能低下包括HIV感染。如果用CAEBV来解释,患者的很多临床表现就可以说得通了。而MDS的诊断必须排除其他可引起血细胞减少及病态造血的克隆性或非克隆性造血系统与非造血系统疾病,其中包括病毒感染(HCV、HIV、CMV、EBV及其他)。这样来看,患者的骨髓用EB病毒而非MDS解释更加合适。
这个病例相对曲折、复杂,最大的遗憾是未能得到鼻咽部占位的病理结果。即使我们反复建议家属完善尸检,最终家属还是选择拒绝。回头来看,在这例患者的诊治过程中,如果早期获得鼻咽部占位的活检,既可以进一步排除肉芽肿性病变等其他病因,也可明确是否为CAEBV导致的鼻咽癌或鼻咽部NK/T淋巴瘤。那么是否有可能通过早期的放、化疗,避免肿瘤的进展,甚至避免肿瘤导致的噬血细胞综合征?这些值得我们深思。
本例启示
 感染及肿瘤可模拟血管炎(包括白塞病)表现,临床中需注意鉴别。
感染及肿瘤可模拟血管炎(包括白塞病)表现,临床中需注意鉴别。
 注意那些一元论不好解释的蛛丝马迹。
注意那些一元论不好解释的蛛丝马迹。
 挖掘隐藏的病史。
挖掘隐藏的病史。
 风湿科医师应跳出风湿病的局限,不要让它限制你的思考及病因的找寻。
风湿科医师应跳出风湿病的局限,不要让它限制你的思考及病因的找寻。
(杨月 陈适)













