 青年女性,慢性病程。
青年女性,慢性病程。
 以反复右上腹痛、腹胀伴发热为主要临床表现。
以反复右上腹痛、腹胀伴发热为主要临床表现。
 化验检查提示间断血小板减少、抗磷脂抗体阳性,腹部增强CT提示肝脏梗死灶、门脉高压、胸腹水及肾上腺梗死后出血。
化验检查提示间断血小板减少、抗磷脂抗体阳性,腹部增强CT提示肝脏梗死灶、门脉高压、胸腹水及肾上腺梗死后出血。
 腹部超声及下腔静脉DSA最终确诊Budd-Chiari综合征。
腹部超声及下腔静脉DSA最终确诊Budd-Chiari综合征。
患者,女,30岁,主因“右上腹痛8个月余,腹胀4个月余”入院。
患者8个多月前以右上腹痛起病,当地医院查血小板(PLT)95×109/L,腹部超声提示“胆囊炎”。予头孢哌酮舒巴坦、奥硝唑抗感染治疗中突发腹痛加重伴发热,复查血常规PLT 57×109/L,余两系未见明显异常。胸片提示“左侧少量胸腔积液”、上腹部磁共振示“肝周及肝缘新发异常信号影,脓肿形成?”。予亚胺培南西司他汀等抗感染治疗,并予人血丙种球蛋白25g qd×7d,体温降至正常、血小板升至148×109/L。复查上腹部磁共振提示“肝内异常信号影较前好转,新发胸腹腔少量积液”,予出院。后患者间断复查血小板、肝功能均未见异常。
4个月前患者为备孕于当地医院行胆囊切除术,入院时PLT 111×109/L、腹部增强CT示“肝S5、S6、S7段多发低回声灶,较前好转,未见胸腹腔积液”,遂行腹腔镜胆囊切除术。术后4天患者自觉腹胀明显,复查腹部CT平扫提示“大量腹水、少量胸腔积液,肝叶比例失调”(因未行增强扫描,肝脏内异常密度影显示欠清),予对症放腹水治疗。4天后患者出现发热,体温最高达38.5℃,伴寒战,复查血常规:WBC 15.19×109/L、Ne 89%、PLT 17×109/L。生化:ALT 544U/L、AST 511U/L、TBil 58μmol/L、DBil 27μmol/L、Alb 30g/L,CRP 273.1ng/ml、红细胞沉降率98mm/h、D-dimer 18 610ng/dl,腹水培养提示“阴沟肠杆菌”。予亚胺培南西司他汀、万古霉素抗感染治疗后,患者体温可降至正常,但复查血小板降低至3×109/L,血EBV-DNA 8.82×105/L、铁蛋白>2000ng/ml、D-dimer 52 960ng/ml、纤维蛋白原升高,复查腹部CT提示“大量胸腔积液、腹水,肝右叶低密度灶较前明显增多、双侧肾上腺增大并出血”。予人血丙种球蛋白20g qd×3d,并间断予血浆、血小板、白蛋白输注(输血前予地塞米松抗过敏),同时予亚胺培南西司他汀、万古霉素、伏立康唑、替加环素抗感染治疗。复查患者血小板逐渐恢复至91×109/L、胸腔积液和腹水减少,其间曾多次行胸腔积液穿刺,符合渗出液,腹水属门静脉高压性腹水;骨髓穿刺提示产板型巨核细胞减少,肝穿刺检查(低密度灶处)提示“纤维素样坏死渗出物及少许肝组织”。但此后监测患者血小板再次逐步降至59×109/L,胸腔积液和腹水再次增多。查ANA 1∶100,抗ENA抗体谱、抗dsDNA抗体均阴性。予甲泼尼龙40mg×4d、人血丙种球蛋白10g×4d治疗,血小板回升至106×109/L,胸腔积液和腹水明显减少。
1个月前,患者腹胀较前明显加重,复查腹部超声提示腹水明显增多,复查 PLT 52×109/L,ESR 18mm/h、D-dimer 7370ng/dl,ANA 1∶320,抗dsDNA抗体、抗ENA抗体、抗核小体抗体均阴性,补体C3、C4降低。
20天前患者再次出现发热,体温最高39℃,伴畏寒、寒战,同时出现气短、憋气及腹胀加重,复查胸片及腹部超声提示胸腔积液和腹水明显增多,同时伴随血小板快速下降、白蛋白下降等表现。外院考虑“系统性红斑狼疮”诊断,遂加用甲泼尼龙80mg qd、丙种球蛋白20g×5d、白蛋白10g/d静脉滴注治疗,同时予美罗培南抗感染。患者体温降至正常后未再升高。此后复查血小板升至90×109/L。胸腔积液基本消失,但仍需间断放腹水缓解腹胀症状。
既往史、个人史、家族史无特殊情况。
生命体征平稳,心肺查体正常,腹膨隆,全腹无压痛、反跳痛,移动性浊音阳性,双下肢无可凹性水肿。
血常规:PLT 84×109/L。尿便常规、肝肾功能、电解质、心肌损伤标志物正常。凝血:纤维蛋白原143mg/ml。骨穿刺除血小板偏少外大致正常。免疫相关:ANA 1∶320,抗ENA抗体、抗 dsDNA 抗体阴性,C3、C4减低,Coombs试验(+++),狼疮抗凝血因子试验(LAC)1.33,β2糖蛋白I(β2-GPI)180.95RU/ml,抗心磷脂抗体(ACL)89.2U/ml。
感染、肿瘤相关:腹水淡黄清亮,SAAG 11.1g/L,细菌培养阴性。血清肿瘤标志物未见异常。
超声心动图:大致正常。
胸部CT:双肺散在肺膨胀不全,双侧胸腔积液和腹水。
腹盆增强CT(图1):肝脏S5、S6、S7段边缘多发低强化灶,呈楔形及条片状,考虑缺血、坏死及纤维形成修复所造成可能性大;肝静脉、门静脉增宽伴侧支循环形成,脾静脉增宽,肝硬化可能性大;肝脏Glisson鞘增厚;肾上腺未见明显异常,大量腹水;子宫双附件正常,未见明确肿瘤性改变。
腹部超声:①Budd-Chiari综合征:下腔静脉入右心处梗阻、肝静脉出口膜性病变;②肝大,少~中量腹水;③双侧少量胸腔积液。
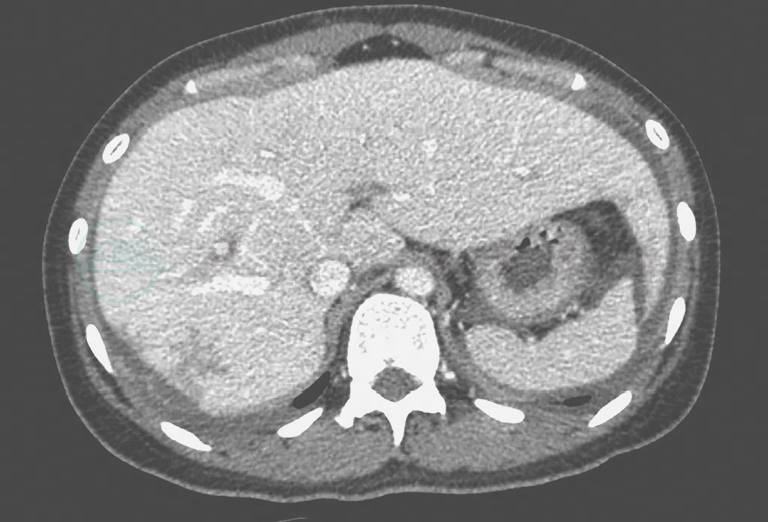
图1 腹盆增强CT
引自:主编:.风湿免疫性疾病疑难病例解析.第1版.ISBN:978-7-117-28376-2
1.抗磷脂综合征
Budd-Chiari综合征
门静脉高压、腹水
球囊扩张术后
肝脏梗死灶
肾上腺梗死后出血
血小板减少
2.系统性红斑狼疮不除外
患者为青年女性,慢性病程,以右上腹痛伴发热起病,抗生素联合人丙种球蛋白治疗有效。腹腔镜胆囊切除术后再次反复出现腹胀、发热,化验提示血小板减少、转氨酶明显升高,影像学提示肝脏多发异常信号,伴胸腔积液、腹水,其间腹水培养阳性。抗感染治疗后血小板减少,胸腔积液、腹水均未见明显好转。此后查ANA高滴度,加用激素治疗有效。结合以上临床表现、化验及检查异常,入院后从风湿免疫病包括系统性红斑狼疮及抗磷脂综合征、肝胆系统感染及腹盆肿瘤三方面进行筛查。以上检查结果可基本除外感染及肿瘤。
患者LAC、β2GPI及ACL水平明显升高,复习患者外院腹部增强CT,除肝脏低密度灶外,还可见到双侧肾上腺增大,伴腺体内高密度区,不伴增强,提示出血可能。综上考虑抗磷脂综合征(APS),肝脏梗死灶、肾上腺梗死后出血、血小板减少诊断基本明确。而患者反复发热后期激素治疗有效、在病初即出现左侧胸腔积液,伴抗核抗体高滴度阳性、抗磷脂抗体阳性、补体降低及Coombs试验强阳性,考虑系统性红斑狼疮(SLE)不除外。予患者甲泼尼龙1mg/kg qd静脉滴注、羟氯喹200mg bid口服,同时联合低分子肝素序贯华法林抗凝治疗。
然而难以解释的是,虽然患者腹部CT并未提示肝静脉或门静脉内血栓形成,但患者存在门静脉增宽伴侧支循环形成及脾静脉增宽,而肝硬化影像学表现并不典型,提示门静脉高压继发于肝硬化的可能性不大;而患者同时存在肝静脉的增宽,提示肝前性门静脉高压可能性大。为进一步寻找肝前性门静脉高压的病因,完善腹部超声检查,发现下腔静脉入右心处梗阻、肝静脉出口膜性病变。完善血管造影,肝上段下腔静脉近右心房开口可见重度狭窄(图2)。术中诊断“肝上段下腔静脉狭窄”,予球囊扩张术治疗,复查血流通畅。最终诊断“Budd-Chiari综合征、球囊扩张术后”。
2周后复查PLT 138×109/L,胸腔积液、腹水完全消失,复查腹部B超示肝静脉血流恢复。
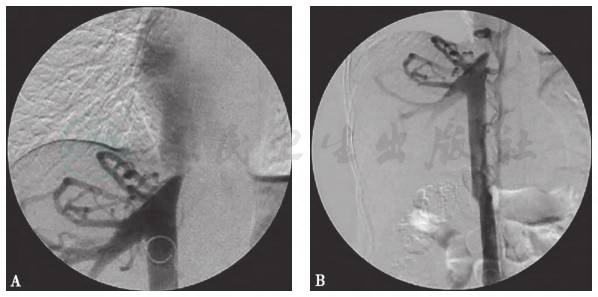
图2 下腔静脉DSA
A:球囊扩张术前;B:球囊扩张术后
引自:主编:.风湿免疫性疾病疑难病例解析.第1版.ISBN:978-7-117-28376-2
APS是一种以反复血栓事件、自发性流产等为主要临床表现,伴抗磷脂抗体阳性的非炎症性自身免疫性疾病。全身各个系统均可受累,肝脏受累可表现为Budd-Chiari综合征、肝窦阻塞综合征、肝梗死、肝结节状再生及肝硬化等。在本例患者中,可同时见到Budd-Chiari综合征及肝梗死表现。
Budd-Chiari综合征是一类肝静脉流出道梗阻疾病的总称。静脉梗阻可发生在肝静脉至下腔静脉汇入右心处之间的任意部位。根据静脉阻塞的程度及发展速度,可表现为无症状至危及生命。临床表现主要为腹痛(61%)、腹水(83%)及肝大(67%)。常见危险因素包括骨髓增殖性疾病、口服避孕药应用等。在APS中其发病率约为0.7%,合并Budd-Chiari综合征的APS患者常伴有ACL阳性。
本患者B超可见肝静脉出口膜性病变而考虑Budd-Chiari综合征诊断。膜性梗阻可为先天解剖异常,也可由血栓机化所致。本患者考虑为APS血栓形成后机化遗留膜性病变。
本例病例诊断的难点,即在于下腔静脉膜性病变的诊断。超声诊断敏感性在50%以上,对于0.4cm以上较厚隔膜,超声即可显示;而对于较薄隔膜由于超声的脱落现象而无法显示,但可通过下腔增宽、浮动性消失及局部狭窄环推断膜结构的存在。而CT对此类疾病的诊断意义不大。本患者病程中曾反复完善CT检查而未见明确梗阻表现,最终通过腹部B超得到确诊。这提示我们对于临床中高度怀疑Budd-Chiari综合征时不能仅靠CT除外诊断。
此外,APS还可出现不常见部位如肾上腺、肾脏等处的血栓形成。肾上腺供血的解剖结构较为特殊,由三条动脉及仅有的一条中央静脉组成。中央静脉肌层纤维素可产生较大的血流阻力。因此,任何导致肾上腺静脉压力升高的因素,均可导致毛细血管的压力负荷增加,进而引起血管破裂出血。多种易栓症包括APS导致肾上腺静脉血栓形成,即容易继发梗死后出血。患者可出现肾上腺功能不全的表现,少数有肾上腺危象。影像学CT、MRI有助于诊断。回顾患者病初外院影像学检查,考虑同时存在肾上腺梗死后出血,因未出现明确肾上腺皮质功能减退的临床表现,故而未被重视。
治疗方面,Budd-Chiari综合征需放置支架或行血管成形术解除梗阻。若效果不佳即门静脉压力持续存在时,可采用经颈内静脉肝内门体分流术(transjugular intrahepatic portosystemic stent,TIPS),若仍无效则需肝移植治疗。抗凝方面,无论从Budd-Chiari综合征(合并或不合并APS)或从已发生血栓的APS方面来看均需要抗凝治疗。本患者经球囊扩张术后腹水消退,肝静脉压力减低,出院后长期华法林维持。
本例启示
 APS肝脏受累可表现为Budd-Chiari综合征、肝窦阻塞综合征、肝梗死、肝结节状再生和肝硬化等;APS导致Budd-Chiari综合征机制为血栓形成后机化遗留膜性病变。
APS肝脏受累可表现为Budd-Chiari综合征、肝窦阻塞综合征、肝梗死、肝结节状再生和肝硬化等;APS导致Budd-Chiari综合征机制为血栓形成后机化遗留膜性病变。
 APS合并Budd-Chiari综合征的诊断难点在于下腔静脉膜性病变的诊断,超声诊断敏感性优于CT,在临床中高度怀疑Budd-Chiari综合征时不能仅靠CT除外诊断。
APS合并Budd-Chiari综合征的诊断难点在于下腔静脉膜性病变的诊断,超声诊断敏感性优于CT,在临床中高度怀疑Budd-Chiari综合征时不能仅靠CT除外诊断。
 APS的血栓可出现于肾上腺,但非常少见,可出现梗死后出血,表现为肾上腺功能不全或无明显临床症状。
APS的血栓可出现于肾上腺,但非常少见,可出现梗死后出血,表现为肾上腺功能不全或无明显临床症状。
(张新羽 杨月)













