(一)病例信息
【病史】
女性患者,50岁,因“夜间睡眠时打鼾伴晨起头痛15年余,加重伴双下肢水肿2年”,于2007年5月15日入院。患者15余年前开始出现夜间睡眠时打鼾,鼾声不均匀。据家人描述,患者夜间睡眠中有呼吸暂停现象,伴梦多,无憋醒,无梦语、梦游,无甩动肢体、拍打同床人等睡眠异常动作。患者晨起头痛、口干,10多分钟后可缓解。近2年,患者上述症状加重,伴双下肢水肿,未予诊治。近半年,患者日间嗜睡明显,伴有明显记忆力减退、疲乏无力,睡眠后不能解乏,但无活动后气短表现。1个月前,患者于外院行多导睡眠监测,诊断为睡眠呼吸暂停低通气综合征,为进一步诊治入院。
患者患乙型肝炎20余年;慢性咳嗽、咳痰多年;患高血压病2年,最高230/110mmHg,服药血压可控制在正常范围内;双下肢静脉曲张病史10余年;吸烟30年,40支/天。
【体格检查】
体温36.5℃,心率68次/分,呼吸18次/分,血压110/70mmHg,BMI 32.7kg/m2(体重87kg,身高1.63m)。神志清楚,对答准确。口唇轻度发绀,球结膜水肿;双肺叩诊清音,未闻干湿啰音;心界不大,心律齐,各瓣膜听诊区未闻病理性杂音;腹部检查无异常;小腿部皮肤可见浅静脉曲张迂曲,双下肢见可凹性水肿,右下肢较重;无杵状指(趾)。
【实验室检查】
入院即刻血气分析:pH 7.34,PaCO2 63mmHg,PaO233mmHg,HCO3- 34mmol/L,SaO2 75%。
血常规:Hb 192g/L,Hct 56%。
血生化:ALT 52U/L,Cr 61μmol/L。
血沉:29mm/1h。
【其他辅助检查】
胸部CT:未见肺内异常。
肺功能检查:FEV1/FVC 79.42%,FEV1 64.5%预计值。
多导睡眠监测(polysomnography,PSG)(2007年5月24日):呼吸紊乱指数(apnea hyponea index,AHI)37次/小时,最长呼吸暂停156秒,最低SpO2 30%,平均SpO2 76.0%(图1~图3)。
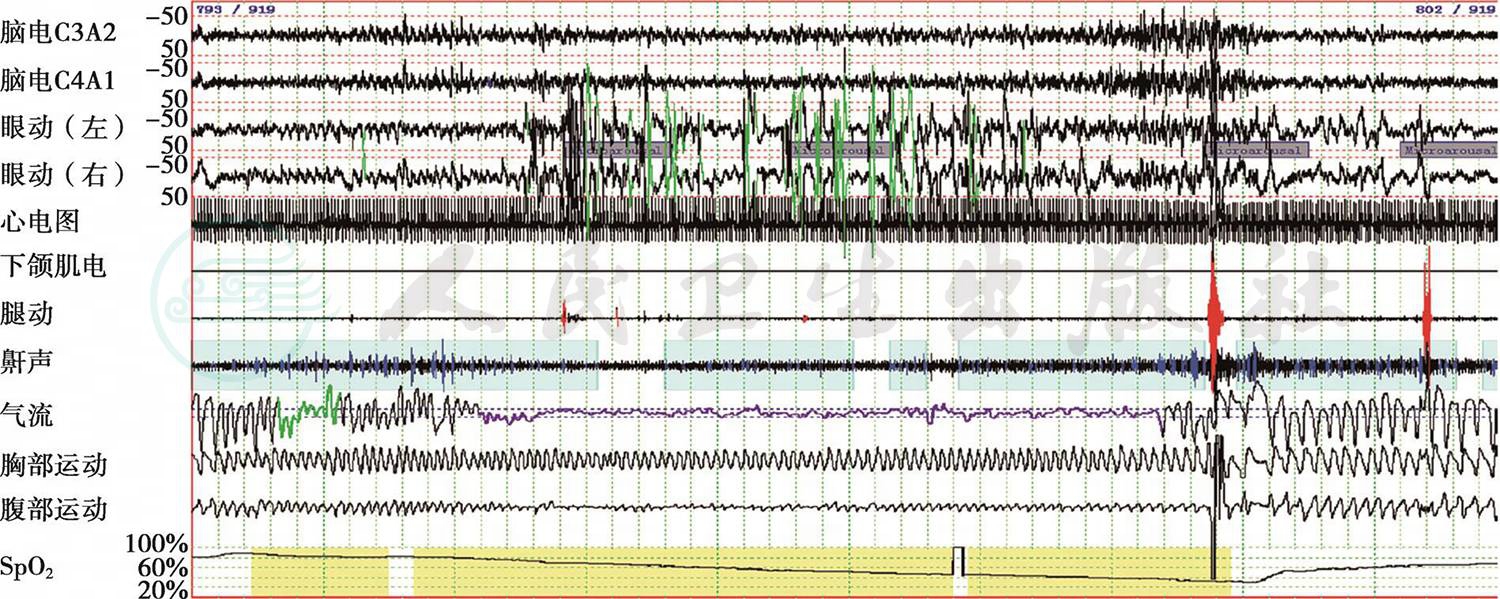
图1 REM睡眠期多导睡眠监测截图(5分钟/屏)
患者在快速眼球运动(rapid eye movement,REM)睡眠期出现较长时间呼吸暂停(气流曲线中紫色部分)和频繁低通气(气流曲线中绿色部分),并存在与之相应的脉搏血氧饱和度(SpO2)下降(SpO2曲线中黄色部分)
引自:主编:.呼吸系统疑难病例诊疗辨析.第1版.ISBN:978-7-117-26415-0
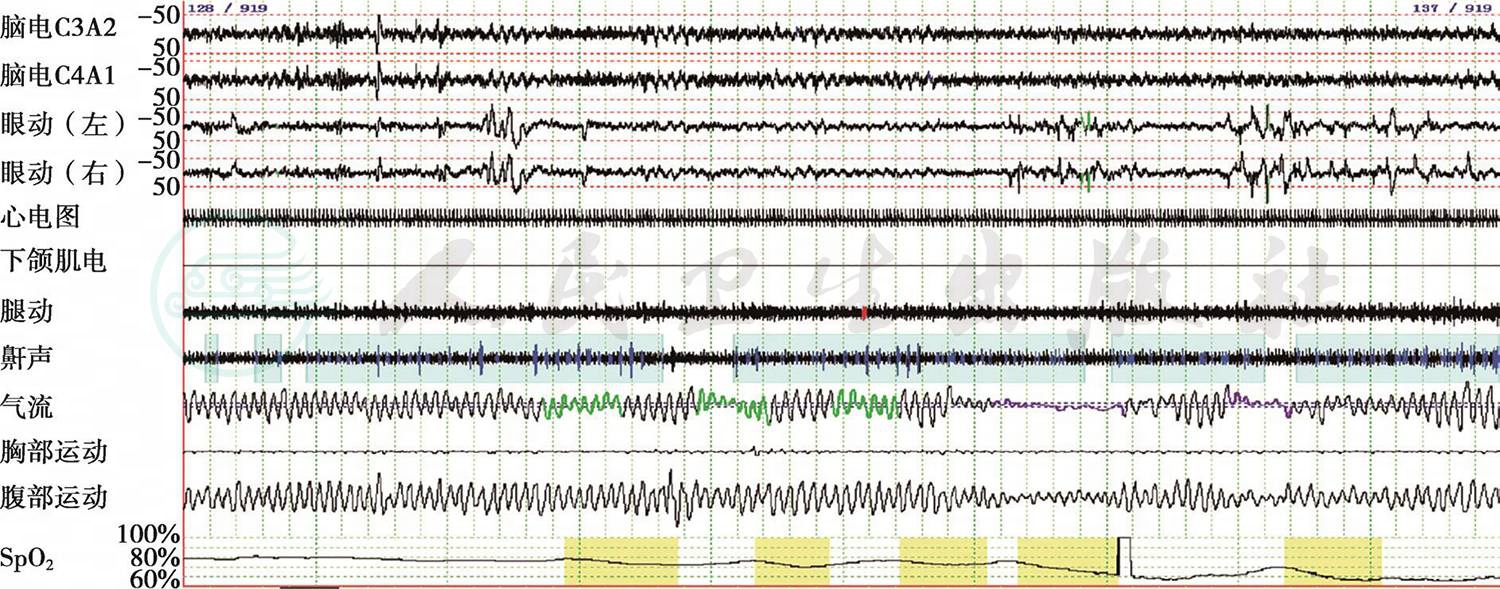
图2 non-REM睡眠期多导睡眠监测截图(5分钟/屏)
患者在非快速眼球运动(non-REM)睡眠期也有频繁低通气(气流曲线中绿色部分),并存在与之相应的脉搏血氧饱和度(SpO2)下降(SpO2曲线中黄色部分)
引自:主编:.呼吸系统疑难病例诊疗辨析.第1版.ISBN:978-7-117-26415-0
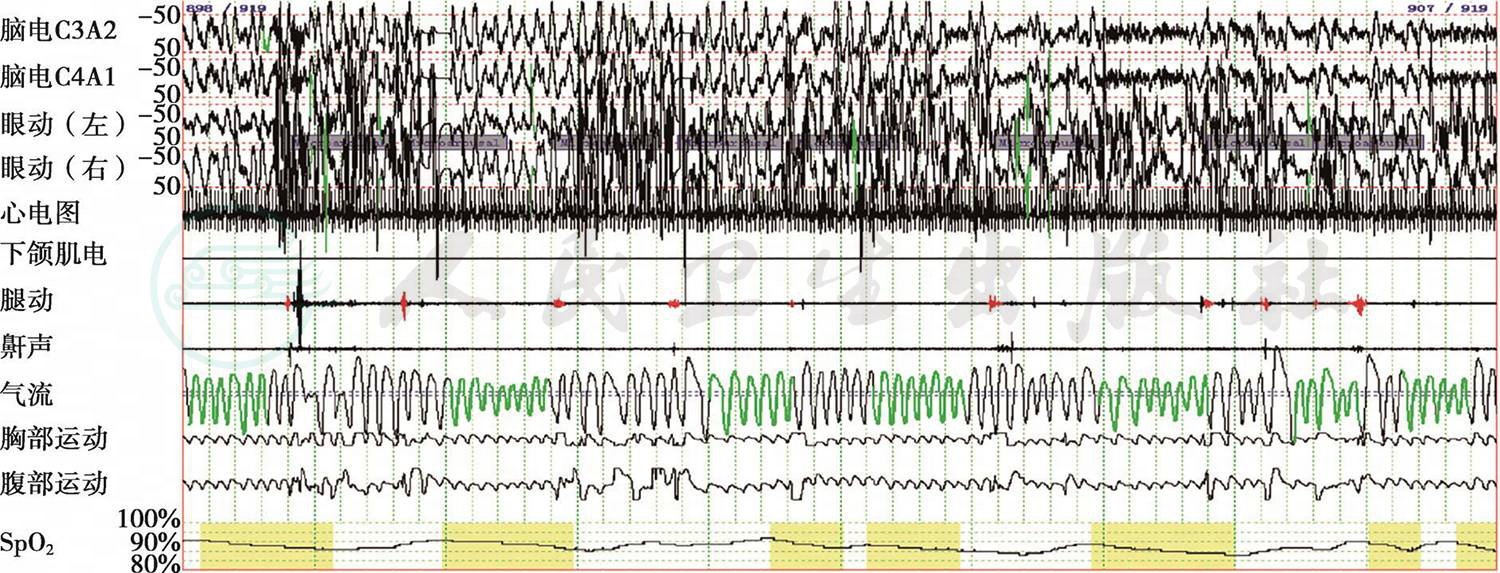
图3 清醒时多导睡眠监测截图(5分钟/屏)
患者在清醒时呼吸不规则,呼吸幅度深浅不一,类似低通气(气流曲线中绿色部分),并存在与之相应的脉搏血氧饱和度(SpO2)下降(SpO2曲线中黄色部分)
引自:主编:.呼吸系统疑难病例诊疗辨析.第1版.ISBN:978-7-117-26415-0
(二)临床思辨
【临床特点】
1.患者为中老年女性,呈慢性病程。
2.主要症状和体征为打鼾、白天嗜睡,晨起头痛,但活动后无明显气短;体形肥胖;口唇轻度发绀,球结膜水肿。双肺、心脏和腹部查体未见异常。双下肢水肿。
3.实验室检查显示外周血红细胞增多,血气分析提示Ⅱ型呼吸衰竭。
4.PSG显示中度睡眠呼吸暂停低通气综合征合并重度低氧血症。
【思辨要点】
慢性呼吸衰竭是各种原因导致通气和换气障碍而形成的较为严重的临床综合征,多由于胸肺部慢性疾病所引起,也可以由肺外因素引起。其常见症状和体征包括呼吸困难、发绀以及与原发病相关的症状和体征。
检查发现,本例患者存在慢性Ⅱ型呼吸衰竭、血气紊乱,但没有明显呼吸困难。出现这种情况的原因可能是什么?
慢性Ⅱ型呼吸衰竭是慢性肺泡低通气发展的严重临床结局,动脉血CO2分压(PaCO2)是反映肺泡通气量大小的可靠指标。PaCO2超过45mmHg即表示存在肺泡低通气。当PaCO2达到50~70mmHg时,与其相伴的低氧血症可导致红细胞增多、肺动脉高压、肺心病、呼吸衰竭等一系列病理生理改变及临床症状,称为肺泡低通气综合征。很多原因可通过影响呼吸控制系统的一个或数个环节致肺泡低通气(表1、表2)。
表1 引起慢性肺泡低通气的可能病因
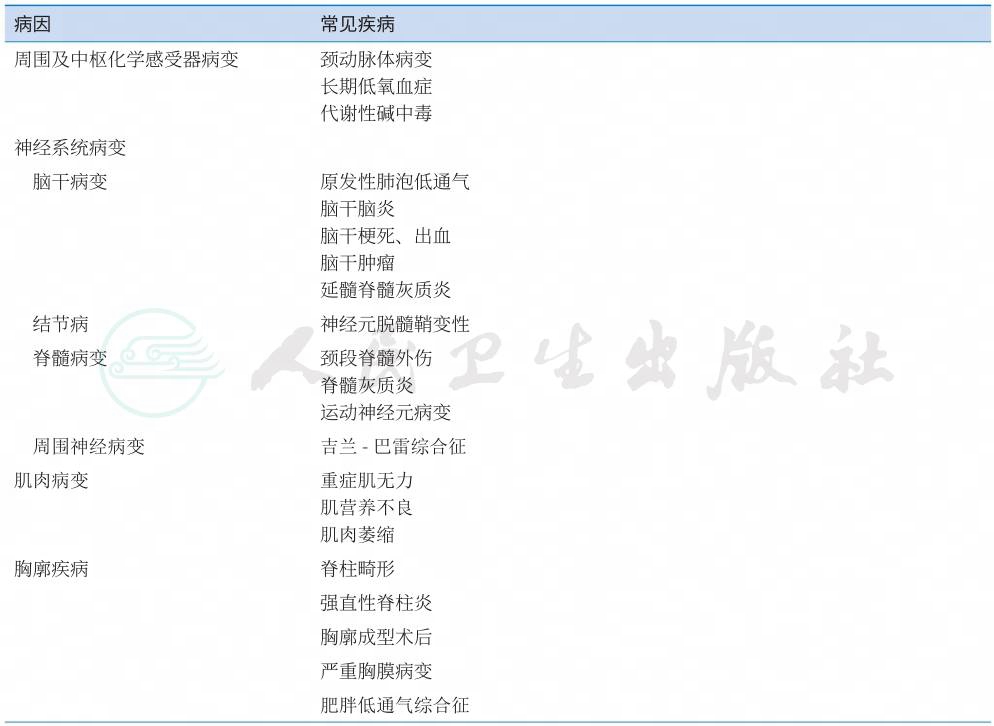
续表

表2 慢性肺泡低通气发生机制
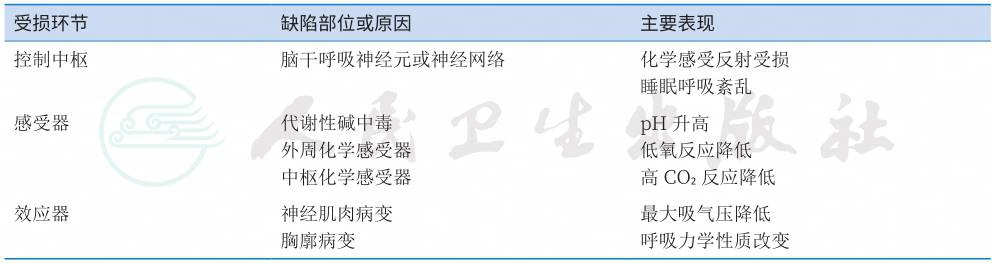
受损环节 缺陷部位或原因 主要表现 |
控制中枢 脑干呼吸神经元或神经网络 化学感受反射受损 睡眠呼吸紊乱 感受器 代谢性碱中毒 外周化学感受器 中枢化学感受器 pH升高 低氧反应降低 高CO2反应降低 效应器 神经肌肉病变 胸廓病变 最大吸气压降低 呼吸力学性质改变 |
引自:主编:.呼吸系统疑难病例诊疗辨析.第1版.ISBN:978-7-117-26415-0
肺泡低通气可根据发生机制分为三类:①脑干功能或器质性病变可引起呼吸节律改变,尤以睡眠状态下显著,此类患者称为“不愿呼吸者”;②呼吸效应系统受损时,经有意识过度呼吸仍不能达到正常通气量,称为“不能呼吸者”;③原发性代谢性碱中毒者的低通气属代谢性控制系统正常代偿,故称“不应呼吸者”。
对于本例患者,根据病史和体格检查结果,可以排除肌肉疾病和胸廓疾病。患者有大量吸烟史,有可能发生慢阻肺所致呼吸衰竭,但肺功能检查提示患者存在较轻程度气流阻塞,胸部CT仅提示局限性肺气肿,因此不能单纯以慢阻肺解释慢性呼吸衰竭的原因。患者常年打鼾,白天嗜睡伴晨起头痛,且两次PSG均提示重度睡眠呼吸暂停低通气综合征合并重度低氧血症。睡眠呼吸暂停低通气综合征有可能导致慢性Ⅱ型呼吸衰竭。患者体形肥胖、白天嗜睡并且存在肺泡通气不足、水肿和打鼾、睡眠呼吸紊乱,符合典型的肥胖型睡眠呼吸暂停表现。Hb、Hct和HCO3-显著升高提示存在慢性呼吸功能不全。夜间睡眠呼吸暂停引起慢性间歇性缺氧,与高碳酸血症及睡眠剥夺相互作用,使得患者白天呼吸调节钝化。如此恶性循环,使得呼吸中枢反应性下降,导致患者白天出现低通气,进而发生慢性呼吸衰竭。
通气不足的一个主要症状是呼吸困难或气短,初期只在活动时出现,逐渐发展到静息状态下亦可发生,尤其是以呼吸控制系统效应器病变为主的“不能呼吸者”表现明显,而以化学感受器敏感性降低为主的“不愿呼吸者”的气短症状并不明显。
综上所述,对于自觉无明显呼吸困难,血气分析提示慢性呼吸衰竭,特别是Ⅱ型呼吸衰竭者,应全面鉴别引起慢性肺泡低通气的各类病因,需考虑化学感受器敏感性下降或呼吸中枢功能不良导致的“不愿呼吸者”。
(一)临床信息
【治疗过程】
采取无创呼吸机治疗后(双水平正压通气,夜间吸氧1L/min,吸气压26cmH2O,呼气压8cmH2O),患者夜间鼾声消失,双下肢水肿消失,夜间平均SpO2为86.5%,最低SpO2 70%。复查白天动脉血气分析显示,pH 7.35,PaCO2 57mmHg,PaO2 44mmHg,HCO3 31.5mmol/L,SaO2 77%。
自主过度通气试验发现,患者进行连续4~5次深大呼吸后脉搏血氧饱和度明显升高,可以达到97%以上,而恢复平静呼吸时脉搏血氧饱和度再度下降至88%左右(图4),运动后的脉搏血氧饱和度亦有明显升高。
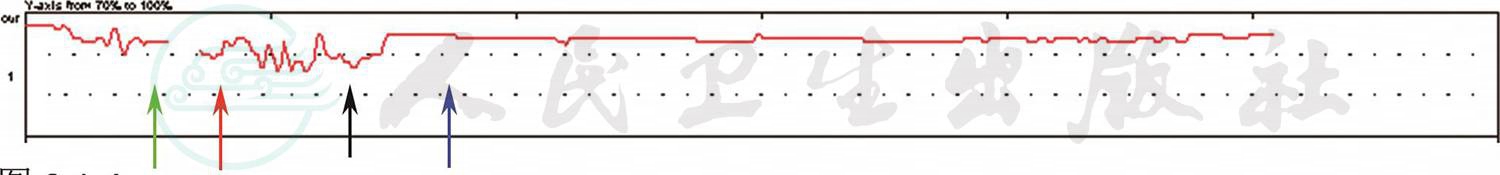
图4 吸氧、自主过度通气试验和给予双水平正压通气时的脉搏血氧饱和度变化
绿色箭头为吸氧,红色箭头为未吸氧平静呼吸,黑色箭头为过度通气,蓝色箭头之后为佩戴BiPAP呼吸机。脉搏血氧饱和度曲线持续时间为50分钟,本图显示曲线为1小时间期
引自:主编:.呼吸系统疑难病例诊疗辨析.第1版.ISBN:978-7-117-26415-0
应用重复呼吸法进行低氧、高二氧化碳通气反应性测定,结果显示患者两项指标均明显低于正常人群。经过 2 周以上双水平正压通气(bi-level positive airway pressure ventilation,BiPAP)呼吸机治疗,患者低氧、高二氧化碳通气反应性均未见明显改善(表3)。
表3 患者BiPAP治疗前后低氧、高二氧化碳通气反应性
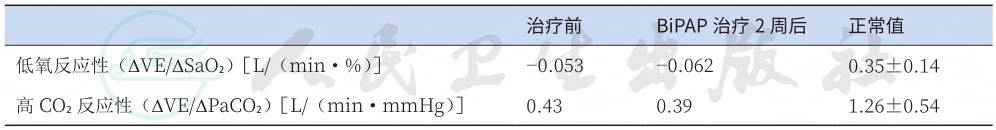
治疗前 BiPAP治疗2周后 正常值 |
低氧反应性(ΔVE/ΔSaO2)[L/(min·%)] -0.053 -0.062 0.35±0.14 高 CO2反应性(ΔVE/ΔPaCO2)[L/(min·mmHg)] 0.43 0.39 1.26±0.54 |
引自:主编:.呼吸系统疑难病例诊疗辨析.第1版.ISBN:978-7-117-26415-0
(二)临床思辨
为什么无创通气治疗没有完全纠正本例患者白天血气紊乱情况?
回顾PSG记录可以看到,患者在REM睡眠期出现较长时间呼吸暂停和频繁低通气(图1),在non-REM睡眠期也有频繁低通气(图2),在清醒时呼吸不规则,呼吸幅度、深浅不一,并且存在与之相应的脉氧饱和度下降(图3)。这种清醒状态下呼吸模式的异常提示,本例患者的慢性呼吸衰竭不是单纯由于阻塞性睡眠呼吸暂停低通气综合征所致,可能还存在呼吸中枢调节障碍。
自主过度通气试验显示,患者的低氧血症和高碳酸血症可以完全纠正(SpO2 75%~97%、PaO2 33~83mmHg,PaCO2 64~43mmHg),运动后的脉搏血氧饱和度亦有明显升高,这些现象不能用慢阻肺合并OSAS来解释。
一般来说,无器质性原因的睡眠呼吸障碍患者经2周治疗有效去除睡眠呼吸紊乱后,白天血气会有所改善,甚至恢复正常,呼吸中枢敏感性可显著提高。然而,本例患者经2周治疗后,上述指标均无改善,提示可能存在呼吸中枢调节功能异常。
(一)临床信息
【影像学检查】
头颅MRI:双侧半卵圆中心、基底节区多发腔隙灶,Ⅰ型Chiari畸形(图5)。
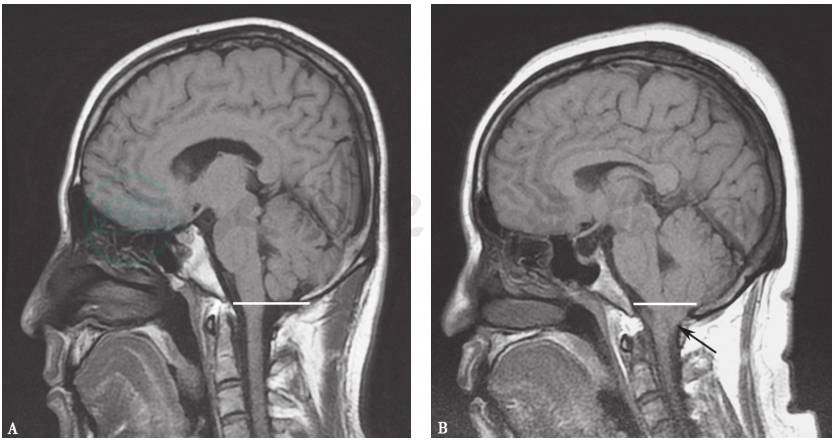
图5 头颅MRI矢状位图像
A.正常表现;B.小脑扁桃体疝入枕骨大孔水平以下8mm(本例患者)
引自:主编:.呼吸系统疑难病例诊疗辨析.第1版.ISBN:978-7-117-26415-0
【治疗过程】
经神经外科会诊,考虑患者存在Chiari畸形有手术指征,遂于6月1日在全麻下行硬脑膜后颅窝减压术。术后,复查血气分析,各项指标较术前明显好转(6月10日,未吸氧):pH 7.45,PaCO2 47.0mmHg,PaO2 51.2mmHg,HCO3- 33.1mmol/L,SaO2 90.7%; 复查 PSG(6月 11 日 ), 最长呼吸暂停时间116s,平均暂停时间24s,总暂停时间2040s,AHI 58次/小时,睡眠中最低SpO246%,平均SpO284.6%(图6)。患者病情好转,并于6月12日出院。
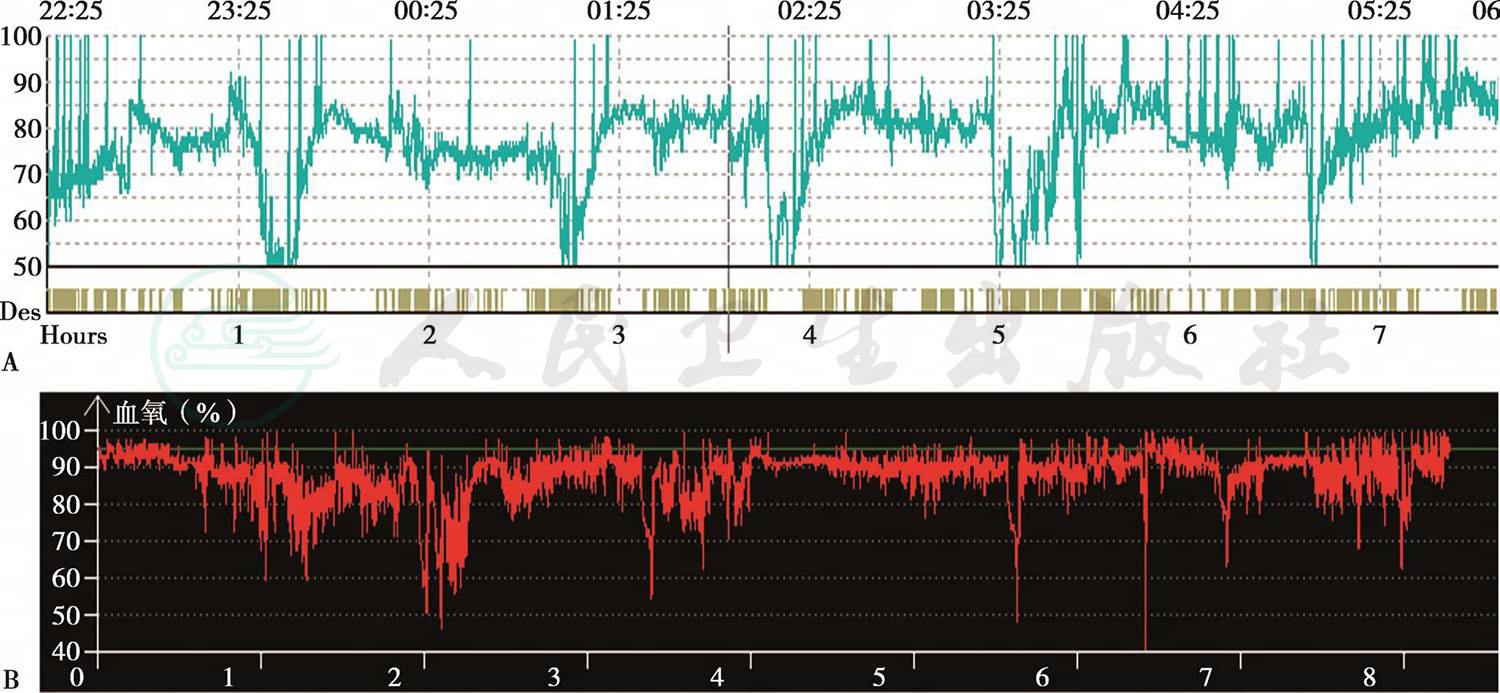
图6 手术前后PSG比较
术前PSG(A)、术后PSG(B)整夜SpO2趋势比较,可见术后SpO2明显改善
引自:主编:.呼吸系统疑难病例诊疗辨析.第1版.ISBN:978-7-117-26415-0
最后诊断:Chiari畸形致慢性呼吸衰竭。
(二)临床思辨
Chiari畸形(Chiari malformation,CM)无论单独存在或与脊髓空洞症并存,均可引起各种突发或缓慢进展的呼吸障碍,包括中枢性肺泡低通气、睡眠呼吸暂停以及因吞咽困难导致误吸引起的急性呼吸功能不全。此类患者睡眠中的呼吸紊乱表现通常由上气道功能不全和呼吸控制异常两种机制引起。上气道功能不全主要与阻塞性呼吸暂停有关,而呼吸控制异常则在中枢性睡眠呼吸暂停的病理生理变化中扮演重要角色。通过PSG观察呼吸模式可以发现,上述两种机制在本病例中均有体现,而且呼吸控制异常对呼吸节律和幅度的影响延续到白天清醒状态。
与其他原因引起的呼吸衰竭不同,CM所致呼吸衰竭可通过自主过度通气纠正。本例患者肺通气功能基本正常,在自主过度通气后,血氧饱和度可恢复正常,提示呼吸效应系统正常而呼吸驱动低下是导致白天低通气和慢性呼吸衰竭的主要原因。自主过度通气纠正试验有助于发现中枢呼吸驱动下降所致慢性呼吸衰竭。这也是本病例诊治过程给予临床工作的重要启示。
本例患者明显肥胖、白天嗜睡、肺泡通气不足、水肿、打鼾与睡眠呼吸紊乱,符合典型的肥胖睡眠呼吸暂停综合征表现。Hb、Hct和HCO3-显著升高,提示存在慢性呼吸功能不全。患者无低钾等电解质紊乱,无典型的阻塞性通气功能障碍,不存在呼吸肌肉无力,自主过度通气可使PaO2和PaCO2恢复至正常水平,说明呼吸衰竭的原因并非“不应呼吸”和“不能呼吸”,而是中枢呼吸调节功能受损所致的“不愿呼吸”。其原因在于:①清醒状态下存在呼吸节律不规整、呼吸幅度和血氧饱和度波动大; ②睡眠状态下存在与中枢呼吸调节功能失调相关的肺泡低通气和呼吸不足,且REM期更明显;③呼吸中枢调节功能测定发现低氧和高二氧化碳反应性均明显降低。因此,患者的化学感受器不敏感,不能刺激脑干呼吸神经元发出足够强的冲动以产生足够通气量。其行为控制系统、传导通路及效应器官均正常,有意识深大呼吸尚可使通气量达到正常;入睡后,行为调节功能减弱或消失,则低通气加重。呼吸中枢调节功能降低是睡眠呼吸紊乱的易患因素。对无器质性原因的睡眠呼吸障碍患者,经2周治疗,有效去除睡眠呼吸紊乱后,白天动脉血气会改善,甚至恢复正常,呼吸中枢敏感性显著提高。本例患者经2周治疗后,上述指标均无改善,提示存在引起呼吸中枢调节功能异常的病因。
通过手术治疗解除对延髓呼吸中枢的压迫后,患者睡眠状态下血氧和白天血气水平明显改善,支持Chiari畸形与呼吸中枢功能低下有关。这与Zolty等报道相符合。成年人通过外科手术治疗Chiari畸形相关睡眠呼吸暂停的研究显示,手术可以明显改善此类患者的中枢性睡眠呼吸障碍,但是对仍存在阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)者,仍应给予无创通气治疗。本例患者在手术后呼吸衰竭得到部分纠正,而AHI增加可能与呼吸中枢敏感性恢复后呼吸驱动增强、呼吸力量增加致吸气时咽腔内负压增大而发生气道阻塞有关。术后PSG检查发现OSA增多也支持这一推测。
慢性呼吸衰竭是内科较为严重的临床综合征,多由于胸肺部慢性疾病所致,肺外因素常难以引起临床医生足够的重视。睡眠呼吸紊乱可导致血气紊乱,甚至诱发Ⅱ型呼吸衰竭。Chiari畸形是一种先天性小脑扁桃体延髓联合畸形。由于此畸形压迫延髓导致睡眠呼吸紊乱,进而发展为慢性呼吸衰竭少有报道,临床上容易被忽视。常规头颅CT检查由于未能包括脑干及枕骨大孔区而可能无法发现此异常,容易造成此类疾病的漏诊。
Chiari畸形相关呼吸调节障碍的临床表现为中枢性睡眠呼吸暂停和低通气,白天清醒状态下呼吸不规整,可导致慢性呼吸衰竭。缺氧状态可以通过自主过度通气试验纠正,表现为典型的中枢性呼吸调节功能不全。手术治疗对Chiari畸形引起的中枢性睡眠呼吸暂停及呼吸调节异常效果显著,但不能去除并发的其他类型睡眠呼吸暂停,因此手术后应进行密切随访,必要时进行家庭无创通气治疗。
(董霄松 韩芳)
1.韩芳,李玉茜.匹克威克综合征与睡眠呼吸医学.中华结核和呼吸杂志,2008,31:717-718.
2.高莹卉,王慧玲,李静,等.睡眠呼吸紊乱与呼吸衰竭及心力衰竭关系的研究.中华结核和呼吸杂志,2012,35:429-434
3.韩芳,陈尔璋,魏海琳.阻塞性睡眠呼吸暂停综合征患者睡眠状态下呼吸中枢控制功能的改变及测定方法.中华结核和呼吸杂志,1998,21:471-476.
4.Han F,Chen E,Wei H,et al.Treatment effects on carbon dioxide retention in patients with obstructive sleep apnea-hypopnea syndrome.Chest,2001,119:1814-1819.
5.Zolty P,Sanders MH,Pollack IF.Chiari malformation and sleep-disordered breathing :a review of diagnostic and management issues.Sleep,2000,23:637-643.
6.韩芳.睡眠呼吸障碍性疾病诊疗和管理的新策略.中华医学杂志,2013,93:403-404.
7.赵蒙蒙,张希龙.阻塞性睡眠呼吸暂停低通气综合征的诊断与治疗.中华医学杂志,2012,92:1228-1230.
8.Gagnadoux F,Meslier N,Svab I,et al.Sleep-disordered breathing in patients with Chiari malformation :improvement after surgery.Neurology,2006,66:136-138.
9.Achiron A,Kuristzky A.Dysphagia as the sole manifestation of adult type Ⅰ Arnold-Chiari malformation.Neurology,1990,40:186-187.
10.Haponik EF,Givens D,Angelo J.Syringobulbia-myelia with obstructive sleep apnea.Neurology,1983,33:1046-1049.
11.Dauvilliers Y,Stal V,Abril B,et al.Chiari malformation and sleep related breathing disorders.J Neurol Neurosurg Psychiatry,2007,78:1344-1348.
12.Bullock R,Todd NV,Easton J,et al.Isolated central respiratory failure due to syringomyelia and Arnold-Chiari malformation.BMJ,1988,297:1448-1449.
13.Fish DR,Howard RS,Wiles CN,et al.Respiratory arrest:a complication of cerebellar ectopia in adults.J Neural Neurosurg Psychiatry,1988,51:714-716.
14.Ely EW,McCall WV,Haponik EF.Multifactorial obstructive sleep apnea in a patient with Chiari malformation.J Neurol Sci,1994,126:232-236.













