(一)病例信息
【病史】
女性患者,35岁,因右侧胸腔积液3个月入院。4个月前,患者因不孕症在当地医院住院治疗,期间曾注射促排卵激素,3个月前出现右侧胸痛,深吸气后加重,无发热、咳嗽、咳痰、咯血。患者于当地医院就诊,胸部超声检查提示右侧胸腔积液,未予特殊治疗,胸痛症状逐渐消失。1个月前,患者又于当地另一家医院就诊,胸部超声检查提示右侧大量胸腔积液,右侧胸腔留置微管引流出乳白色液体,实验室检测证实为乳糜胸。胸腔积液细胞学检查未见肿瘤细胞。胸部CT检查显示双肺多发囊状密度减低区。患者为进一步诊治住我院。自发病以来,患者精神、睡眠正常,食欲较差,体重无明显变化。
患者否认既往高血压、冠心病、糖尿病等病史,否认手术、外伤史及输血史,对头孢菌素过敏。
【体格检查】
体温36.8℃,心率78次/分,呼吸17次/分,血压120/80mmHg;一般状况可;胸廓无畸形,胸壁静脉无曲张,右侧肋间隙增宽;胸骨无压痛,未触及胸膜摩擦感及皮下捻发感;右侧肩胛下角线第8肋间以下叩诊浊音;左肺呼吸音清,右肺呼吸音稍弱,双肺未闻干湿啰音;右侧腋后线第8肋间留置引流管,每天引流量约200ml;心界不大,心律齐,心音有力,各瓣膜听诊区未闻病理性杂音;腹平坦,无腹壁静脉曲张,未见胃肠型及蠕动波;全腹无压痛,无反跳痛、肌紧张,肝、脾肋下未触及;肠鸣音5次/分。其他检查未见异常。
【影像学检查】
胸腔B超(入院前33天):右侧胸腔可见大量液性暗区,于腋后线8肋间测得液性暗区前后径为9.8cm。
胸腔B超(入院前20天,胸腔置管后):右侧肋膈角处可见液性暗区,前后径为0.7cm。
胸部HRCT检查(入院后2天):双肺散在囊状透亮区,最大直径在1cm左右,右侧少量胸腔积液(图1)。肺门及纵隔淋巴结未见肿大。
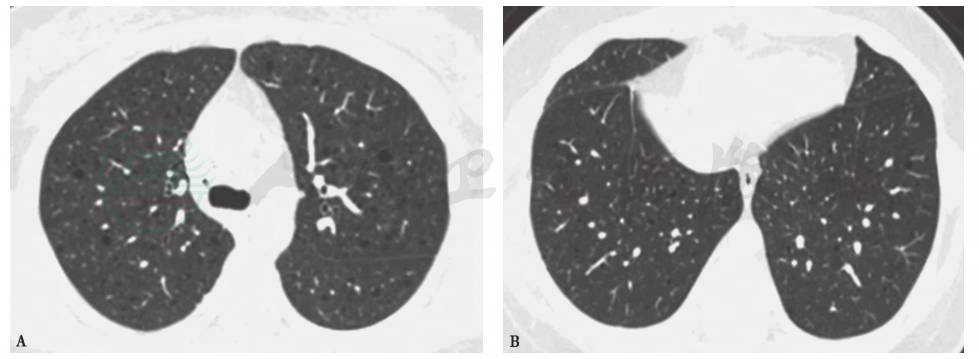
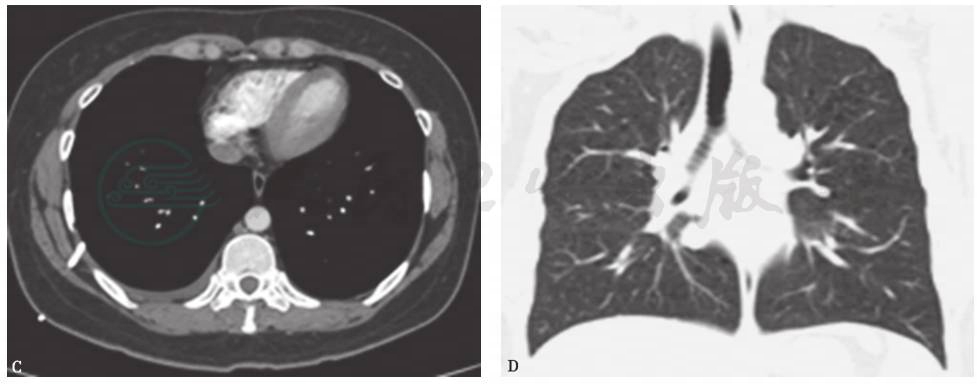
图1 入院后2天胸部HRCT表现
(二)临床思辨
【临床特点】
1.患者为育龄期青年女性,病程呈亚急性。
2.发病前注射过促排卵药物(可能诱因)。
3.临床表现为咳嗽、咳痰,活动后气短,右侧乳糜胸。
4.胸部HRCT特点为双肺散在多发囊状透亮区,右侧少量胸腔积液,纵隔及肺门淋巴结未见肿大。
【思辨要点】
对育龄期妇女出现进行性呼吸困难,胸部CT呈现弥漫性囊泡性病变,并反复发生自发性气胸和(或)乳糜胸,应该考虑该病的可能。欧洲呼吸病学会(European Respiratory Society,ERS)在2010年颁布了LAM临床指南,其中提到如果患者具有LAM的特征性HRCT表现,同时合并乳糜胸或乳糜腹,即可确诊LAM。但是,早期淋巴管肌病的HRCT征象有时并不典型,而且有些疾病的HRCT表现与LAM十分类似,因此有必要对双肺多发囊性病变进行系统的鉴别诊断。
有哪些疾病可能发生双肺多发囊性病变?
(1)淋巴管平滑肌瘤病
LAM曾被认为是发生在育龄期妇女的一种致命性疾病,除了肺移植之外无药可医。在最近20年,人类对这种“孤儿病”的研究取得了极大的进展,目前认为绝经期后的妇女也可以罹患该病,但患者在妊娠期、接受外源性雌激素治疗期间容易出现病情进展。LAM患者的临床表现包括肺内和肺外两个方面,主要的肺内表现包括活动后呼吸困难、复发性气胸(发病率为39%~76%)、咳嗽、胸痛、乳糜胸、咯血等;LAM患者经常同时患肾血管平滑肌脂肪瘤(AML)、腹膜后淋巴管平滑肌瘤、腹膜后及盆腔淋巴结肿大、子宫平滑肌瘤等,出现相应肺外表现,如肾内肿物、腹膜后或盆腔肿物、腹部不适、乳糜腹等。LAM的特征性HRCT表现为:双肺多发(>10个)薄壁囊泡性改变,囊泡呈圆形或椭圆形,直径通常在2~5mm,少数可达25~30mm,囊壁厚度一般不超过2mm;肺容积正常或呈过度充气状态(图2)。如果双肺仅有3~9个薄壁囊腔,则定义为LAM的符合性HRCT表现。LAM典型的病理表现为:肺实质囊性改变及异常增生的LAM细胞。LAM细胞包括两种形态:一种为未成熟的梭形平滑肌细胞,呈多灶性、结节样增生;另一种为分布在血管周围的类上皮样细胞。LAM细胞在瘤样增殖过程中围绕淋巴管、小气道和小血管,引起局部狭窄或破坏,最终导致终末气腔囊性扩张、淋巴管扩张和淋巴液淤滞、血管破裂和含铁血黄素沉积。作为LAM常见的肺外表现,肾血管平滑肌脂肪瘤、淋巴结病、肺外淋巴管肌瘤的组织学特点与患者肺内病理改变基本一致。LAM的免疫组化标志包括α-平滑肌肌动蛋白(SMA)、结蛋白及人类黑色素瘤单克隆抗体(HMB45),HMB45阳性对诊断LAM具有较高特异性。
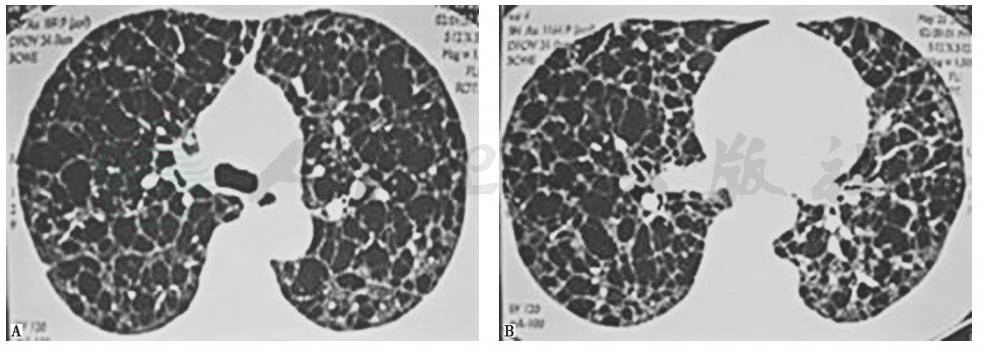
图2 淋巴管平滑肌瘤病胸部CT表现
女性患者,44岁,间断咳嗽、活动后气短7年。胸部CT显示双肺弥漫分布的薄壁类圆形囊性病变。经电视辅助胸腔镜肺活检,病理诊断为淋巴管平滑肌瘤病
(2)小叶中心型肺气肿
是由于终末细支气管发生慢性阻塞性细支气管炎引起管腔狭窄,其下游的一级、二级、三级呼吸性细支气管发生囊状扩张,而远端的肺泡管、肺泡囊、肺泡仍保持结构正常,发生囊状扩张的呼吸性细支气管位于二级肺小叶的中央,故称为小叶中心型肺气肿。小叶中心型肺气肿是慢性阻塞性肺疾病的主要病理特征之一,HRCT表现为双肺多发小圆形无壁低密度区,直径从数毫米至1cm,严重者可相互融合形成体积较大的气囊影,直径>1cm的肺气肿区域属于肺大疱,通常有薄壁。在HRCT横断面上,有时可以观察到肺气肿包绕着小叶中心动脉。小叶中心型肺气肿可以分布在整个肺,但上叶多发(图3)。小叶中心型肺气肿的影像学表现具有特征性,故通过HRCT即可诊断。
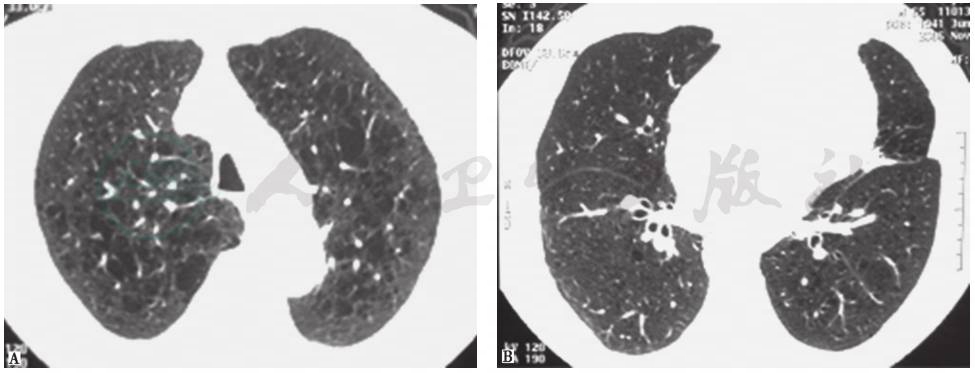
图3 小叶中心型肺气肿CT表现
男性患者,55岁,长期吸烟,咳嗽、咳痰伴活动后气短6年。胸部CT显示双肺多发囊状无壁透亮影(即小叶中心型肺气肿),肺气肿区之间为正常肺组织。小叶中心型肺气肿的分布特点常为上肺重、下肺较轻
(3)肺朗格汉斯细胞组织细胞增生症(PLCH)
又称肺组织细胞增多症X,为朗格汉斯细胞组织细胞增多症(LCH)单器官受累的一个亚型,几乎(98%)仅见于吸烟者,因此被认为是一种与吸烟相关的弥漫性间质性肺病。PLCH好发于30~50岁的重度吸烟者,主要临床症状包括咳嗽、活动后气短、自发性气胸,其中15%的患者以气胸为首发症状。PLCH患者的胸部HRCT特点是双肺弥漫分布的不规则囊性病变及微结节影,其囊性病变更多分布在中上肺野,囊壁厚薄不均,囊腔形态多样,可表现为双叶形、分支形、哑铃形、不规则形等(图4)。微结节位于小叶中心,其直径一般<5mm,小结节中心可见空腔形成。PLCH患者常同时患有其他吸烟相关肺部疾病,故HRCT可同时显示肺气肿、呼吸性细支气管炎伴间质性肺疾病(RB-ILD)、特发性肺纤维化(IPF)等疾病的影像学特点。PLCH的组织病理学特点是:肺组织结构呈囊性或肺大疱样改变,重度患者可见肺间质纤维化;小气道周围可见由朗格汉斯细胞、嗜酸性粒细胞、淋巴细胞等炎症细胞浸润形成的肉芽肿样结构。朗格汉斯细胞的免疫组化标志包括细胞表面抗原S-100蛋白及CD1a抗原染色阳性。
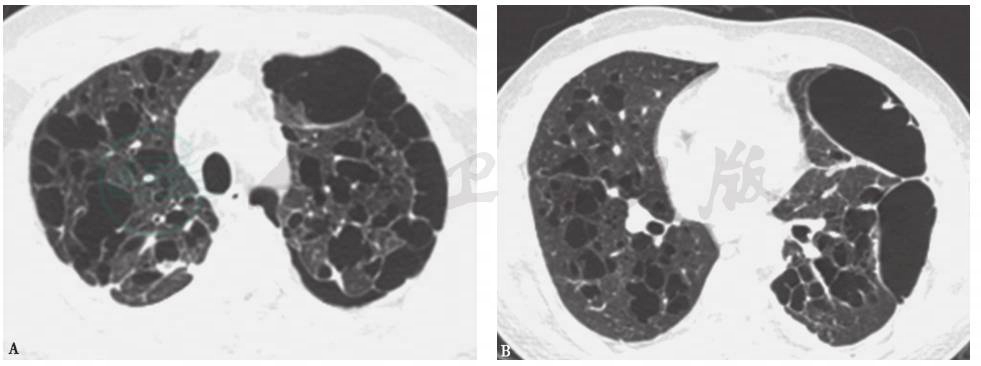
图4 PLCH胸部影像学表现
男性患者,40岁,因活动后气短、自发性气胸入院。胸部CT可见双肺多发不规则形囊性病变伴左侧气胸。行VATS下肺大疱切除术及胸膜固定术,术后病理诊断为肺朗格汉斯细胞组织细胞增生症
(4)脓毒性肺栓塞(septic pulmonary embolism,SPE)
也称感染性肺栓塞,即含有病原微生物的菌栓脱落后进入肺循环并栓塞肺动脉及其分支,引起肺栓塞(pulmonary embolism,PE)和(或)肺梗死,菌栓中的病原微生物可造成栓塞部位肺炎和(或)肺脓肿。引起SPE的菌栓常来源于右心系统的感染性心内膜炎、感染性血栓性静脉炎和骨髓炎,有时也可见于皮肤软组织和泌尿道感染等。常见的病原菌包括凝固酶阴性葡萄球菌、金黄色葡萄球菌、肠球菌、念珠菌、肺炎克雷伯菌和大肠杆菌等。除了发热和肺外感染症状之外,SPE患者的呼吸道症状包括咳嗽、呼吸困难、胸痛、咯血等,重症患者可合并ARDS或脓毒性休克。SPE胸部CT主要表现为双肺外带、胸膜下多发结节样浸润或楔形实变影,病变进展迅速。化脓性感染(如金黄色葡萄球菌感染)通常表现为多发空洞(图5),即血源播散性肺脓肿。临床诊断SPE必须符合以下4条:①局灶或多灶性肺浸润影;②存在可作为脓毒性栓子来源的活动性肺外感染灶;③排除其他可能引起肺浸润影的疾病;④经恰当的抗菌治疗,肺浸润影吸收。
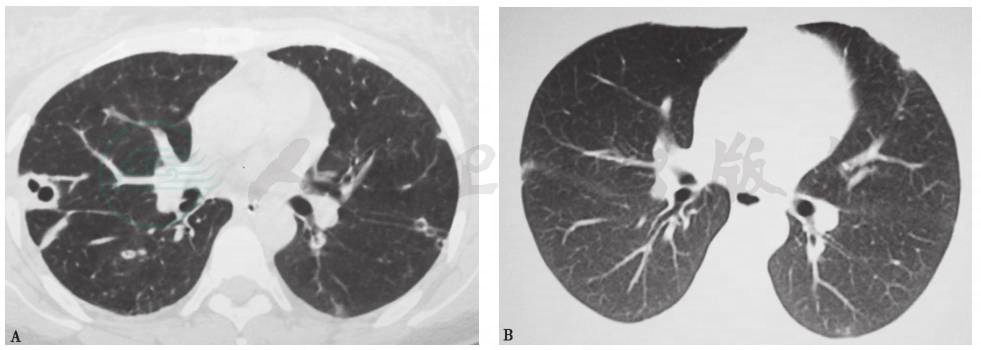
图5 脓毒性肺栓塞胸部HRCT表现
女性患者,34岁,皮肤软组织耐甲氧西林金黄色葡萄球菌(MRSA)感染,进一步导致脓毒性肺栓塞。治疗前,胸部CT显示双肺多发浸润及空洞,多位于肺野外带及胸膜下(A);万古霉素治疗8周后,胸部CT显示双肺多发浸润及空洞完全消失(B)
(5)骨与软组织肉瘤肺转移
肉瘤是指一大类具有间质细胞分化特征的恶性肿瘤,其发病率占成年人恶性肿瘤的1%,占儿童恶性肿瘤的15%。根据分化特征,肉瘤可分为两大类,即骨肉瘤和软组织肉瘤。骨与软组织肉瘤最常见的转移方式是通过血行转移到肺。肺转移性肉瘤最常见的HRCT表现为双肺多发实性结节,其次表现为双肺多发薄壁囊性空洞,结节或空洞周围的磨玻璃样渗出或空洞内的液平提示出血。肺转移性肉瘤早期并不引起症状,逐渐进展时主要表现为咳嗽、咯血、自发性气胸、呼吸困难等。据文献报道,骨肉瘤、平滑肌肉瘤、血管肉瘤(包括上皮样血管内皮肉瘤)、滑膜肉瘤、子宫内膜肉瘤等引起的肺转移瘤在HRCT上均可表现为双肺多发薄壁囊性空洞(图6),其成因有三方面:①转移瘤结节中心坏死;②肿瘤细胞浸润远端气腔壁,通过环瓣效应导致远端气腔囊性扩张;③在血管肉瘤,肿瘤细胞增殖后可形成囊性血管腔隙。临床上,对于已经确诊的骨与软组织肉瘤患者,当胸部影像学检查见双肺多发薄壁囊性空洞性病变时,应考虑肺转移。不少肉瘤患者确诊时已经出现肺转移灶,而原发灶的症状并不明显。
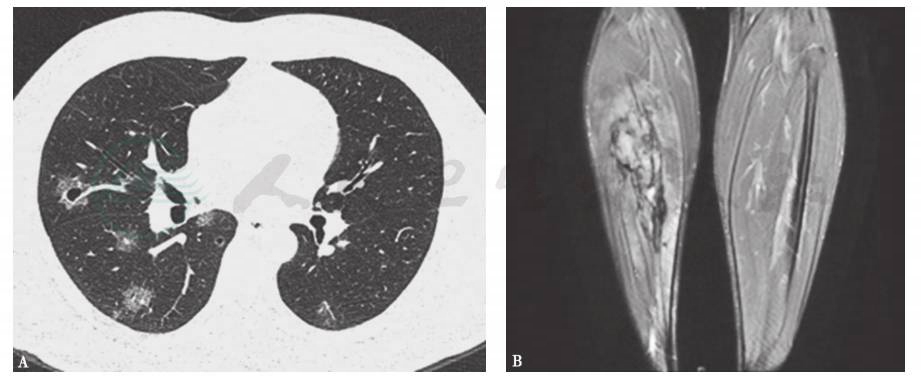
图6 血管内皮肉瘤伴肺转移影像学表现
男性患者,40岁,因间断咳嗽、咯血1年、反复自发性气胸入院。发病初期胸部CT显示双肺多发薄壁囊性空洞,空洞周围可见磨玻璃样渗出(A);下肢MRI(T2相)显示右小腿肌层内异常信号伴周围软组织水肿(B)。VATS肺活检病理诊断为血管肉瘤;右下肢腓肠肌粗针活检病理诊断为上皮样血管内皮肉瘤;最终确诊为右下肢腓肠肌上皮样血管内皮肉瘤(Ⅳ期)伴双肺转移
(6)淋巴细胞性间质性肺炎(LIP)
特发性LIP在临床上很少见,绝大部分LIP继发于某种原发疾病,而最常见的原发病是干燥综合征。LIP的胸部HRCT表现为支气管肺泡周围囊肿,伴或不伴磨玻璃影或网状改变(图7)。LIP的组织学表现以多克隆炎症细胞呈弥漫性或间质性浸润为特征,可能会形成结节性淋巴组织。LIP通常与滤泡性细支气管炎同时存在,后者引起近端气道狭窄,在单向活瓣作用下使远端气腔呈囊性扩张。此外,干燥综合征还有一个并发症——肺淀粉样变,在胸部HRCT既可以表现为实性结节,也可以表现为薄壁囊腔。总之,干燥综合征患者的胸部HRCT显示支气管周围囊肿增多、增大,往往提示原发疾病呈进展趋势。对于已经确诊的干燥综合征患者,依据典型的HRCT征象,且排除其他与干燥综合征相关特殊肺部并发症(如黏膜相关淋巴瘤),即可临床诊断LIP。
本例患者为育龄期妇女,否认吸烟史,结合HRCT的特点,可完全排除小叶中心型肺气肿和肺朗格汉斯细胞组织细胞增生症诊断。患者的临床特点也不符合活动性感染表现,因此不考虑脓毒性肺栓塞。患者否认眼干、口干,而且HRCT所示囊性病变呈随机分布,而非沿支气管血管束分布,不符合继发于干燥综合征的LIP表现。淋巴管平滑肌瘤病和肺转移性肉瘤的临床表现均包括咳嗽、咳痰、咯血、胸痛、自发性气胸等,二者的HRCT特点也具有多发囊性病变的共性。本病例表现为乳糜胸,因此,更支持淋巴管平滑肌瘤病的诊断。
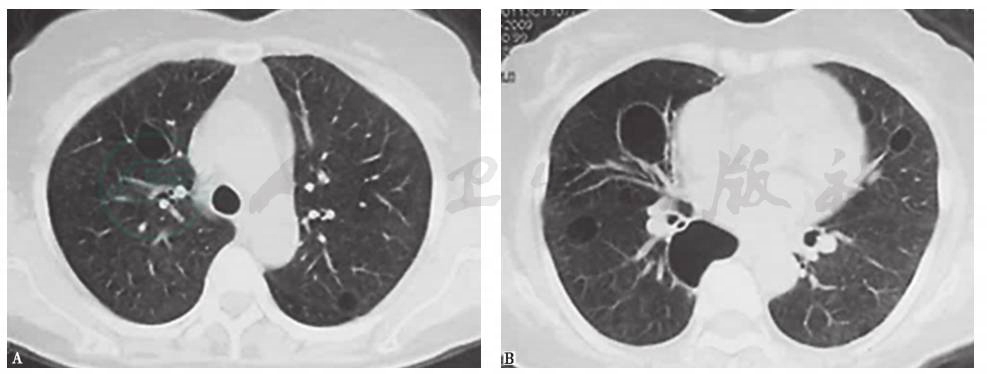
图7 干燥综合征合并淋巴细胞性间质性肺炎胸部CT表现
女性患者,73岁,干燥综合征合并淋巴细胞性间质性肺炎。胸部CT显示双肺弥漫性磨玻璃样渗出,伴多发大小不等、沿支气管血管束分布的薄壁囊腔
患者临床初步诊断考虑淋巴管平滑肌瘤病,胸部HRCT显示双肺散在微小囊性病变,提示肺部受累尚不严重。确诊需通过外科肺活检以获得组织病理学证据,在电视辅助胸腔镜(VATS)肺活检过程中还可同时进行胸膜固定术来治疗顽固性右侧乳糜胸。由于LAM患者经常合并肾脏血管平滑肌脂肪瘤及腹膜后病变,故入院后应完善腹部CT。
(一)临床信息
【实验室检查】
1.一般检查
(1)血常规
WBC 2.97×109/L,N% 69.1%,L% 21.9%,Hb 15g/dl,PLT 297×109/L。
(2)血生化
ALT 29U/L,AST 23U/L,LDH 150U/L,CK 58U/L,ALB 35.1g/L,CCr 58μmol/L。
2.免疫相关检查
自身抗体谱未见异常(包括ANA、抗-Sm、RNP、SSA、SSB、AMA、ANCA)。
3.性激素水平检查
促黄体激素(luteotropic hormone,LH)6.25U/L,促卵泡激素(folliclestimulating hormone,FSH)6.82U/L,雌二醇(estradiol,E2)0.1820nmol/L,催乳素(prolactin,PRL)14.92ng/ml。
【影像学检查】
腹部CT见肝脏多发囊肿,其余未见异常。
【胸腔镜检查】
术前各项检查显示,患者不存在手术禁忌证,具备电视辅助胸腔镜(VATS)肺活检的适应证,遂由胸外科医师为患者实施全麻下VATS辅助肺活检术。
术中所见:肺表面多发肺实质内大泡及胸膜下积气,大泡直径为2~5mm,胸壁及肺表面无明显结节。
分别在右肺上叶前段、中叶外侧段及下叶背段囊性病变明显处行楔形切除取得3条肺组织。
肺活检组织病理学特点:肺泡呈囊性扩张,囊腔周围可见梭形细胞呈多灶分布,部分小血管扩张(图8A)。免疫组化染色,CD31、CD34、S-100、SMA、Desmin,HMB45(局灶)均阳性 (图8B)。病理诊断为肺淋巴管平滑肌瘤病。
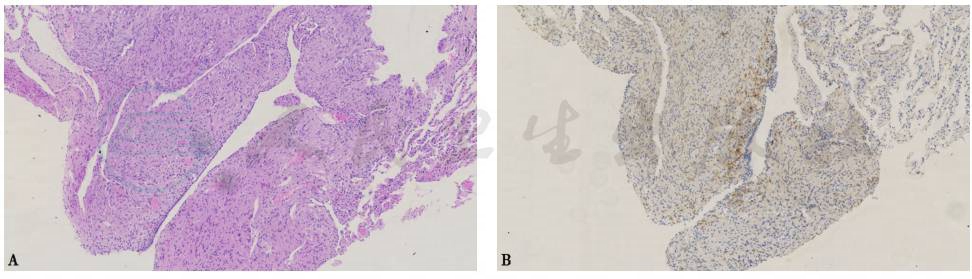
图8 肺组织病理表现
A.HE染色,100×;B.HMB45染色,100×
最后诊断:淋巴管平滑肌瘤病。
术后,予患者右侧胸腔留置闭式引流,每天可引流出多量乳糜性胸液;给予低脂高蛋白饮食及静脉营养,并经胸管注入滑石粉+利多卡因混悬液进行胸膜固定。患者胸腔封闭良好,顺利出院。
(二)临床思辨
本例患者的肺活检组织病理学结果证实了之前的临床推断——LAM。与10年前相比,近年来确诊的LAM患者普遍年轻(本例患者35岁),其中双肺囊性病变呈弥漫性改变者(图2)临床疗效欠佳,预后差。
LAM有两种表型:一种见于结节性硬化症(TSC)患者,该病是由TSC1、TSC2基因突变引起的常染色体显性遗传病,女性TSC患者中有26%~38%会合并LAM;另一种为散发型LAM,人群发病率为3.3~7.7/100万,其发病机制与体细胞发生TSC1、TSC2基因突变有关。TSC1基因的编码产物(错构瘤蛋白)及TSC2基因的编码产物(马铃薯球蛋白)均参与调节哺乳动物西罗莫司靶蛋白(mTOR)激酶活性。如果TSC1或TSC2发生基因突变,将导致mTOR激酶持续活化,继而使LAM细胞发生不受控制的增殖、迁移和侵袭。研究发现,雌激素和马铃薯球蛋白下游的mTOR具有协同效应,在LAM细胞的转移和侵袭中发挥重要作用。因此LAM患者在妊娠期、接受外源性雌激素治疗期间容易出现病情进展。
虽然LAM细胞的组织学形态不具备恶性细胞的异型性,但其生物学行为具备肿瘤细胞的侵袭性特点。Karbowniczek M等学者在10多年前就发现,LAM患者在接受单肺移植后,移植肺复发LAM。并且分子生物学研究显示,LAM细胞来源于肺移植受者而非供者,说明LAM细胞在人体内是可以转移的。其他临床研究也发现,从LAM患者的血液、尿液、胸腔或腹腔乳糜液中都能找到LAM细胞。迄今为止,LAM的原发病灶尚未明确,推测LAM细胞可能来源于淋巴管系统或血管平滑肌脂肪瘤(AML),但68%的散发型LAM患者并不合并AML。
无论是结节性硬化症患者的LAM还是散发型LAM,其发病的分子机制均涉及mTOR信号通路异常激活,这正是mTOR特异性抑制剂——西罗莫司(雷帕霉素)治疗LAM的理论基础。目前,国际上已完成用西罗莫司治疗LAM的Ⅰ期、Ⅱ期及Ⅲ期临床试验,证明西罗莫司可以稳定LAM患者的肺功能、减轻临床症状、改善生活质量。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)2014年颁布的《软组织肉瘤临床实践指南》中,将LAM归入软组织肉瘤分类,并依据现有循证医学研究结果,推荐西罗莫司用于治疗LAM。
本病例的诊断过程并不复杂,重点在于对双肺多发囊性病变的鉴别诊断,需要从临床流行病学特点、高危因素、临床表现、HRCT特点等方面掌握肺囊性病变疾病谱的特点。例如,在临床高危因素方面,小叶中央性肺气肿和LCH是吸烟相关肺疾病,多见于男性;LIP多继发于干燥综合征,女性多见;LAM几乎仅见于女性。在HRCT特点方面,LCH表现为有壁囊腔,形状多样;LAM表现为薄壁的圆形或类圆形囊腔,呈散在或弥漫分布;LIP表现为气囊影分布于支气管血管束周围。在临床表现方面,LCH、LAM、肺转移性肉瘤患者常出现自发性气胸,只有LAM会发生乳糜胸。
(卢冰冰 高占成)
1.McCormack FX.Lymphangioleiomyomatosis :a clinical update.Chest,2008,133:507-516.
2.Karbowniczek M,Astrinidis A,Balsara BR,et al.Recurrent lymphangiomyomatosis after transplantation :genetic analyses reveal a metastatic mechanism.Am J Respir Crit Care Med,2003,167:976-982
3.Johnson SR,Cordier JF,Lazor R,et al.European Respiratory Society guidelines for the diagnosis and management of lymphangioleiomyomatosis.Eur Respir J,2010,35:14-26
4.Bissler JJ,McCormack FX,Young LR,et al.Sirolimus for angiomyolipoma in tuberous sclerosis complex or lymphangioleiomyomatosis.N Engl J Med,2008,358:140-151.
5.Mc Cormack FX,Inoue Y,Moss J et al.Efficacy and Safety of Sirolimus in Lymphangioleiomyomatosis.N Engl J Med,2011,364:1595-1606.
6.Songür N,Karakas A,Arikan M,et al.Multiple cystic pulmonary metastases from osteosarcoma.Respiration,2005,418.
7.NCCN clinical practice guidelines in oncology :soft tissue sarcoma(Version 2.2014)[EB/OL].http://www.nccn.org.National Comprehensive Cancer Network.
8.Castoldi MC,Verrioli A,Juli ED,et al.Pulmonary Langerhans cell histiocytosis :the many faces of presentation at initial CT scan.Insights Imaging,2014,5:483-492.
9.Hagmeyer L,Randerath W.Smoking-related interstitial lung disease.Dtsch Arztebl Int,2015,112:43-50.
10.Iwasaki Y,Nagata K,Nakanishi M,et al.Spiral CT findings in septic pulmonary emboli.Eur J Radiol,2001,37:190-194.
11.Cook RJ,Ashton RW,Aughenbaugh GL,et al.Septic pulmonary embolism :Presenting features and clinical course of 14 patients.Chest,2005,128:162-166.
12.Shi JH,Liu HR,Xu WB,et al.Pulmonary Manifestations of Sjögren’s syndrome.Respiration,2009,78:377-386.
13.Kokosi M,Riemer EC,Highland KB,et al.Pulmonary involvement in Sjögren’s syndrome. Clin Chest Med,2009,78:377-386.
14.Cook RJ,Ashton RW,Aughenbaugh GL,et al.Septic pulmonary embolism :presenting features and clinical course of 14 patients.Chest,2005,128:162-166.
15.卢冰冰,高占成,王俊,等.肺淋巴管平滑肌瘤病三例并国内文献复习.中华全科医师杂志,2005,4:162-166.













