(一)病例信息
【病史】
男性患者,30岁,因左侧背痛1个月伴胸痛1周入院。患者于1个月前无明显诱因,出现左侧背痛,呈钝痛,无撕裂样痛,无向四肢放射性疼痛,白天较轻,夜晚加重,无发热、乏力、盗汗,无咳嗽、咳痰,无恶心、呕吐,无心悸、头晕,外用膏药治疗,疼痛无明显缓解。1周前,患者出现阵发性左侧胸痛,程度不重,与呼吸运动无明显关联,无出冷汗及头晕、胸闷等不适,于我院门诊就诊,查心电图、心肌酶谱等无异常,胸部CT示两肺多发性异常密度影(有真菌感染可能,不排除肿瘤),为进一步明确诊断及治疗收住入院。患者发病以来,精神、食欲可,小便无异常,体重无明显减轻。
患者职业为消防队员,吸烟10余年(1~2包/天),无明显过敏史。
【体格检查】
体温37℃,心率90次/分,呼吸20次/分,血压136/89mmHg。神清,精神可,颈静脉无怒张,无眼睑水肿,浅表淋巴结未触及,胸廓无畸形,胸背部无固定压痛点;两肺呼吸音清,未闻干湿啰音;心律齐,未闻明显病理性杂音;腹软,无压痛,肝脾肋下未触及;双下肢无水肿,四肢无畸形,杵状指阴性,神经系统体征阴性。
【实验室检查】
血常规:WBC 8.2×109/L,N% 77.3%,Hb 147g/L,PLT 180×109/L。
尿常规未见异常;血生化未见异常。
【影像学检查】
胸部CT:两肺野内可见多发结节状、斑片状密度增高影,以两上肺为主,病灶形态欠规整,其内密度不均,部分内见空洞(图1)。
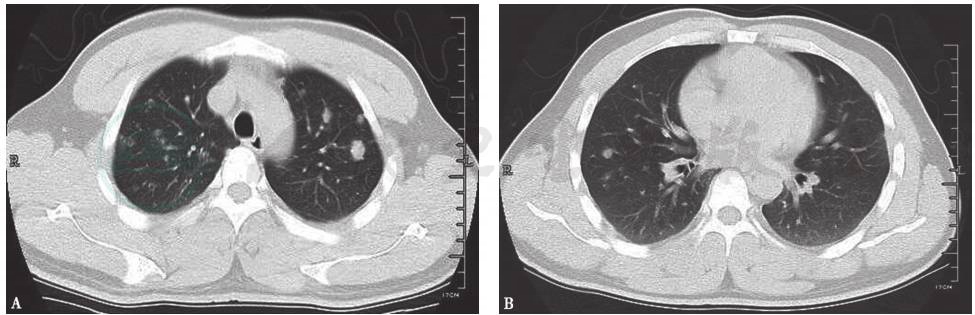
图1 入院前胸部CT表现
(二)临床思辨
【临床特点】
1.患者为青年男性,亚急性起病。
2.起病主要症状和体征为胸背痛,无明显感染中毒症状,无特殊阳性体征。
3.实验室检查无特殊阳性发现。
4.胸部影像学表现为两肺多发斑片状渗出,多发结节伴小空洞形成。
5.外用药物治疗疗效不佳。
【思辨要点】
临床上,结节及空洞样病变的胸部影像学表现缺乏特异性,在确立诊断过程中首先需要思考:是不是感染所致?
在感染性疾病中,首先要排除肺部真菌感染及肺部化脓性细菌感染。肺部真菌感染患者往往有免疫力下降病史,并伴有发热、咳嗽等症状,辅助检查可发现血常规、C反应蛋白升高,胸部影像学表现可见短期内动态变化(图2)。肺化脓性细菌感染表现为双肺多发空洞,有时空腔内合并小液平,可合并胸腔积液(图3)。本例患者无明显发热等全身症状,病史不符合急性感染性疾病特征,但仍须进一步完善感染标志物等检查以明确病情。
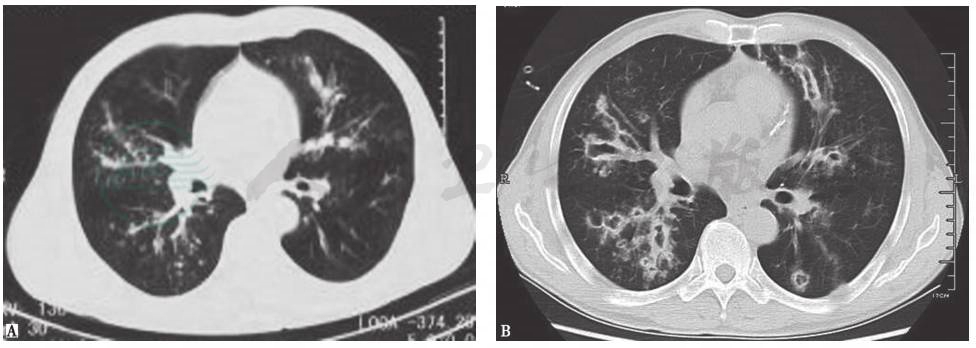
图2 侵袭性肺曲霉菌病胸部CT表现
男患者性,53岁,发热、咯血1周,伴呼吸困难,诊断为侵袭性肺曲霉菌病。胸部CT初期表现为沿支气管分布的粟粒样结节(A);1周后表现为多发沿支气管分布的空洞,有中心性支气管扩张(B)
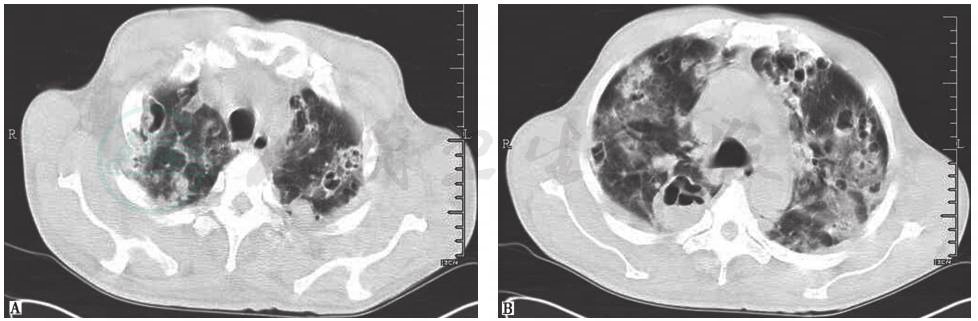
图3 血源性金黄色葡萄球菌肺炎胸部CT表现
胸部CT可见双肺多发结节空洞性改变,部分空洞伴液平,病灶周围可见渗出表现
在非感染性疾病中,需要与风湿免疫病以及肿瘤性肺疾病(如转移性肿瘤及和支气管肺癌等)相鉴别。风湿免疫病的临床表现除了肺部病变以外,常伴有肾、关节、皮肤、肌肉和血液等多系统损伤,但可能以肺组织损伤为首发表现。当累及肺组织时,往往双侧肺叶受累,大多表现为双肺弥漫性病变或弥漫性肺泡出血(图4),肺内病灶表现常有多变、多形、多样的特点。肺部转移性肿瘤往往表现为两肺多发结节,进展程度个体差异大。肺癌影像学表现可为肺部结节及多发空洞 (图5、图6),经支气管镜或经皮肺穿刺大多可明确诊断。本例患者为青年男性,有吸烟史,以胸痛起病,有必要行支气管镜检查以排除肿瘤性病变,并需要进一步行骨发射型计算机断层扫描(emission computed tomograpy,ECT)等检查以排除骨骼病变。
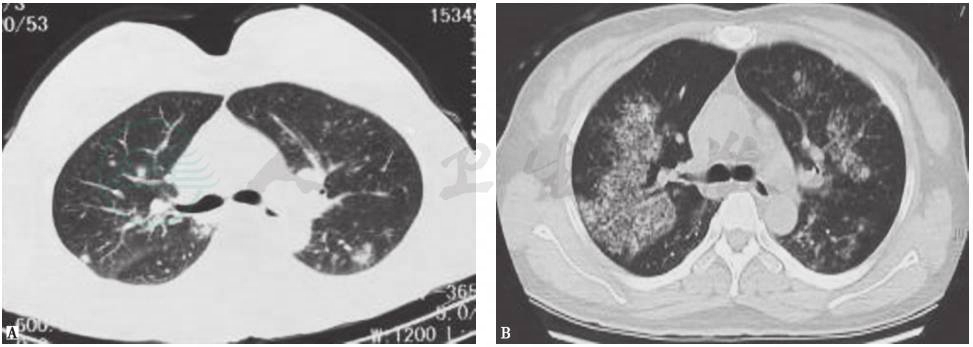
图4 弥漫性肺泡出血胸部CT表现
女性患者,48岁,因咳嗽2个月、发热4天入院。起病时胸部CT表现为两肺多发结节(A),之后出现两肺弥漫性肺泡出血,部分病变有游走性改变(B)。诊断为弥漫性肺泡出血
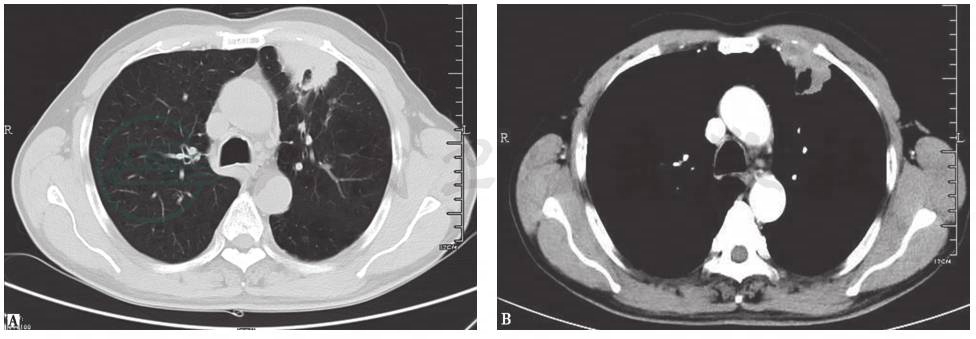
图5 肺鳞癌胸部CT表现
男性患者,63岁,痰中带血1个月。胸部CT发现左上肺空洞性病变,病理诊断为肺鳞癌
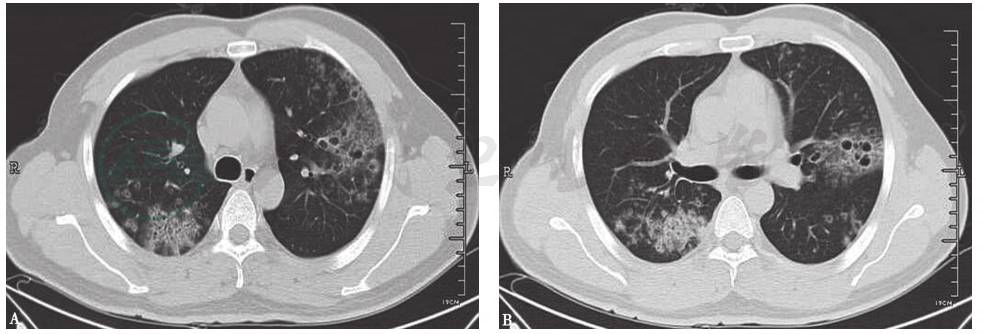
图6 高分化腺癌胸部CT表现
男性患者,37岁,因咳嗽9个月入院,病理检查证实为高分化腺癌。胸部CT表现为两肺野多发斑点状、斑片状结节影及模糊环状低密度影,病灶形态欠光整
综上分析,本病例影像学表现为肺内多发小结节及空洞样病灶,有胸背疼痛,无明显发热、咳嗽等症状,无脓性痰液排出。这些特点与常见肺部感染有很大不同,若血沉、CRP等在正常范围内,首先考虑为非感染性病变,但不能排除特殊病原体感染。因此,对于本病例,需要进一步完善免疫学检查及支气管镜或经皮肺穿刺、胸腔镜活检等以明确诊断。
(一)临床信息
【实验室检查】
1.一般检查
(1)血常规(多次检查):WBC(8.20~11.28)×109/L,N% 80%~83.6%,Hb和PLT均正常。
(2)ESR 12mm/1h。
(3)肝功能正常。
2.免疫相关检查
自身抗体(包括抗核抗体、抗dsDNA、Sm抗体、抗线粒体抗体、ANCA、MPO/PR3等)均阴性。
3.感染相关检查
PCT 0.01μg/ml;CRP 59.1mg/L;PPD试验阴性;T-SPOT阴性;真菌检测(G和GM试验)阴性;痰一般细菌培养及真菌培养均阴性。支气管肺泡灌洗液(BALF)抗酸杆菌阴性,未找到脱落细胞。
【其他辅助检查】
1.支气管镜检查
见双肺各叶段支气管通畅,未见管腔狭窄及阻塞(图7)。
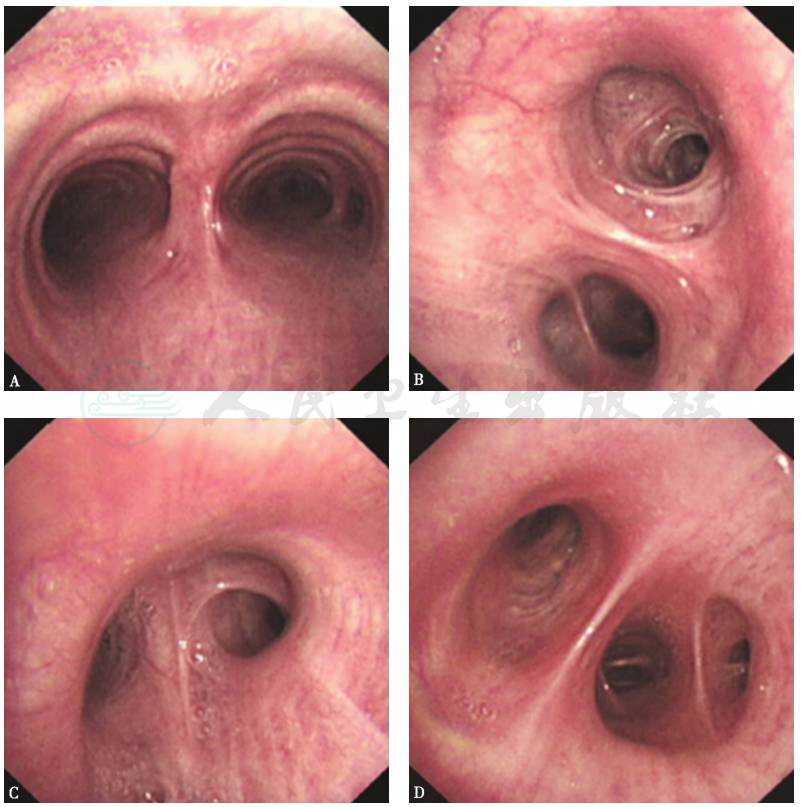
图7 支气管镜检查镜下表现
A.气管隆嵴;B.左主支气管;C.右上叶支气管;D.右中间段支气管
2.双肾、肾上腺、后腹膜B超
未见异常。
3.肺功能通气+弥散功能
轻度混合性通气功能异常,弥散功能轻度降低(DLco 74%预计值)。
骨骼ECT:左第四前肋骨质局灶性代谢活跃。
(二)临床思辨
患者入院后所做系列检查显示:①血生化指标均在正常范围;②自身抗体均阴性,结合临床表现,可初步排除风湿免疫病;③支气管镜检查见肺内气道通畅,可排除合并气管腔内病变;④骨ECT示骨质代谢局灶性活跃,且与疼痛部位相应,结合患者否认外伤史,考虑合并骨质病变;⑤常规病原学检查均阴性。这些结果支持非感染性病变的可能。
此时需要思考的问题是如何选择鉴定病因的最佳手段?
本例患者支气管镜检查无特殊阳性发现,故需要通过有创手段获得标本,进行相关检测,如CT引导下穿刺、B超引导下穿刺、气道超声内镜引导下活检和外科胸腔镜手术等。由于患者胸部影像学检查显示结节多位于肺外带,气道内超声引导下活检阳性率低,产生气胸的可能性极大,但外科胸腔镜活检相对创伤较大。患者为青年男性,身体一般情况好,故在征得患者同意后拟定先行经皮肺穿刺活检明确诊断,必要时行胸腔镜活检。
(一)临床信息
对患者左肺病灶行经皮肺穿刺活检,病理见穿刺组织内较多急慢性炎症细胞浸润,以嗜酸细胞为多(图8A、B),免疫组化见多量CD1a(图8C)、S100阳性细胞(图8D),肺穿刺液细菌、真菌培养阴性,抗酸涂片阴性。
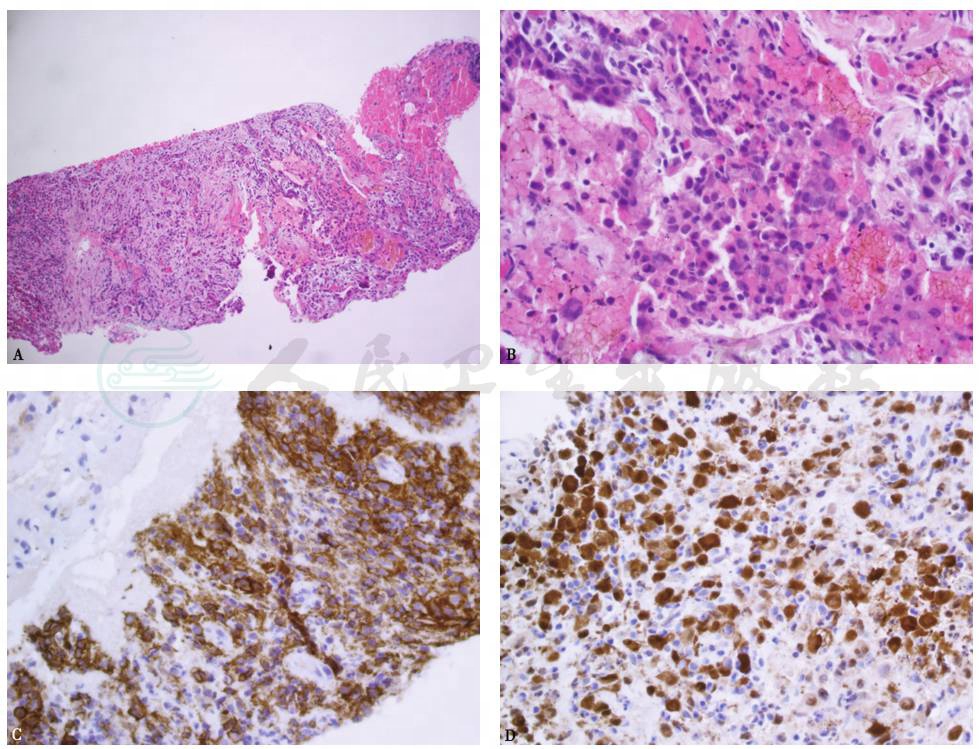
图8 病理表现
A.HE染色,100×;B.HE染色,400×;C.CD1a阳性,400×;D.S100阳性,400×
最后诊断:肺朗格汉斯细胞组织细胞增多症。
诊断明确后,嘱患者严格戒烟,同时给予糖皮质激素治疗(因合并骨质损害)。患者胸痛症状明显好转,1个月后复查胸部CT示肺部病灶基本吸收(图9)。
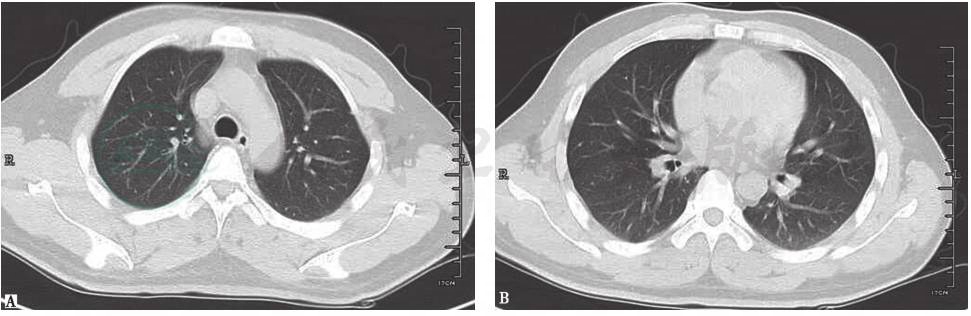
图9 复查胸部CT表现
(二)临床思辨
朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)是累及多种器官的一组免疫紊乱性疾病,是由树突状细胞家族中的朗格汉斯细胞(Langerhans cell,LC)单克隆性增生所致,可发生在任何年龄段。LCH生物学行为表现多样,轻者病变局限、病程自限,重者可表现为爆发性多器官免疫紊乱或恶性肿瘤而危及生命。
成年人LCH可以单独表现为肺部受累。男性患病率显著高于女性,超过90%患者吸烟。患者往往起病隐匿,主要表现为干咳和呼吸困难,偶有咯血,大约10%患者可出现气胸或溶骨性肋骨损伤,此时患者可出现胸痛。气胸有时是肺朗格汉斯细胞组织细胞增生症(PLCH)特征性表现之一。部分患者可出现中枢性尿崩症。PLCH患者体检时往往缺乏听诊湿啰音或杵状指这些体征。
PLCH影像学表现为以上中肺病变为主的弥漫性结节状和囊状病变。HRCT可发现薄壁囊泡(壁厚<1mm,直径<10mm)、小结节,或两者同时存在。随着病情进展,小结节逐步退化,囊性变会进一步加重,部分患者可能出现气胸。PLCH少见双下肺病灶分布,可以此与肺淋巴管平滑肌瘤病相鉴别。磨玻璃样影像学表现在PLCH患者中亦不常见。本例患者CT表现为小结节及空洞同时存在,病变以上中肺为主,但是囊性病变并不明显,临床上尚需与坏死性肉芽肿性血管炎、肺部真菌感染及转移性肿瘤鉴别。PLCH患者肺功能检查可提示混合型通气功能障碍。确诊LCH依赖病理活检。目前认为,识别朗格汉斯细胞最简便易行的标志物是CD1a和S100蛋白。确诊LCH金标准是找到Birbeck颗粒。
PLCH目前尚无标准治疗指南,患者预后也不尽相同。部分病例通过严格戒烟可能自愈,糖皮质激素对于部分有症状的患者有效。联合化疗用于LCH严重累及多系统者。对于急性进展并且出现呼吸衰竭的患者,可以进行肺移植术。本例患者行经皮肺穿刺活检明确诊断后,鉴于患者尚有胸痛症状,ECT提示肋骨代谢活跃,故在督促患者严格戒烟的同时加用糖皮质激素。1个月后复查胸部CT显示病灶基本吸收。
对于吸烟的男性患者,若胸部影像学检查见以双上肺为主,自上而下向肺底渐进性发展的小叶中心型结节、不规则囊性变,肋膈角邻近肺野病灶稀少,而无明显临床不适主诉,应甄别PLCH的可能。综合吸烟史和影像学改变可以做出PLCH的临床诊断,BALF细胞学CD1a和S100蛋白标志物阳性者可确诊,必要时可考虑采取肺活检明确诊断。
(许攀峰 周建英)
1.Richards JC,Lynch DA,Chung JH.Cystic and nodular lung disease.Clin Chest Med,2015,36(2):299-312.
2.Grana N.Langerhans cell histiocytosis.Cancer Control,2014,21(4):328-343.













