(一)病例信息
【病史】
男性患者,43岁,自由职业者,患骨髓增生异常/骨髓增殖性肿瘤(myelodysplastic syndrome,MDS)伴粒细胞减少症1年,因高热伴胸痛2周于2011年3月30日入院。患者于入院半个月前出现高热,最高体温39.7℃,伴畏寒、右侧胸痛,偶有咳嗽、咳少量白黏痰。外院胸部CT示右肺中叶大片炎症,美罗培南抗感染治疗后,患者胸痛减轻,但仍有高热。入院时胸部HRCT提示肺部感染,结合患者有血液系统疾病、多次住院史,不排除真菌感染可能性,予利奈唑胺、亚胺培南/西司他丁钠、阿奇霉素及伊曲康唑抗感染1周。患者仍有高热,体温最高达40.0℃,并出现胸闷、气促;血气分析Ⅰ型呼吸衰竭;复查胸部CT未见明显好转。抗感染治疗药物调整为莫西沙星及替考拉宁抗细菌,醋酸卡泊芬净抗真菌,更昔洛韦抗病毒。2011年4月14日复查胸部CT示病变较前明显进展。
【体格检查】
体温38.6℃,心率102次/分,呼吸24次/分,血压116/73mmHg。神志清楚,中度贫血貌;右肺呼吸音低,两肺未闻干湿啰音;心律齐,未闻病理性杂音;腹部未见明显异常;双侧下肢无水肿。
【实验室检查】
血常规:WBC 6.3×109/L,N% 58.0%,Hb 85g/L,PLT 241×109/L。
尿常规正常。
生化:ALT 298.5U/L,AST 155.1U/L,肌酐(Cr)及血尿素氮(BUN)正常。
C反应蛋白(CRP)83.9mg/L,血沉(ESR)93mm/1h。
结核抗体阴性;血IgE正常。
血气分析(吸入氧浓度 2L/min):pH 7.47,PaO2 69mmHg,PaCO2 32mmHg。
【影像学检查】
入院时胸部HRCT示右中上肺大片炎症伴实变影,右侧胸腔积液伴双侧胸膜增厚、粘连(图1);抗感染治疗2周后复查胸部HRCT示病变较前明显进展,可见双肺多发片状影及结节影,部分病变内可见支气管充气征,双侧少量胸腔积液(图2)。

图1 入院时胸部HRCT表现
HRCT示右中上肺大片炎症伴实变影、磨玻璃影,右侧胸腔积液伴双侧胸膜增厚粘连

图2 入院治疗2周后复查胸部HRCT表现
HRCT示双肺以中上肺为主的多发实变影、结节影及磨玻璃影,部分病变内可见支气管充气征,双侧少量胸腔积液
(二)临床思辨
【临床特点】
1.患者为中年男性,起病急,既往有骨髓增生异常/骨髓增殖性肿瘤(MDS/MPN)及粒细胞减少症1年。
2.主要症状和体征为高热、胸痛、干咳、气喘,右肺呼吸音低。
3.实验室检查显示贫血、肝功能损伤、CRP增高,ESR明显加快,血气分析提示Ⅰ型呼吸衰竭。
4.病灶进展快,影像学检查见右上肺大片实变影、磨玻璃影伴右侧少量胸腔积液发展为双肺多发实变影、结节影及磨玻璃影,部分病变内可见支气管充气征,双侧少量胸腔积液。
5.患者先后接受多种抗感染治疗,包括利奈唑胺、亚胺培南/西司他丁钠、阿奇霉素、替考拉宁、莫西沙星、伊曲康唑、醋酸卡泊芬净及更昔洛韦等,仍有高热,而且肺内病变有加重趋势,治疗无效。
【思辨要点】
临床上,肺部疾病的常见症状和体征包括发热、胸痛、咳嗽、气喘,双肺多发实变影、磨玻璃影、结节影。这些表现并无病因特异性,许多疾病均可表现为同样的症状和体征。
对疑似感染性肺疾病者,在确立诊断的过程中首先需要思考以下问题:本病例是不是感染?如果是感染,可能是哪种感染病原?
根据患者临床表现及各项检查结果,首先考虑为肺部感染,结合患者有血液系统疾病、多次住院史及影像学改变,需要考虑细菌及真菌感染。患者曾先后使用氟喹诺酮类、碳青霉烯类、大环内酯类、利奈唑胺、替考拉宁、伊曲康唑及卡泊芬净等抗感染药物,所覆盖的病原体包括肺炎链球菌、流感嗜血杆菌、金黄色葡萄球菌、非典型病原(肺炎支原体、肺炎衣原体和军团菌)、革兰阴性菌(肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌等)和厌氧菌等,但治疗2周病情未见好转,复查胸部CT提示病灶进展,由右上肺实变影发展为双肺广泛磨玻璃影、实变影及结节影。所用抗菌药物未覆盖的病原体包括病毒(巨细胞病毒、EB病毒)、真菌(肺孢子菌)和个别细菌(结核分枝杆菌)等。此外,需要重点排查相关非感染性疾病。
1.感染性疾病
(1)病毒感染
本例患者有MDS及粒细胞减少症病史,细胞免疫功能受抑制,不能排除患巨细胞病毒性肺炎和EB病毒性肺炎的可能。病毒性肺炎外周血WBC多表现为正常或降低,病情要么短期内迅速加重,发展为重症肺炎,甚或急性呼吸窘迫综合征(ARDS),要么呈自限性,逐渐好转,很少呈迁延状态或亚急性过程。胸部HRCT可表现为双肺弥漫性磨玻璃影、实变影(图3、图4)。对于本病例,可做巨细胞病毒及EB病毒DNA检查及相关病毒抗体检查以进一步排除。


图3 巨细胞病毒肺炎胸部影像学表现
女性患者,46岁,咳嗽1个月余,高热伴胸闷、气喘1周,患白血病化疗后1个月余。胸部HRCT示双肺弥漫性实变影,沿支气管血管束分布。血清及支气管肺泡灌洗液中巨细胞病毒DNA明显增高,诊断为巨细胞病毒性肺炎

图4 EB病毒性肺炎HRCT表现
女性患者,58岁,高热伴咳嗽10余天,患糖尿病10余年。胸部HRCT示双肺实变影、磨玻璃影。支气管肺泡灌洗液EB病毒DNA明显增高,诊断为EB病毒性肺炎
(2)真菌感染
真菌感染常继发于免疫功能低下和粒细胞缺乏状态,主要病原体为曲霉菌和肺孢子菌。
肺曲霉菌病:典型的曲霉菌感染表现为结节影、空洞影、实变影,可有晕轮征和新月征改变,也可见空洞(图5)。本例患者有MDS/MPN及粒细胞减少症病史,曾高度怀疑曲霉菌感染,但先后使用伊曲康唑及卡泊芬净治疗后未见好转,虽然不符合曲霉菌感染的特点,但仍须进行G试验、GM试验、反复痰真菌培养,必要时行支气管肺泡灌洗液(BALF)培养以及经支气管肺活检(TBLB)病理以排除曲霉菌感染。
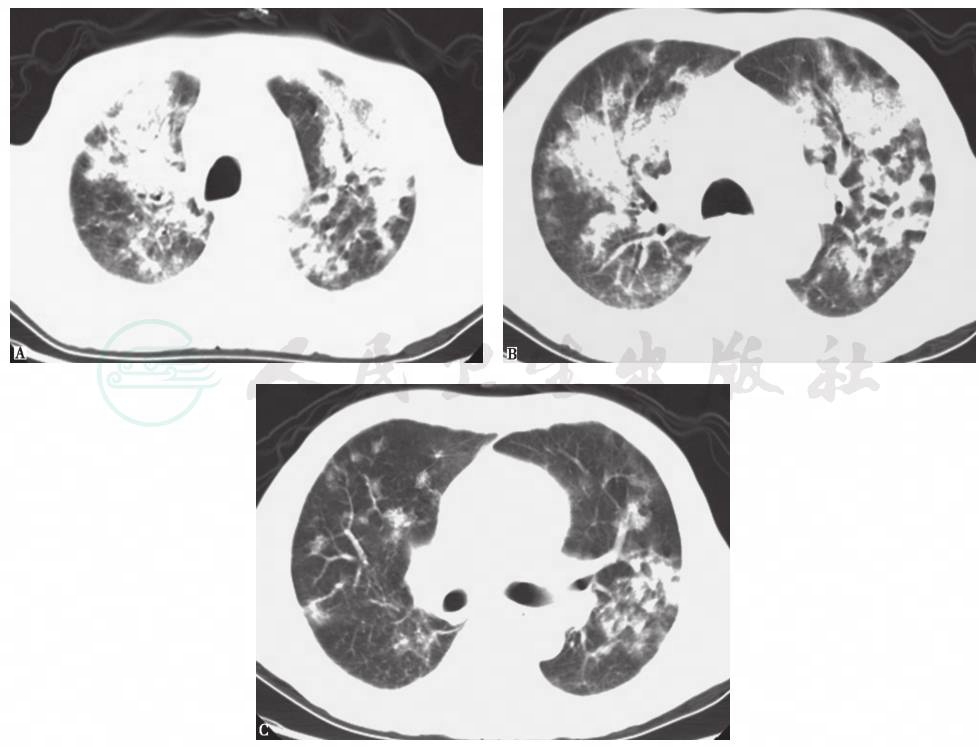
图5 侵袭性肺曲霉菌病HRCT表现
女性患者,62岁,发热、咳嗽伴胸闷、气喘1周。胸部HRCT示双肺多发性实变影、结节影,沿支气管血管束分布,以双侧中上肺为主。GM试验阳性,痰真菌培养曲霉菌阳性,确诊为侵袭性肺曲霉菌病
肺孢子菌肺炎(PCP):当患者出现发热、干咳、呼吸困难的临床表现,双肺出现弥漫性磨玻璃影、实变影,同时伴有细胞免疫功能低下,要考虑PCP。PCP是在AIDS患者中首先发现的,是AIDS患者最常见和最严重的机会性感染。AIDS合并PCP患者可出现发热、胸闷、气喘,肺部常无阳性体征,外周血CD4+T淋巴细胞计数明显降低,血气分析提示低氧血症或Ⅰ型呼吸衰竭,乳酸脱氢酶(LDH)及β-D-(l、3)-葡聚糖增高,肺通气及弥散功能障碍,HIV抗体阳性。AIDS合并PCP的典型胸部HRCT表现为两侧肺门周围对称性磨玻璃影、实变影、结节影,由肺门向外周肺野发展并有融合趋势,可伴有不同程度网状影或小叶间隔增厚,可形成铺路石征,伴有纵隔淋巴结肿大,部分可见肺气囊、少量胸腔积液、牵拉性支气管扩张等征象(图6)。
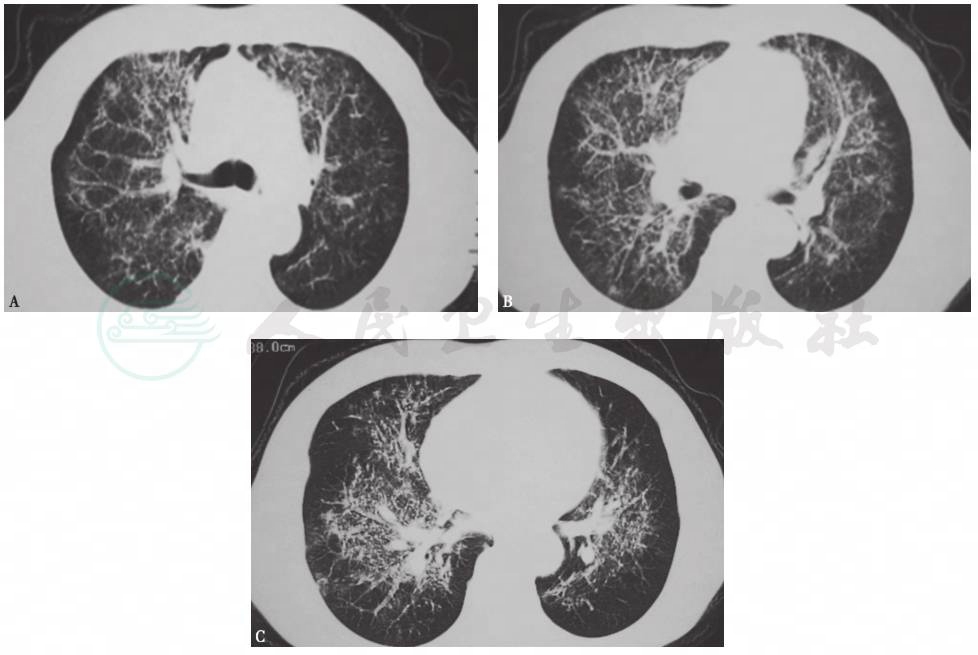
图6 肺孢子菌肺炎HRCT表现
男性患者,50岁,发热伴胸闷、气喘1个月。胸部HRCT示两肺沿支气管血管束的网状实变影。HIV阳性,TBLB病理为肺孢子菌感染,确诊为AIDS合并PCP
该病的确诊依靠病原学检查,可通过深部痰液、BALF、肺活检病理检查找到肺孢子菌。本例患者有血液系统基础病,有细胞免疫功能抑制,应详细询问有无冶游史、输血史等特殊病史,可查CD4+T淋巴细胞计数、LDH、β-D-(1,3)-葡聚糖及HIV抗体以进一步排除。除了AIDS外,长期应用糖皮质激素和免疫抑制剂、进行化疗/放疗以及器官移植的患者,若发热、干咳、胸痛、呼吸困难等症状,胸部HRCT显示磨玻璃影伴实变影、囊性改变 (图7),CD4+T淋巴细胞计数明显降低、LDH增高、β-D-(1,3)-葡聚糖增高,应高度怀疑HIV阴性PCP。本例患者有血液系统疾病,不排除细胞免疫功能抑制后HIV阴性的PCP,可行CD4+T淋巴细胞计数、LDH、β-D-(1,3)-葡聚糖检查,必要时行支气管肺泡灌洗(BAL)及经支气管肺活检(TBLB)进一步排查。
念珠菌感染:念珠菌所致原发性肺感染的概率很低,诊断难度大,多为导管相关性或抗菌药物所致的二重感染,罕见原发感染。本例患者未留置体内导管,且使用对念珠菌敏感的伊曲康唑及卡泊芬净治疗无效,故念珠菌感染的可能性较小。


图7 肺孢子菌肺炎HRCT表现
女性患者,30岁,高热伴咳嗽半个月,有肾移植手术史。胸部HRCT示双肺弥漫性磨玻璃影、实变影、结节影及囊性改变。TBLB病理确诊PCP
(3)肺结核
是呼吸系统的常见病、多发病。常见症状有低热、盗汗、咳嗽、咯血、消瘦、乏力等。影像学表现有多形态、多部位及多钙化的特点。胸部HRCT示多发性结节影、实变影,可伴有空洞、胸腔积液、纵隔淋巴结肿大等改变。临床上有一些肺结核患者,可表现为发热、干咳、胸闷、气喘,胸部HRCT出现类似间质性肺炎改变,两肺弥漫性磨玻璃影、实变影、结节影,沿支气管血管束的网状影,痰检结核分枝杆菌常为阴性,经常被误诊为间质性肺炎(图8),需要TBLB病理以明确诊断。本例患者胸部HRCT两周内明显进展,不符合肺结核较慢的发展病程,但仍要加强排查,可反复查痰找抗酸杆菌以及查血清结核抗体、血沉、T淋巴细胞刺激γ-干扰素释放试验、PPD试验,必要时行BALF及TBLB检查以排除。


图8 肺结核HRCT表现
男性患者,74岁,发热4个月,咳嗽、活动后气喘1个月。胸部HRCT示两肺弥漫性磨玻璃影、结节影,右下叶实变影。肺穿刺活检示肉芽肿改变,诊断为肺结核
2.非感染性疾病
对于本例患者,要确定是否为非感染性疾病,首先要与风湿免疫病等所致的继发性间质性肺炎、恶性肿瘤(淋巴瘤、肺泡细胞癌)、间质性肺疾病(机化性肺炎、肺泡蛋白沉积症、过敏性肺炎、急性间质性肺炎等)、弥漫性肺泡出血、肺水肿等进行鉴别。
(1)风湿免疫病
临床表现除发热外,往往伴有肾、关节、皮肤、肌肉和血液等多系统损伤,单一累及肺组织者少见,自身抗体、免疫功能等一项或多项检查结果可呈阳性。当累及肺组织时,大多表现为双肺弥漫性间质损伤或弥漫性肺泡出血(图9)。本例患者发病呈现亚急性发展,抗感染治疗无效,虽然无多系统损害,但仍需检查自身抗体、抗中性粒细胞胞质抗体、免疫球蛋白亚型、血沉、尿常规及肾功能等以排除之。
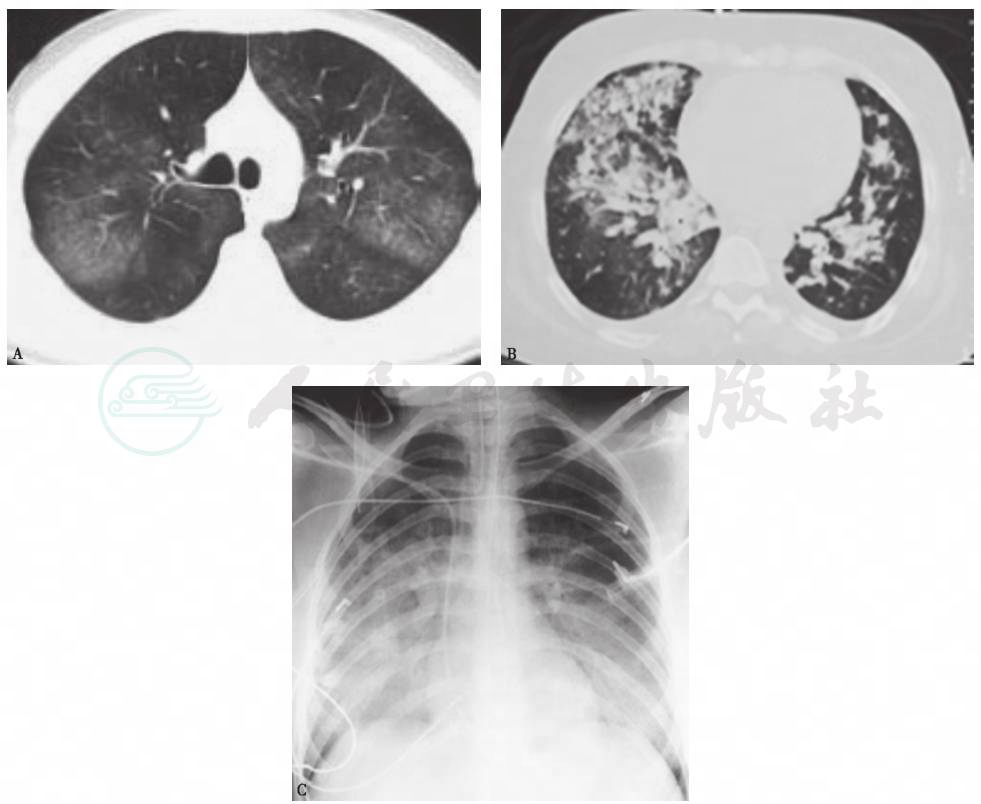
图9 系统性红斑狼疮伴发弥漫性肺泡出血胸部影像学表现
女性患者,42岁,咯血伴气喘10余天,有系统性红斑狼疮病史10余年。胸部HRCT(A、B)及X线片(C)示双肺弥漫性磨玻璃影、实变影、结节影。诊断为系统红斑狼疮伴发弥漫性肺泡出血
(2)肿瘤
淋巴瘤:是起源于淋巴结和淋巴组织的血液系统恶性肿瘤,可分为霍奇金淋巴瘤和非霍奇金淋巴瘤两大类。其发生大多与免疫应答过程中淋巴细胞增殖分化产生某种免疫细胞恶变有关,也属于免疫系统恶性肿瘤。由于淋巴结和淋巴组织遍布全身且与单核-巨噬细胞系统、血液系统相互沟通,故淋巴瘤可以发生在身体任何部位。肺部也是淋巴瘤侵犯的常见部位。淋巴瘤侵犯肺部的临床表现为发热、咳嗽、胸闷、气喘等,胸部HRCT变现为多发性结节影、大片实变影(图10),经常被误诊为肺部感染,须行肺穿刺病理检查(图11)以明确诊断。本例患者临床发展过程呈亚急性,2周后病灶即从右上肺大片实变影发展为双肺弥漫性实变影、磨玻璃影,比一般淋巴瘤进展快,但仍需要肺穿刺病理检查来明确。

图10 NK/T细胞淋巴瘤HRCT表现
男性患者,39岁,间断高热4个月,咳嗽伴胸闷、气喘1个月余。胸部HRCT示双肺以肺门为中心的大片实变影、磨玻璃影,支气管血管束增粗。肺穿刺活检病理示NK/T细胞淋巴瘤
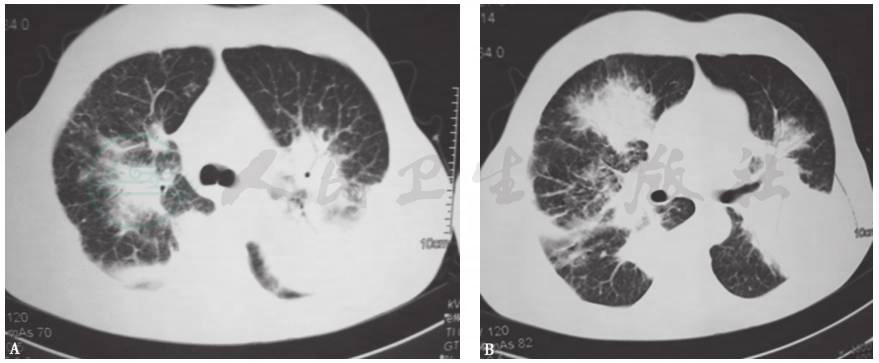

图11 淋巴瘤胸部HRCT表现
男性患者,53岁,胸闷、气喘半年,加重伴咳嗽2周。胸部HRCT示双肺多发实变影、磨玻璃影、结节影。肺穿刺活检病理示淋巴瘤
细支气管肺泡细胞癌(BAC):是肺腺癌的一种特殊亚型,又称细支气管肺泡癌,多见于女性。癌细胞沿细支气管、肺泡管和肺泡壁生长,不侵犯肺泡间隔。根据影像学表现,肺泡细胞癌可分为结节型和弥漫型两类,后者形态类似肺炎,可出现磨玻璃影、实变影、多发性结节影,在实变影中可见支气管充气征、枯树枝征,病变按叶或段分布(图12、图13)。BAC的临床表现差异很大,主要与其细胞来源和形态学类型有关。临床症状主要为咳嗽、咳大量白黏痰、胸闷、气喘、呼吸困难,伴感染时有发热。BAC具有惰性发展趋势,早期生长可相当缓慢,影像学表现可稳定数年不变化。本例患者的胸部影像学表现类似于BAC,但病情发展较快,2周就有明显变化,故基本可排除BAC,但仍需肺活检病理结果证实。
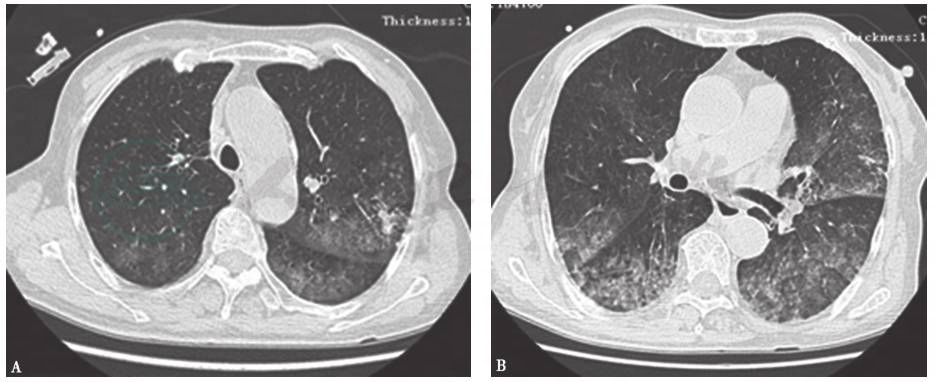

图12 肺泡细胞癌HRCT表现
女性患者,73岁,咳嗽4个月,加重伴活动后气喘半个月。胸部HRCT示双肺弥漫性磨玻璃影、结节影,右下肺融合成实变影。CT引导下经皮肺穿刺活检病理示肺泡细胞癌


图13 肺泡细胞癌HRCT表现
男性患者,46岁,反复发热、咳嗽、胸闷气喘1年余。胸部HRCT示双肺弥漫性磨玻璃影、实变影。CT引导下经皮肺穿刺活检示肺泡细胞癌
(3)间质性肺疾病
隐源性机化性肺炎(COP):是以肺泡内、肺泡管、呼吸性细支气管及终末细支气管腔内有机化性肉芽组织为病理特点,对糖皮质激素反应良好的间质性肺疾病。胸部HRCT示多发性肺泡实变影、磨玻璃影,可伴有支气管充气征,病变部分可有游走,也可表现为不规则形条索阴影,沿支气管血管束分布(图14、图15)。临床症状有发热、咳嗽、胸闷、气喘,肺部可闻及爆裂音,病程一般为亚急性发展。本例患者的临床特征、影像学特点及发展过程与COP极为相似,目前急需肺活检病理检查以进一步明确诊断。


图14 隐源性机化性肺炎HRCT表现
男性患者,71岁,发热伴咳嗽、咳痰6个月余,加重伴气喘1个月余。胸部HRCT示双肺多发性肺泡实变影、磨玻璃影,可伴有支气管充气征。CT引导下经皮肺穿刺病理示COP

图15 隐源性机化性肺炎HRCT表现
女性患者,19岁,反复咳嗽、气喘1个月余。胸部HRCT示不规则形条索阴影、实变影,沿支气管血管束分布。CT引导下经皮肺穿刺病理示COP
肺泡蛋白沉积症(PAP):是以肺泡及终末呼吸性细支气管内富含类似肺泡表面活性物质的脂蛋白样物质沉积为特点的少见肺部疾病,90%以上为特发性,主要是由于患者体内粒细胞-巨噬细胞集落刺激因子(GM-CSF)自身抗体导致肺泡-巨噬细胞成熟障碍,对表面活性物质的清除能力下降,使得正常表面活性物质在肺泡内积聚过多所致。临床症状、体征与胸部影像学表现不平行是该病的特征之一。临床症状有咳嗽、气喘、呼吸困难等;约1/2患者为隐袭起病,可无症状;少数病例可有低热和咯血;体格检查一般无特殊阳性发现。胸部HRCT可呈磨玻璃影、斑片状阴影,伴小叶内间隔和小叶间间隔增厚,呈铺路石征,病变对称或不对称性,有时可见支气管充气征,病变与周围肺组织间常有明显界限且边界不规则,形成较具特征性的地图样改变(图16、图17)。BALF中以巨噬细胞为主,也可以淋巴细胞为主,PAS染色阳性。本例患者的临床特征、影像学特点与PAP有部分相似之处,但PAP发展过程较慢,临床症状相对较轻,而本例患者症状较重,且胸部HRCT进展较快,不符合PAP的临床特点,可予以BALF检查以排除。

图16 肺泡蛋白沉积症HRCT表现
男性患者,45岁,活动后气喘1年,加重1个月。胸部HRCT示双肺磨玻璃影、斑片状阴影,伴小叶间间隔增厚,呈铺路石征及地图样改变。BALF示PAS染色阳性,确诊为PAP
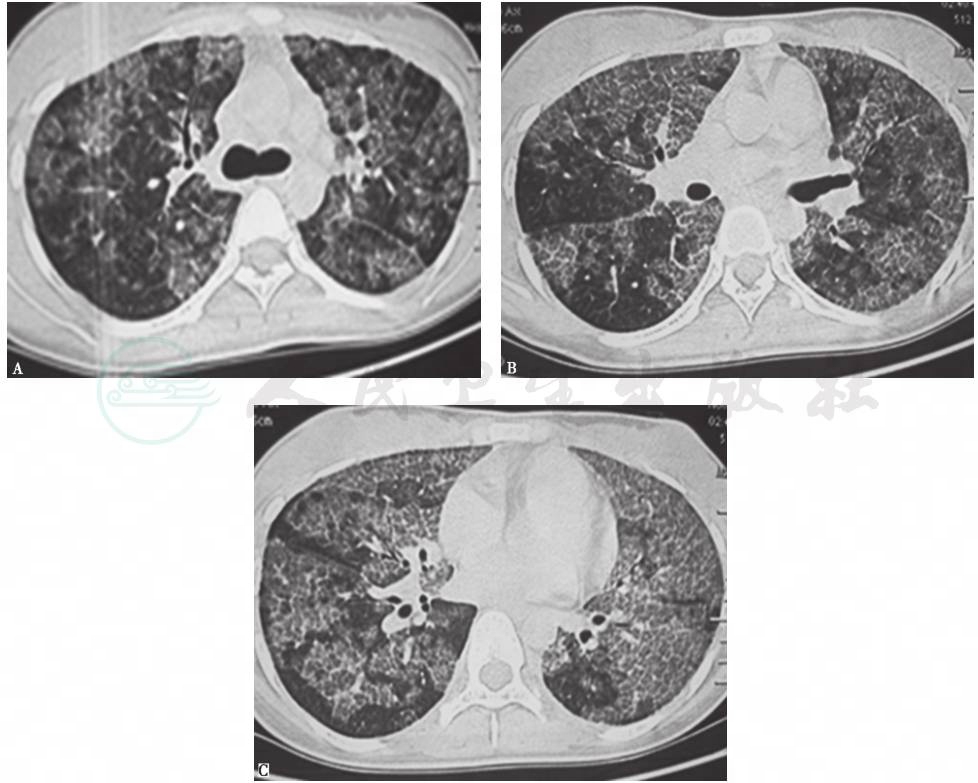
图17 肺泡蛋白沉积症HRCT表现
女性患者,21岁,活动后气喘3年,加重1个月。胸部HRCT示双肺弥漫性磨玻璃影、斑片状阴影,伴小叶间隔增厚,呈铺路石征、地图样改变。BALF示PAS染色阳性,确诊为PAP
过敏性肺炎(HP):也称外源性过敏性肺泡炎(EAA),是一组由于个体反复吸入外界某些具有抗原性的有机粉尘所引起的变态反应性肺部炎症,以间质性肺炎、细胞性细支气管炎和肉芽肿为病理特征。HP代表一组疾病,原因各异,但发病机制、病理、临床表现、影像学、治疗和预后相似,故亦可称之为症状群。HP可分为急性、亚急性和慢性3种。其主要临床症状为呼吸困难、咳嗽、咳痰、发热、体重减轻;血气分析为低氧血症;肺功能检查显示限制性通气功能障碍及气体交换障碍;胸部HRCT主要表现为双肺弥漫性磨玻璃影、斑片影、小叶中心性结节影、马赛克征和网格影或伴蜂窝肺;BALF示肺泡淋巴细胞增加;TBLB病理表现为淋巴细胞浸润为主的肺泡炎、非干酪性坏死性肉芽肿及间质性肺炎。急性HP的HRCT表现为双肺磨玻璃阴影、斑片状阴影,边缘模糊,密度及分布不均,短时间内病灶位置变化大且具有游走性(图18)。亚急性HP的HRCT表现为弥漫性分布的小叶中心性结节影,边缘不清,斑片状磨玻璃影,气体陷闭征与肺囊性改变。慢性HP的HRCT表现为网格状、蜂窝状纤维索条影(为肺间质纤维化改变)。本例患者的胸部HRCT表现与急性HP类似,疾病发展过程类似于亚急性改变,但无抗原吸入史,还需BALF及TBLB进一步排除。


图18 急性过敏性肺炎胸部HRCT表现
男性患者,28岁,咳嗽、气喘、呼吸困难1天,有油漆吸入史。胸部HRCT示双肺弥漫性磨玻璃影、实变影及边界不清的结节影。TBLB病理示肉芽肿和淋巴细胞性细支气管炎,诊断为急性HP
急性间质性肺炎(acute interstitial pneumonia,AIP):为一种原因不明的急性进行性间质性肺炎,既往称为Hammer-Rich综合征或特发性ARDS。大多数患者起病急剧(数日至数周内),表现为突然发热、干咳,继发感染时可有脓痰,伴有胸闷、进行性呼吸困难。胸部HRCT表现为双肺弥漫性高密度磨玻璃影、实变影,继之发展为牵拉性支气管扩张和蜂窝肺(图19)。临床上,此类患者多需要机械通气维持,病死率极高(>60%),多数患者在1~2个月内死亡。本病例病程为亚急性状,虽然有低氧血症,但不似AIP发展迅速,也不需要机械通气,可暂不考虑AIP诊断,但必要时可行病理检查排除之。

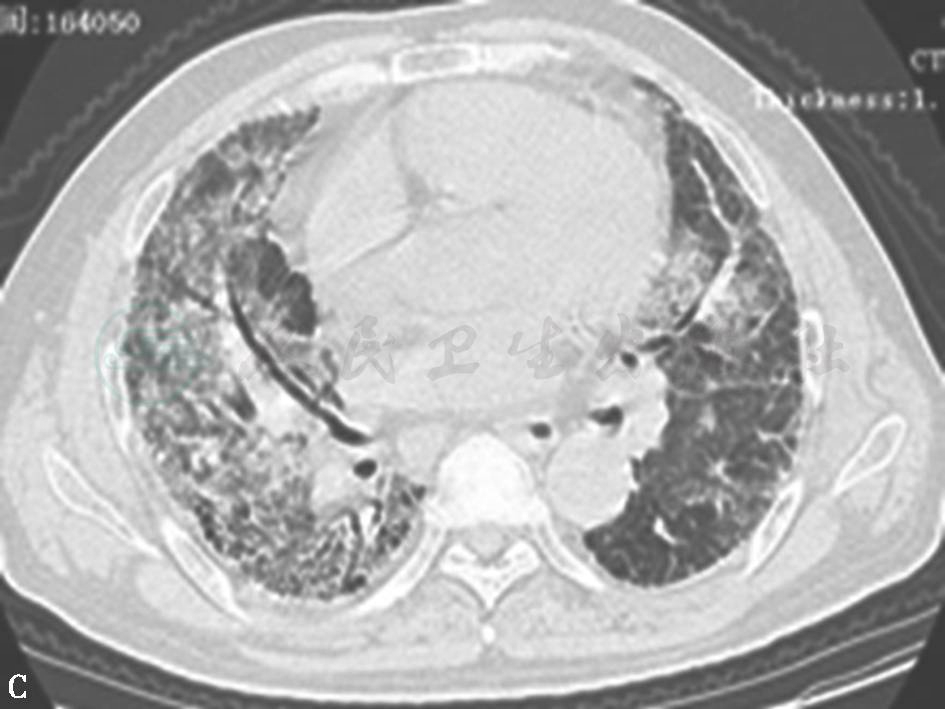
图19 急性间质性肺炎胸部HRCT表现
女性患者,65岁,高热、气喘6天,既往身体健康。胸部HRCT示双肺弥漫性磨玻璃样实变影、网状影,牵拉性支气管扩张。诊断为AIP
(4)弥漫性肺泡出血综合征(diffuse alveolar hemorrhage syndrome,DAHS)
是以咯血、贫血和弥漫性肺泡浸润或实变为特征的临床综合征,临床少见,但病情凶险,常威胁患者生命。DAHS起病急骤,临床表现为发热、咳嗽、咯血、气短,并出现贫血和低氧血症。胸部HRCT表现为两肺或单侧肺弥漫性肺泡充填性、融合性实变阴影(图20)。支气管肺泡灌洗可见多肺段回收液呈血性,出血48小时后吞噬含铁血黄素肺泡巨噬细胞比例>20%,普鲁蓝染色阳性。
DAHS可见于病因和发病机制完全不同,而临床表现却非常相似的一组异质性疾病,针对不同疾病采取的治疗措施不同,其预后也截然不同。DAHS治疗首先是针对基础疾病的治疗,在急性期,大剂量肾上腺皮质激素是首选方案,有低氧血症者需机械通气呼吸支持,同时须进行抗感染和支持治疗。本例患者的HRCT表现与DAHS相似,但无咯血和贫血表现,可复查血常规及BALF以排除之。
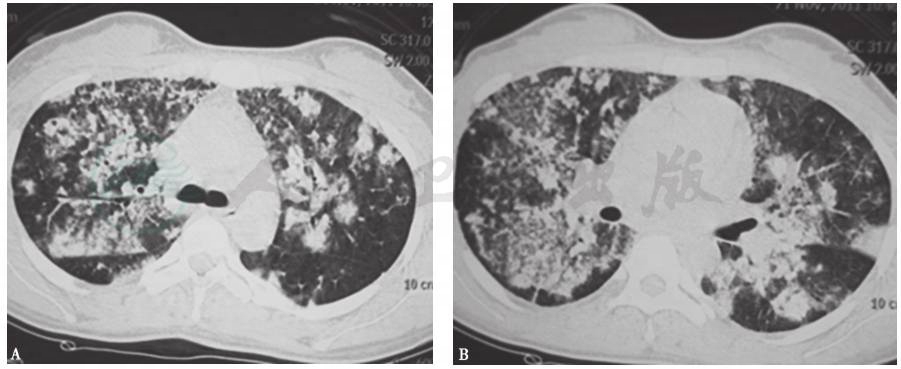
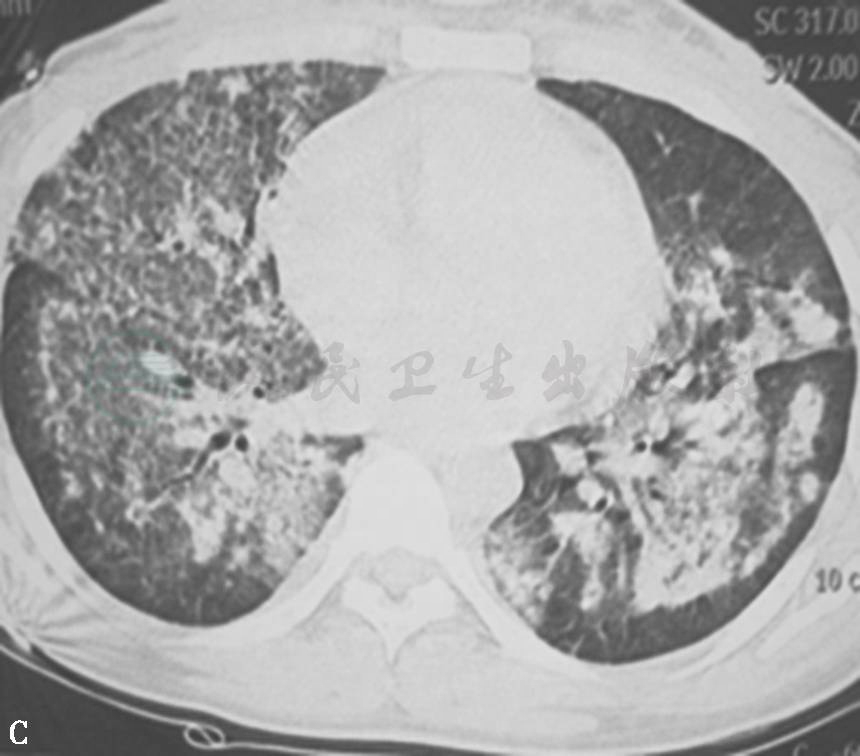
图20 弥漫性肺泡出血综合征胸部HRCT表现
女性患者,24岁,咯血伴胸闷、气喘10余天。胸部HRCT示双肺弥漫性磨玻璃影、实变影、结节影。Hb 70g/L。诊断为DAHS
(5)肺水肿(PE)
是指由于各种原因引起肺血管外液体量过度增多蓄积于肺间质和(或)肺泡内,形成间质性和(或)肺泡性肺水肿。临床表现为呼吸困难,咳嗽、咳白色或血性泡沫痰,两肺散在湿啰音。肺水肿的影像学表现可分为间质性和肺泡性两种。肺泡性肺水肿影像学表现为小叶中心型腺泡状阴影,不规则、相互融合的模糊实变影,双肺内中带分布,或局限于一侧或一叶,典型者表现为从肺门两侧向外扩展,逐渐变淡,形成典型的蝴蝶状阴影,可伴有胸腔积液(图21、图22)。肺水肿患者经强心、利尿等治疗,症状可迅速缓解。本病例与肺泡性肺水肿相似,HRCT示双肺磨玻璃影、实变影及少量胸腔积液,临床症状有胸闷、气喘,但肺水肿病情发展快,且有脑钠肽(BNP)增高,利尿消肿治疗可快速缓解症状,而本例患者无心肺基础疾病,BNP正常,故基本可排除肺水肿。

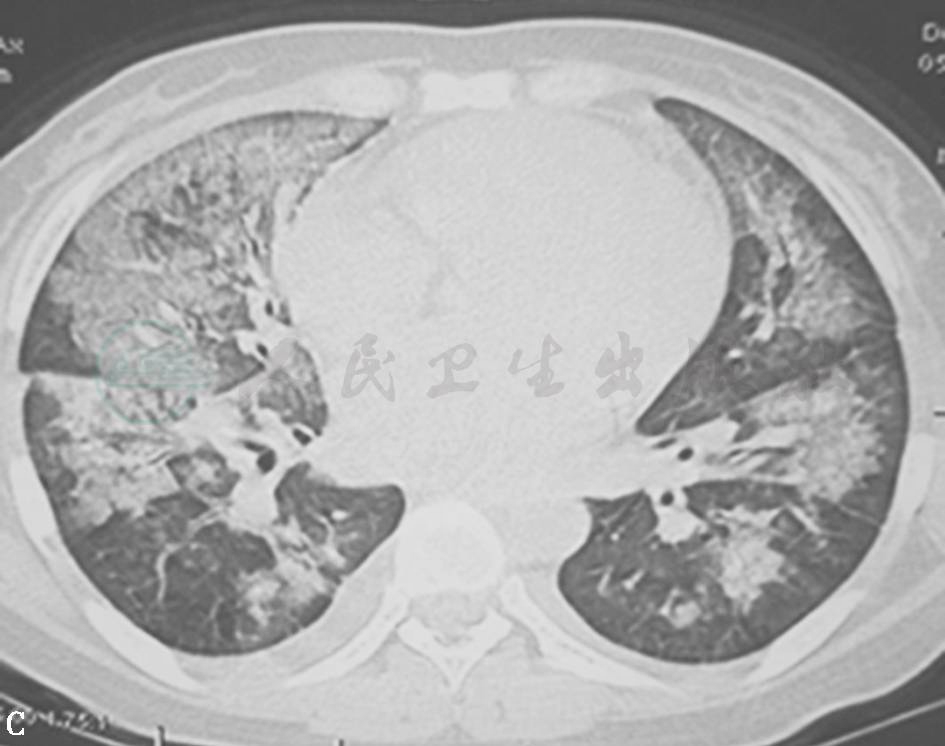
图21 肺水肿胸部HRCT表现
女性患者,21岁,咳嗽、气喘1个月,加重1天。胸部HRCT示双肺弥漫性磨玻璃影、实变影,伴小叶间隔增厚,以中下肺为主,双侧少量胸腔积液。BNP 900pg/ml。经利尿治疗后病变明显吸收。诊断为肺水肿

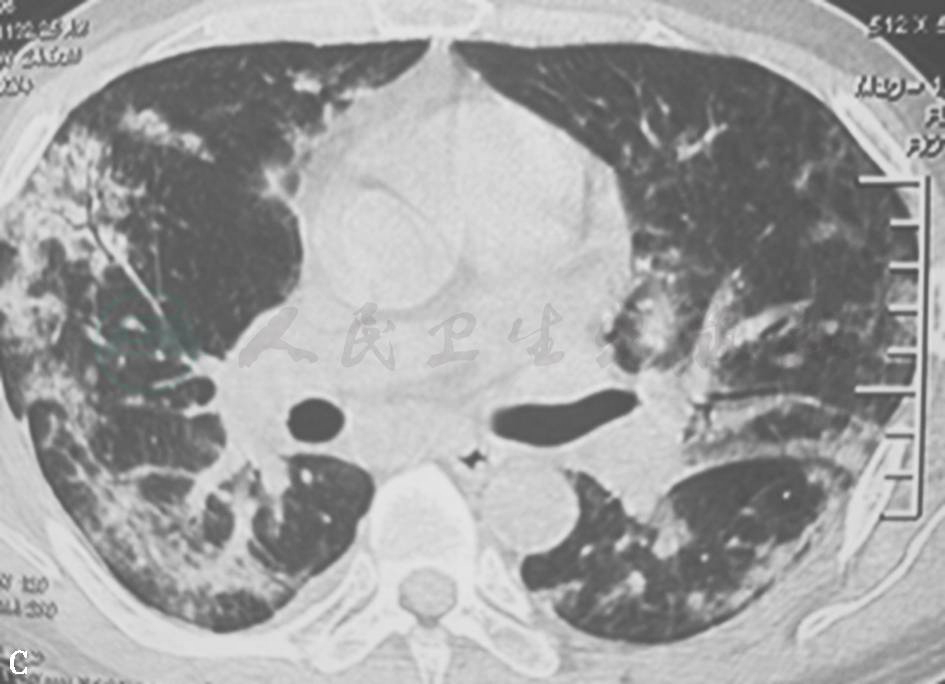
图22 肺水肿胸部HRCT表现
女性患者,39岁,呼吸困难2天。胸部HRCT示双肺弥漫性磨玻璃样实变影、小叶中心型结节影。BNP 2100pg/ml。经利尿后病变明显吸收。诊断为肺水肿
综上所述,本病例为由细菌、病毒和真菌引起感染的概率很小,但还不能排除结核分枝杆菌、非结核分枝杆菌或诺卡菌等特殊病原菌引起的感染,并且需要进一步完善相关检查,排除可能的非感染性因素所致疾病。
(一)临床信息
【实验室检查】
1.一般检查
血常规(多次检查):WBC(6.3~14.2)×109/L,N% 58.0%~83.6%,Hb 85~9.2g/L,PLT正常。
ESR 93~106mm/1h。
肝功能:①入院时,ALT 298.5U/L,AST 155.1U/L ;②保肝治疗后,ALT 103U/L,AST 72U/L。
2.免疫相关检查
自身抗体(包括抗中性粒细胞胞质抗体、抗核抗体、抗可提取核抗原多肽抗体谱、抗dsDNA抗体、抗Sm抗体、抗线粒体抗体)阴性;血清补体、类风湿因子、免疫球蛋白和IgE水平正常。
3.感染相关检查
降钙素原(PCT)0.42μg/ml;CRP 83.9mg/L;PPD试验、T-SPOT均阴性;血清病原抗体(包括梅毒螺旋体、结核分枝杆菌、肺炎支原体、肺炎衣原体、军团杆菌、包虫等)均阴性;真菌检测(G试验和GM试验)均为阴性;EB病毒和巨细胞病毒DNA及抗体IgM均为正常。支气管肺泡灌洗液(BALF)病毒核酸检测均阴性(包括流感病毒、腺病毒、呼吸道合胞病毒感染、鼻病毒等15种)。血培养2次,均阴性。痰病原检测(包括普通细菌、真菌、抗酸染色和寄生虫)5次,均阴性;大便抗酸染色和寄生虫检测均阴性;人类免疫缺陷病毒(HIV)抗体阴性。
4.肿瘤相关检查
血清肿瘤标志物(包括NSE、CA72-4、CAl99、CAl25、CAl53、PSA和CEA)均正常,痰查肿瘤细胞阴性。
5.血气分析(吸入氧浓度2L/min)
pH 7.47,PaO2 61mmHg,PaCO2 32mmHg。
【支气管镜检查】
双肺各叶段支气管通畅(图23),未见气管、支气管内明显异常。BALF细胞总数0.45×106/ml,中性粒细胞百分比45.5%,淋巴细胞百分比50.0%。

图23 支气管镜检查镜下表现
A.气管隆嵴;B.右主支气管;C.右中间段支气管;D.左主支气管
【影像学检查】
经常规抗感染治疗后,复查胸部HRCT可见双肺多发病灶加重(图2)。
(二)临床思辨
患者入院后所做系列检查显示:①血沉较入院前明显增快,提示原有病变仍在加重;②自身抗体检测均阴性,结合临床表现,基本可排除风湿免疫病;③支气管镜检查见肺内气道通畅,未见任何阻塞征象,刷片未找到抗酸杆菌及脱落细胞,故基本可以排除因肿瘤、感染、结核等阻塞性原因导致的阻塞性肺炎;④BALF分类淋巴细胞比例增高;⑤胸部HRCT示右上肺实变影发展为双肺多发实变影、结节影及磨玻璃影,病灶游走;⑥常规病原学检查均阴性;⑦多次血气分析示低氧血症;⑧抗感染治疗无效。这些表现不支持感染性肺疾病诊断,故考虑本病例为非感染性疾病可能性大,且高度怀疑为特发性间质性肺炎(IIP),特别是COP可能性大。
(一)临床信息
CT引导下右上肺穿刺活检病理示肺泡腔内纤维蛋白球形成,肺泡管和细支气管内成纤维细胞呈息肉状延伸(机化),伴纤维素样红染物质,肺泡间隔略增宽,散在淋巴细胞、浆细胞浸润,符合急性纤维素性机化性肺炎(acute fibrinous and organizing pneumonia,AFOP)表现(图24)。
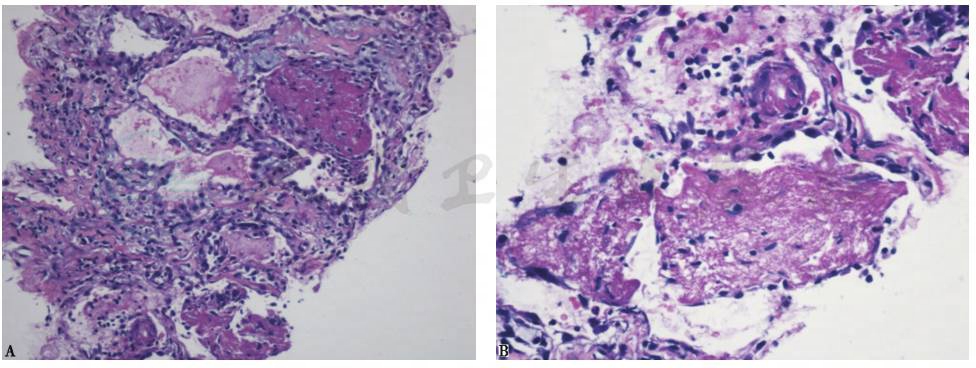
图24 经皮肺穿刺活检以及经支气管肺活检病理表现
肺泡腔内可见大量纤维蛋白球形成、机化组织和炎性细胞浸润(A.HE染色,200×;B.HE染色,400×)
最后诊断:急性纤维素性机化性肺炎。
经甲泼尼松龙160mg/d静脉滴注治疗5天,减为80mg/d治疗5天,再减为40mg/d治疗3天,再改为泼尼松40mg/d口服。激素治疗1个月后,患者临床症状明显好转,无胸痛、胸闷、气喘,复查肝功能、CRP、ESR及血气分析均正常,胸部CT显示实变影、结节影明显吸收,遗留有少许片状影和索条影(图25)。
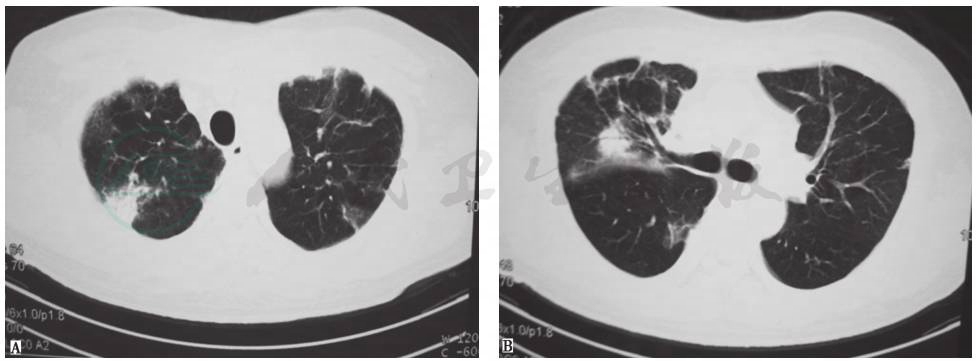

图25 激素治疗1个月后复查胸部CT表现
(二)临床思辨
AFOP呈急性或亚急性起病,最早由Beasley等提出。他们对一组(17例)急性/亚急性肺损伤患者进行开胸活检或尸检,病理分析后发现一种新的急性弥漫性肺损伤类型,其共同病理特征为肺泡腔内纤维蛋白球形成,肺泡管和细支气管内可见机化性肺炎(OP)时出现的机化组织,而无肺泡内透明膜形成,不伴有明显嗜酸性粒细胞浸润。这些病理特征不同于弥漫性肺泡损伤(DAD)、COP、嗜酸性粒细胞性肺炎(eosinophils pneumonia,EP),故Beasley等将其命名为AFOP。
引起AFOP的病因多种,包括特发性和继发性原因,如结缔组织疾病、细菌感染、病毒感染、慢性肾功能不全、药品不良反应、淋巴瘤、糖尿病、器官移植等,也可能与环境暴露有关。从Beasley等报道后,Hwang等和Cincotta等先后报道了两组急性肺损伤患者,其肺组织病理也同样存在AFOP特征。
AFOP中纤维素球形成的机制尚不明确,可能与DAD中形成透明膜的机制类似。纤维素球及透明膜均源于肺泡毛细血管血浆中的纤维蛋白。肺泡损伤后,毛细血管内的蛋白浆液渗进肺泡腔内,水分在通气过程中干燥、吸收,纤维蛋白贴附沉着于肺泡内壁,形成嗜伊红均质透明膜,形成的纤维素球与此相似。因此,AFOP可能与肺泡壁毛细血管损伤及出血有关。
AFOP的临床表现与急性肺损伤相似 ,但缺乏特异性。AFOP多呈急性或亚急性过程,临床症状为进行性气喘、咳嗽、发热、胸痛、咯血。肺部听诊可闻及捻发音或帛裂音(Velcro音)。实验室检查可有WBC计数、CRP增高;血气分析主要为低氧血症;肺功能检查主要为限制性通气功能障碍及弥散量减低;影像学表现主要为呈两肺弥漫性、斑片状分布的实变影、结节影、磨玻璃影,伴有支气管充气征,还可表现为小叶间隔增厚、铺路石征、网格状,病变变化快,可从单侧进展成双侧,病变可游走,少数可有胸腔积液,无纵隔和肺门淋巴结肿大。若单纯抗感染治疗,病灶通常进展、扩大,使用激素治疗后病变吸收、好转。亚急性AFOP对糖皮质激素治疗的反应较好,预后较好,几乎所有患者都不需要机械通气。急性AFOP临床表现为成人ARDS症状,病理表现为典型DAD,几乎所有患者都需要机械通气辅助治疗,预后不佳。机械通气是唯一的与预后相关的因素。有些学者将AFOP分为亚急性(与COP相似)和急性(与ARDS相似)两种临床类型。
AFOP目前尚无统一的诊断标准,其临床症状及影像学表现与COP类似,一般基于胸闷、气喘、咳嗽、发热及胸痛等的临床特点以及影像学表现(如游走性实变影、磨玻璃影)可考虑该病,并依靠特征性病理改变做出最终诊断。临床上,诊断AFOP,需要与DAD、COP、EP等相鉴别。
AFOP典型的病理表现为肺泡腔内纤维蛋白球形成,同时肺泡管和细支气管内可以见到机化组织,没有透明膜形成,不伴有明显的嗜酸性粒细胞浸润,无肉芽肿形成。
DAD典型的病理表现为大量透明膜形成。其早期为肺渗出性改变,包括肺泡隔毛细血管淤血、间质水肿增宽、肺泡腔内蛋白性水肿液渗出伴透明膜形成、肺间质及肺泡腔内多少不等的炎症细胞浸润等(图26)。随着病变进展,晚期可见纤维组织增生、Ⅱ型肺泡上皮增生等。DAD透明膜呈均质嗜伊红的膜状物形态,镜下所见与AFOP的纤维素样物质相似,但后者呈团块状,周边或内部可见增生的成纤维细胞。此两种病变镜下较易鉴别。许多报道提出,二者常同时并存。Hwang等报道,AFOP和DAD组织学形态同时存在于30%(6/20)的病例中,在活检标本中较难鉴别。笔者认为,若显微镜下见两种形态混合存在,应结合临床考虑DAD的可能,若病变中透明膜形成较少,可考虑为特发AFOP。
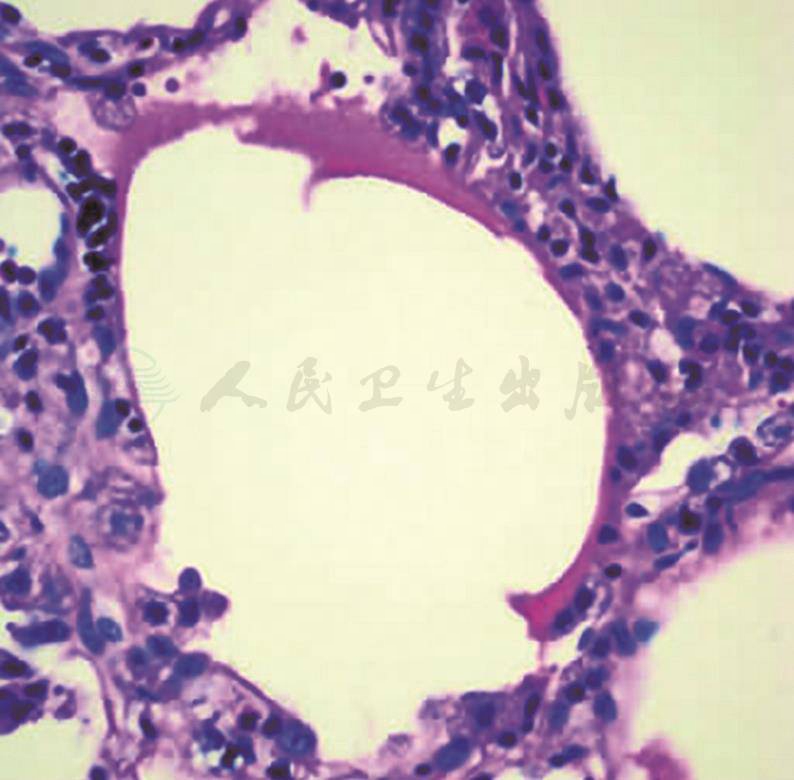
图26 DAD透明膜
肺泡腔内见嗜伊红的均质膜状物衬覆于肺泡腔内壁,肺泡间隔示慢性炎症细胞浸润(HE染色,400×)
COP的典型病理表现为呼吸性细支气管、肺泡管和肺泡内有疏松结缔组织形成的息肉样肉芽肿,形成Masson小体,肺泡内几乎没有纤维素沉积(图27)。COP与AFOP的组织表现关系较密切,AFOP纤维素球中几乎均有不同程度的机化。纤维素样物质过少、机化组织明显时,宜诊断COP,因为此类病变的本质可能是激素治疗效果不佳的Ⅱ型COP。根据相关临床及病理学研究,Beasley等报道的AFOP也可能是代表COP病变进展中的某个阶段,亚急性起病的AFOP在病程及预后方面接近典型COP。

图27 COP病理改变
纤维细胞增生形成Masson小体填充肺泡腔,其内可见纤维素样物质形成纤维球结构(HE染色,200×)
EP可引起急性肺损伤的临床表现,组织学上既可见DAD样透明膜形成,也可见纤维素沉积,肺组织中大量嗜酸性粒细胞浸润(图28)。Beasley等报道17例AFOP中有6例出现嗜酸性粒细胞浸润,但浸润程度较轻,亦无嗜酸性粒细胞脓肿形成,因此不能依此判断这些病例与EP有密切关系。值得注意的是,激素治疗可降低嗜酸性粒细胞浸润程度,因此曾有部分具有嗜酸性粒细胞浸润AFOP病例被认为可能是经过不完全治疗的EP。对AFOP样改变伴嗜酸性粒细胞浸润的病例,应结合临床表现排除激素使用、变态反应等对形态学的影响。

图28 EP病理表现
肺间质、肺泡和毛细血管内可见大量嗜酸性粒细胞浸润(HE染色,200×)
肺泡内纤维蛋白球形成和机化并非AFOP的特异性改变,有时在特殊病原肺部感染和肺肉芽肿性疾病等也可见到类似病理表现。因此,诊断AFOP需要临床、影像学和病理学检查密切结合。目前,对AFOP是否为一种独立病理类型的间质性肺炎,尚存在争议。Beasley等提出,AFOP可能为DAD变异体,不代表一种独立的疾病实体;Hwang等及Cincotta等认为,AFOP是急性肺损伤的一个发展过程,DAD为早期急性肺损伤的组织病理改变,而AFOP可能是晚期急性肺损伤的组织病理学改变。近年来,国内有越来越多的临床及病理报道,支持AFOP是一种新型独立的间质性肺炎。
AFOP目前尚无统一的治疗方案,主要是应用糖皮质激素,但其剂量和疗程尚不统一。一般采用甲泼尼龙冲击治疗及口服泼尼松序贯治疗,预后较好。
高热、胸痛、气喘伴肺部实变影、磨玻璃影是呼吸系统疾病常见的临床病症之一,须考虑感染性疾病。但本例患者经过规范抗感染治疗后,病情及病灶仍在进展,所使用的抗感染药物覆盖了大部分细菌及真菌,对于未覆盖的病毒(巨细胞病毒和EB病毒)、真菌(肺孢子菌)及特殊病原菌(结核分枝杆菌)感染,临床证据均不支持,因此应重点排查非感染性疾病。
对于非感染性疾病,要排除风湿免疫病等所致的继发性间质性肺炎、弥漫性肺泡出血、肺水肿和恶性肿瘤(淋巴瘤、肺泡细胞癌)等,须重点考虑间质性肺病(机化性肺炎、肺泡蛋白沉积症、过敏性肺炎和急性间质性肺炎等),肺穿刺活检有助于明确诊断。
AFOP的病理表现需要与DAD、COP及EP相鉴别。AFOP病因多样,临床和影像学无特征性,但由于其病理和转归模式有一定独特性,目前确定为一种特殊类型的间质性肺炎。对于临床上若遇到发热、胸痛、气喘,肺部出现弥漫性实变影、磨玻璃影,抗感染疗效不佳的患者,除COP外,还要考虑AFOP的可能。
(邱玉英 蔡后荣)
1.Beasley MB,Franks TJ,Galvin JR,et al.Acute fibrinous and organizing pneumonia :a histological pattern of lung injury and possible variant of diffuse alveolar damage.Arch Pathol Lab Med,2002,126:1064-1070.
2.Prahalad S,Bohnsack JF,Maloney CG,et al.Fatal acute fibrinous and organizing pneumonia in a child with juvenile dermatomyositis.J Pediatr,2005,146:289-292.
3.Hariri LP,Unizony S,Stone J,et al.Acute fibrinous and organizing pneumonia in systemic lupus erythematosus :a case report and review of the literature.Pathol Int,2010,60(11):755- 759.
4.Valim V,Rocha RH,Couto RB,et al.Acute fibrinous and organizing pneumonia and undifferentiated connective tissue disease :a case report.Case Rep Rheumatol,2012,2012(9):549298.
5.Hwang DM,Chamberlain DW,Poutanen SM,et al.Pulmonary pathology of severe acute respiratory syndrome in Toronto.Mod Pathol,2005,18:1-10.
6.Cincotta DR,Sebire NJ,Lim E,et al.Fatal acute fibrinous and organizing pneumonia in an infant:The histopathologic variability of acute respiratory distress syndrome.Pediatr Crit Care Med,2007,8:378-382.
7.Heo JY,Song JY,Noh JY,et al.Acute fibrinous and organizing pneumonia in a patient with HIV infection and Pneumocystis jiroveci pneumonia.Respirology,2010,15(8):1259-1261.
8.Ribera A,Llatjós R,Casanova A,et al.Chlamydia pneumonia infection associated to acute fibrinous and organizing pneumonia.Enferm Infecc Microbiol Clin,2011,29(8):632-634.
9.Kobayashi H,Sugimoto C,Kanoh S,et al.Acute fibrinous and organizing pneumonia :initial presentation as a solitary nodule.Thorac Imaging,2005,20:291-293.
10.Lee SM,Park JJ,Sung SH,et al.Acute fibrinous and organizing pneumonia following hematopoietic stem cell transplantation.Korean J Intern Med,2009,24(2):156- 159.
11.Vasu TS,Cavallazzi R,Hirani A,et al.A 64-year-old male with fever and persistent lung infiltrate.Respir Care,2009,54:1263-1265.
12.Sverzellati N,Poletti V,Chilosi M,et al.The crazy-paving pattern in granulomatous mycosis fungoides :high-resolution computed tomography-pathological correlation.J Comput Assist Tomogr,2006,30:843-845.
13.Jarbou M,Yusof M,Coberly E,et al.Acute fibrinous and organizing pneumonia.Chest,2006,130:300S.
14.Yoshinouchi T,Ohtsuki Y,Kubo K,et al.Clinicopathological study on two types of cryptogenic organizing pneumonitis.Respir Med,1995,89(4):271-278.
15.Beasley MB.The pathologist's approach to acute lung injury.Arch Pathol Lab Med,2010,134(4):719 -727.
16.张捷,方秋红,冯瑞娥,等.急性纤维素性并机化性肺炎一例及文献复习.中华结核和呼吸杂志,2010,33(12):892-895.
17.邱玉英,苗立云,蔡后荣,等.急性纤维素性机化性肺炎五例临床和影像及病理分析.中华结核和呼吸杂志,2013,36(6):425-430.
18.冯安宁,孟凡青.急性纤维素性机化性肺炎的研究进展.临床与实验病理学杂志,2013,29(7):775-778.













