(一)病例信息
【病史】
男性患者,57岁,半年前出现活动后气促,伴厌食、体重减轻,未予诊治,气促呈进行性加重。3个月前,患者于外院就诊,胸部CT提示双肺弥漫病变,诊断为双侧间质性肺炎,予激素治疗(甲泼尼龙或泼尼松抗炎累积剂量3530mg)、抗感染及对症治疗后,症状未见明显改善,复查胸部CT提示病灶较前进展,气促加重。20天前,患者无诱因出现反复发热,最高体温达39℃,伴畏寒、咳嗽、咳痰,气促症状进一步加重。患者自发病以来,精神欠佳,睡眠尚可,食欲稍差,大小便正常,体重有所下降(具体不详)。
患者有痛风、高血压病史,在采石场从事采石工作10年,长期在当地山上挖竹笋,有吸烟、饮酒史,否认吸毒、冶游史。
【体格检查】
体温36.5℃,心率73次/分,呼吸25次/分,血压145/93mmHg,SpO2 90%(FiO2 33%)。急性面容,神志清楚,全身皮肤未见皮疹、结节,全身各浅表淋巴结未触及肿大;双肺呼吸音粗,双肺可闻及散在湿啰音;心律齐,未闻病理性杂音;肝、脾肋下未触及,双下肢无水肿。
【辅助检查】
胸部CT:入院前3个月胸部CT示双肺弥漫性间质病变,可见磨玻璃和斑片高密度影,伴部分间质纤维化(图1)。予激素、抗感染及对症治疗后复查胸部CT,见双肺间质性病变较前增多。
肺功能检查:FEV1/FVC 76.11%,弥散功能中度减退,限制性通气功能障碍。
支气管镜检查:镜下见左、右主支气管及双侧各叶段支气管表面见多发散在白色黏稠分泌物附着;支气管肺泡灌洗液未找到肿瘤细胞;小块黏膜病理检查见慢性炎症,黏膜上皮增生。复查支气管镜可见各支气管管腔大量脓性分泌物,支气管肺泡灌洗液培养出恶臭假单胞菌。
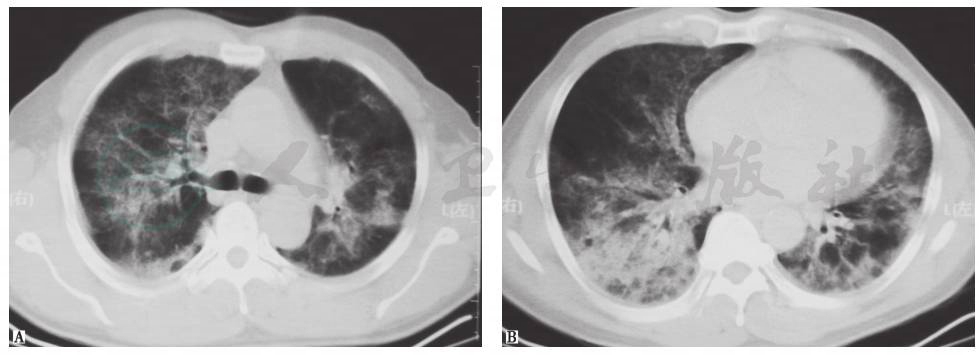
图1 胸部CT表现(2013-02-02)
发病初期,胸部CT见双肺间质弥漫性磨玻璃样渗出伴斑片高密度影,累及叶间裂
(二)临床思辨
【临床特点】
1.患者为中年男性,农民,有粉尘接触史,病程呈慢性(达6个月以上),既往曾使用大剂量激素(外院)。
2.主要症状和体征表现为进行性加重的气促,最终发展为呼吸衰竭,近1个月来伴发热、厌食、体重减轻,双肺闻及散在湿啰音。
3.胸部影像示双肺间质呈弥漫性磨玻璃样渗出伴斑片状实变,病灶分布以肺门为中心;肺功能检查提示弥散功能减退、限制性通气功能障碍;支气管镜检查见支气管各管腔多发散在白色黏稠分泌物及大量脓性分泌物,病理示黏膜慢性炎症;支气管肺泡灌洗液培养出恶臭假单胞菌。
4.发病半年过程中,患者经过抗感染、激素抗炎治疗,病情无好转,肺内病变有加重趋势,治疗反应差。
【思辨要点】
双肺弥漫性病变治疗的关键在于病因诊断。本例患者病情进展是因原发性肺部感染、间质性肺疾病急性加重,还是继发肺部感染所致,鉴别十分困难。
在确立诊断的过程中首先思考以下问题:
1.本病例是否为非感染性肺疾病?
本例患者有长期粉尘接触史,出现呈进行性加重的呼吸困难,影像学检查见双肺间质呈弥漫性磨玻璃样和斑片高密度改变,肺功能检查提示弥散功能障碍,须考虑以下非感染性疾病:
(1)间质性肺疾病
多起病缓慢,最重要的症状是进行性气促、干咳、乏力,多数患者可在双肺底闻及Velcro啰音,晚期缺氧严重者可见杵状指。影像学检查可见弥漫性磨玻璃样改变、小结节影、网状影、支气管充气征,晚期肺容积缩小,可出现蜂窝样改变。肺功能检查主要表现为限制性通气功能障碍和弥散功能下降。动脉血气分析可显示不同程度的低氧血症。常见的间质性肺疾病包括放射性/药物性肺间质损害、尘肺、结缔组织疾病相关间质性肺疾病,其他少见的还有特发性间质性肺炎(idiopathic interstitial pneumonia,IIP)、结节病等。本例患者不存在放射线接触史,且无服用胺碘酮或化疗药物(如博来霉素、丝裂霉素)等病史,故可排除放射性或药物性肺损伤。患者病史长,以进行性加重的气促为主要表现,影像学检查见双肺弥漫性磨玻璃样改变,以间质损害为主,须考虑间质性肺炎可能。其中,常见的结缔组织疾病相关间质性肺疾病(图2)可有发热,但往往伴有肾、关节、皮肤、肌肉和血液等多系统损伤,在出现肺部临床症状时常有较长的结缔组织疾病病史,激素治疗有效,这与本例患者的临床过程不符,但仍须进一步行相应检查以排除。
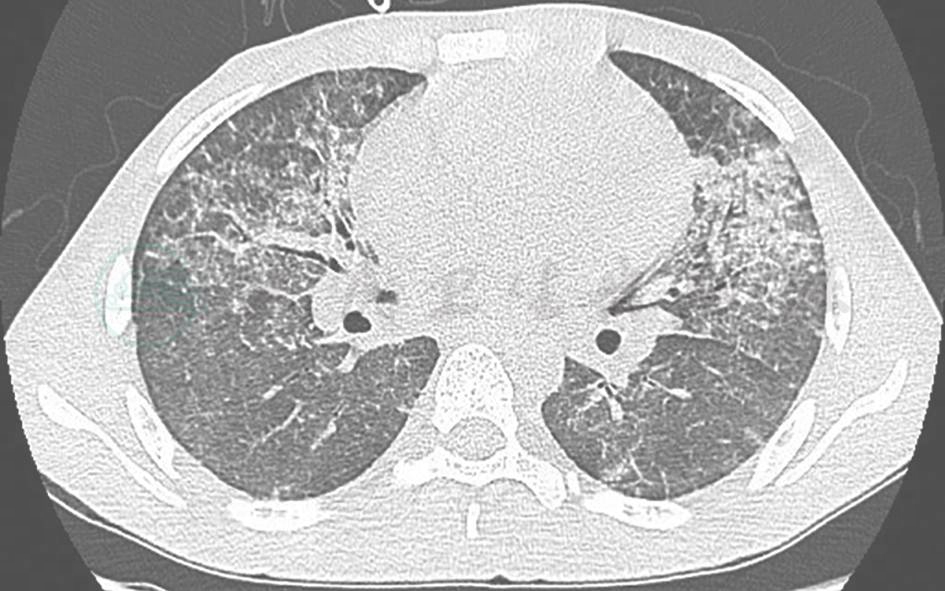
图2 结缔组织疾病并发间质性肺炎胸部CT表现
胸部CT可见双肺弥漫性间质性病变,伴肺内斑片高密度影,小叶间隔增厚
患者有长期粉尘接触史,并出现双肺弥漫病变,须注意有无尘肺,但其影像学检查未见明显结节状改变,与尘肺特征(图3)不符,因此患该病可能性不大。患者影像学检查见双肺弥漫间质病变,以肺门为中心,胸膜下线累及较少,不能排除肺泡蛋白沉积症。综上所述,目前不能排除特发性间质性肺炎、肺泡蛋白沉积症等,需要行肺活检以明确诊断。
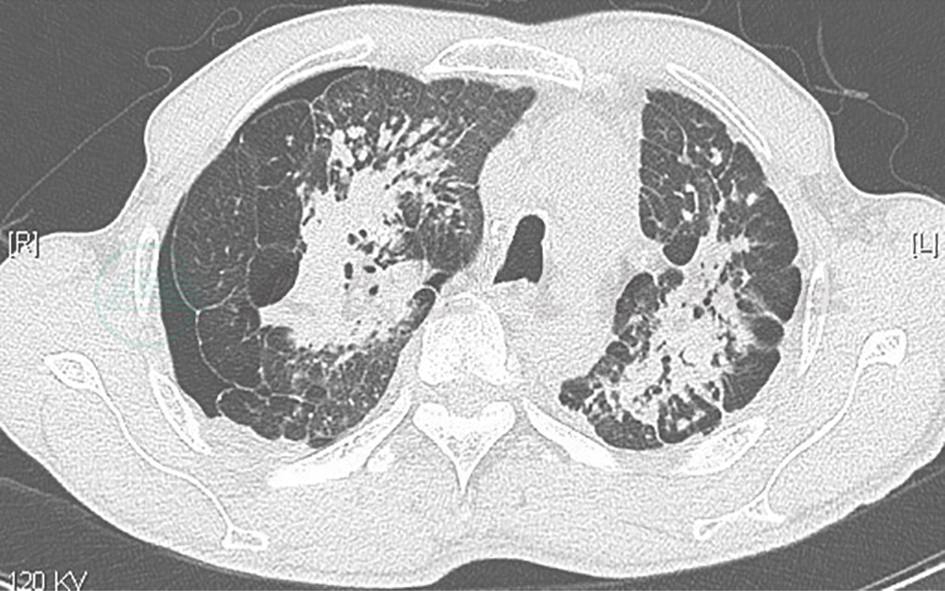
图3 尘肺合并右侧气胸胸部CT表现
胸部CT可见双肺中上肺为主的高密度实变影,肺内结节影伴小叶间隔增厚,间隔旁肺气肿,右侧少量气胸,双侧胸膜肥厚
(2)急性肺水肿
患者常有心脏病、慢性肾病病史;伴下肢、眼睑水肿;胸部CT可见斑片状密度增高影,呈蝶翼状分布,伴间质性肺水肿、胸腔积液,心源性肺水肿还可见心脏增大、肺淤血征象 (图4)。本例患者无心脏病、肾病病史,无咳粉红色泡沫痰,BNP正常,与该病表现不符,故可排除。
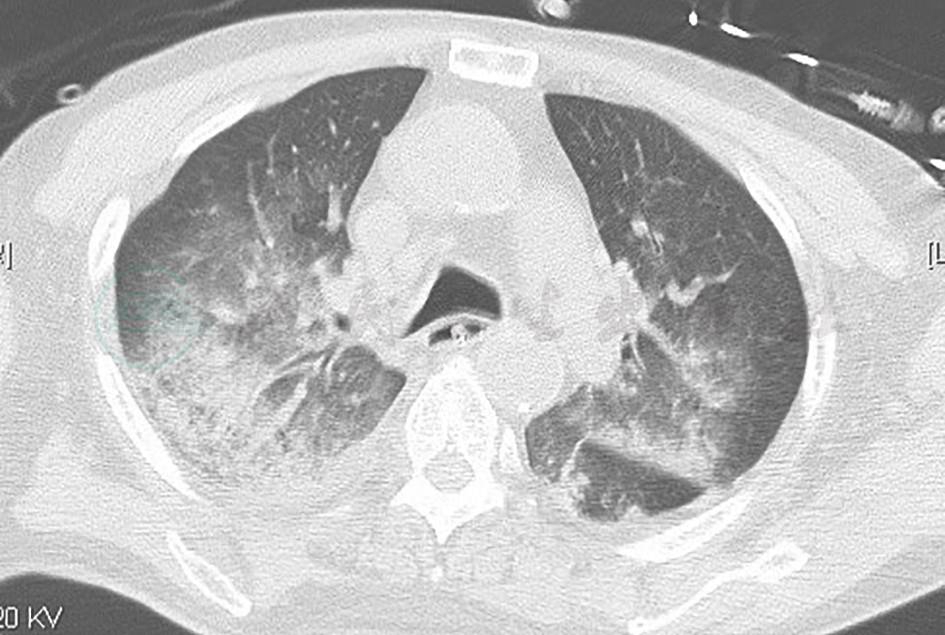
图4 急性心力衰竭肺水肿胸部CT表现
胸部CT可见双肺弥漫性磨玻璃样、实变高密度伴双侧少量胸腔积液
(3)肿瘤性肺间质病变
弥漫性细支气管肺泡癌可出现肺间质性病变,胸部CT可见双肺弥漫斑片状影,伴网格影、支气管气影(图5),可出现进行性气促,多数患者可出现咳大量白色泡沫痰,常伴有肿瘤消耗征象。本例患者临床特征与此不符,故患弥漫性细支气管肺泡癌可能性很小,可查肿瘤标志物、气管镜下活检进一步鉴别。
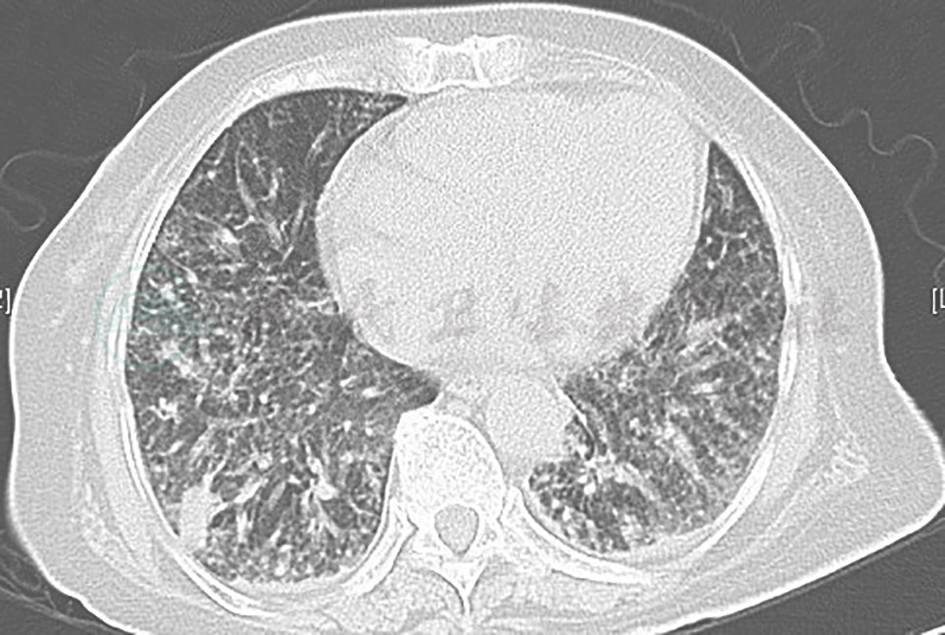
图5 细支气管肺泡癌胸部CT表现
2.本病例是否为感染性疾病?
本例患者近1个月来有发热表现,须考虑存在感染性因素——除间质性肺疾病合并感染之外,还须考虑感染导致双肺弥漫病变的可能。
(1)原发性感染
病原体包括病毒、细菌、支原体、衣原体等,其中以病毒感染所致双肺弥漫性磨玻璃样改变多见。常见病毒有新型甲型流感病毒、人高致病性禽流感病毒、新型冠状病毒SARS等。病毒感染患者多有典型的流行病学史,起病初期有流感症状,病情在短期内急骤加重甚至出现急性呼吸窘迫综合征,双肺呈“白肺”改变,血常规检查提示白细胞计数下降或正常,淋巴细胞比例下降。本例患者肺间质病变时间长,无相应流行病学史,与病毒感染情况不符。
(2)继发机会性感染
原发或继发的免疫功能缺陷综合征合并机会性感染,亦可以首先表现为发热伴双肺弥漫性间质性病变。本例患者有长期大剂量激素服用史,在服用过程中出现发热、急性加重的呼吸困难、急性呼吸窘迫综合征,需考虑继发机会性感染的可能。机会性感染的常见致病菌为巨细胞病毒、肺孢子菌、马尔尼菲青霉菌等。肺巨细胞病毒感染影像学表现为双肺磨玻璃样改变或局部实变 (图6),可查血巨细胞病毒抗体、尿巨细胞病毒DNA,以及行活检(见巨细胞病毒包涵体)帮助确诊。
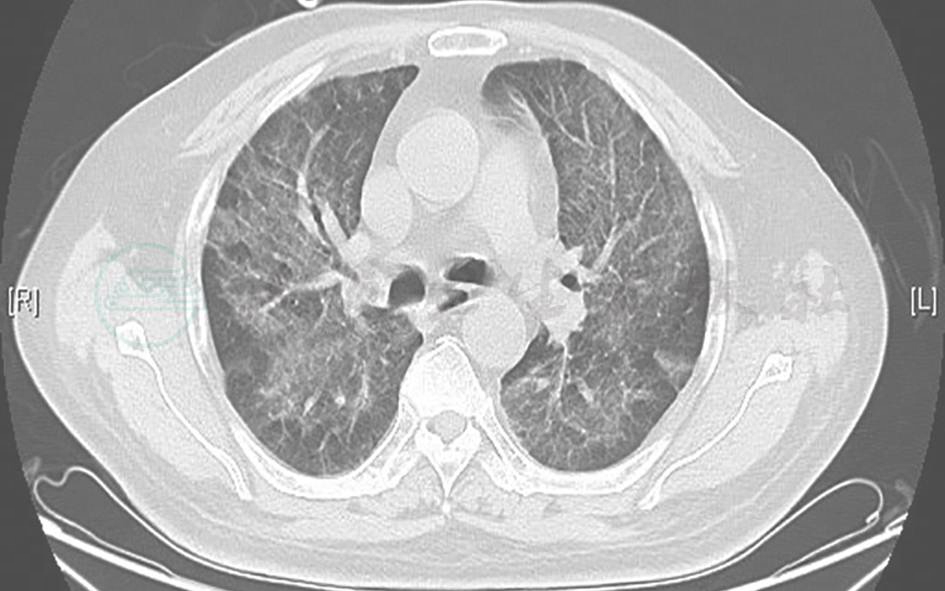
图6 巨细胞病毒性肺炎胸部CT表现
肺孢子菌感染多以干咳常见表现,胸部影像学表现为双肺弥漫间质病变,典型者可见小叶间隔增厚,部分可见kerley线(图7),支气管肺泡灌洗液找到肺孢子菌(GMS染色阳性)有助于确诊。马尔尼菲青霉菌为双相真菌(25℃时表现为酵母相,35℃时表现为菌丝相),严重感染可导致双肺磨玻璃样改变,甚至双肺多发空洞样改变,血培养有助于确诊。
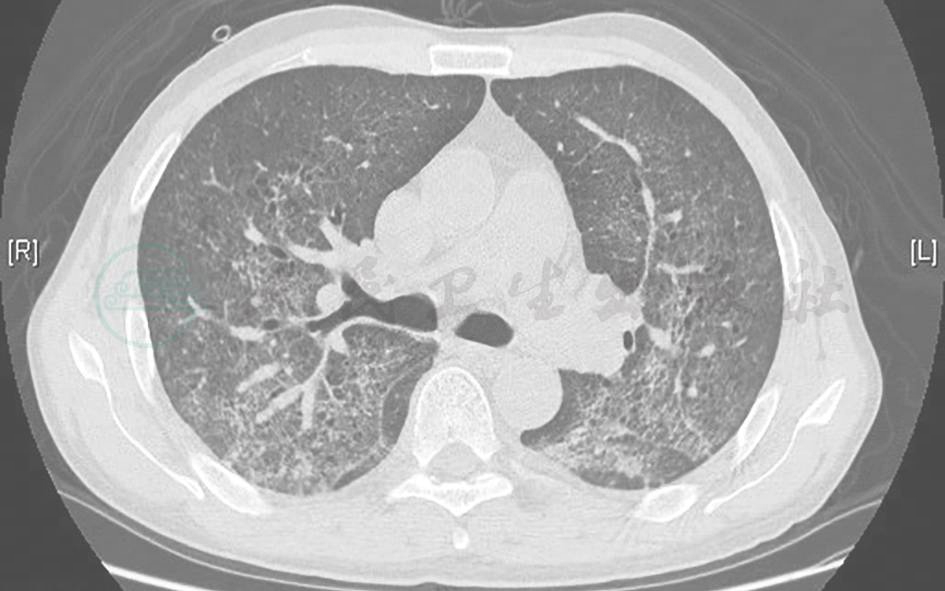
图7 肺孢子菌肺炎胸部CT表现
综上所述,本例病例为间质性肺炎合并感染可能性大,但不能排除感染所致双肺弥漫病变。若是前者,患者激素治疗效果差,须注意排除肺泡蛋白沉积症等其他间质性肺疾病;若是后者,则须重点考虑有无机会性感染。
(一)临床信息
【实验室检查】
1.一般检查
血常规:WBC 12.1×109/L,N% 80%,Hb和PLT均正常。
肝肾功能、电解质均正常。
肿瘤标志物:CEA 14.44ng/ml。
肌钙蛋白I(TnI)、脑钠肽(BNP)正常。
动脉血气分析(FiO241%):pH 7.435,PaCO2 31.4mmHg,PaO2 65.6mmHg,SaO2 92.5%, 21.3mmol/l,氧合指数160mmHg。
21.3mmol/l,氧合指数160mmHg。
2.感染相关检查
PCT 0.51ng/ml,ESR 10mm/1h,CRP 17.10mg/L。
3.免疫相关检查
自身抗体全套、ANCA、环瓜氨酸肽(cyclic citrullinated peptide,CCP)均阴性。
4.病原学检查
呼吸道感染病原体抗体、巨细胞病毒抗体、HIV检测及T淋巴细胞刺激γ-干扰素释放试验均阴性;痰涂片检出革兰染色阳性球菌,革兰染色阴性球菌及杆菌;支气管分泌物及支气管肺泡灌洗液涂片均未找到抗酸杆菌。
【其他辅助检查】
心电图大致正常,全腹B超未见异常。
支气管镜检查:支气管管腔内见少量白色分泌物。右肺中叶支气管肺泡灌洗液较为浑浊,类乳白色。BALF细胞学分类:中性分叶核55%,巨噬细胞27%,淋巴细胞18%。BALF背景见大量急慢性炎症细胞,部分细胞退变,并见大量无结构红染物质,少数核呈泡状的多核巨细胞,GMS染色阴性,PAS染色阳性。支气管毛刷未见肿瘤细胞。支气管黏膜活检示肺支气管黏膜炎症不明显,肺泡腔扩张,腔内见有渗出液,肺泡间隔纤维组织轻度增生,间质少量慢性炎症细胞浸润。
【入院治疗】
患者入院后,予奥司他韦75mg(每天2次),莫西沙星、亚胺培南西司他丁钠、利奈唑胺抗感染及激素逐渐减量治疗,无明显好转,仍发热。
(二)临床思辨
【思辨要点】
入院后系列检查:①WBC、N%、PCT、ESR升高,提示存在感染;②氧合指数160mmHg,无心力衰竭,提示存在急性呼吸窘迫综合征(ARDS)可能;③常规病原学检查均阴性,未找到感染致病菌;④T淋巴细胞刺激γ-干扰素释放试验阴性,痰涂片、支气管分泌物及BALF涂片皆未找到抗酸杆菌,病理未见干酪样坏死样肉芽肿改变,结合临床无结核中毒症状,胸部影像亦不符合结核改变,基本可排除肺结核;⑤血CEA升高2倍,但支气管镜检查BALF及活检结果不支持肺部肿瘤,需要进一步排除;⑥自身抗体及ANCA阴性,且无相应临床症状,因此目前无结缔组织疾病所致肺损害诊断依据;⑦BALF外观浑浊,类乳白色,PAS染色阳性,结合其有粉尘接触史,需考虑肺泡蛋白沉积症。
此外,在覆盖常见致病菌及耐药革兰阳性菌、革兰阴性菌的抗感染治疗情况下,患者发热等症状仍未见好转。
综合以上情况,对于本例患者,需考虑肺间质病变合并感染可能,且不能排除肺泡蛋白沉积症和肺癌。
此时需要思考以下问题。
1.本病例如果存在感染,可能的病原体是什么?
本例患者反复住院并大剂量使用激素,须考虑医院获得性肺炎(HAP)可能,病原体主要以多耐药革兰阴性杆菌为主,但不能排除革兰阳性菌中耐甲氧西林金黄色葡萄球菌(MRSA)感染。大剂量使用激素使机会性感染,如巨细胞病毒感染、肺孢子菌肺炎(PCP)、真菌(如念珠菌、曲霉菌)感染等概率明显增加。
巨细胞病毒性肺炎,可见双肺弥漫性间质性改变,实验室检测外周血白细胞正常或降低,呼吸道分泌物和纤维支气管镜肺组织活检标本内可发现巨细胞内酸性包涵体或血清巨细胞病毒抗体阳性。本病例病程长,血白细胞计数无下降,巨细胞病毒抗体检测阴性,不支持此病诊断。PCP肺炎主要表现为双肺弥漫性磨玻璃样改变伴小叶间隔增厚,常见于免疫功能低下患者。本例患者有相似症状,但BALF及肺活检未见肺孢子菌,GMS染色阴性,不支持该诊断。患者免疫功能低下,常规抗感染治疗效果欠佳,不能排除真菌感染,但其口腔未见白斑,痰培养未检出真菌,诊断依据不足,需要多次痰培养,结合BALF培养或血培养结果进一步鉴别。
综上所述,对于本例患者,首先考虑合并细菌感染,且耐药菌感染可能性大,但不能排除肺孢子菌及真菌感染,须结合病原学资料或抗感染治疗反应来鉴别。
2.对于本例患者,如何选择治疗策略?
鉴于患者外院支气管肺泡灌洗液中培养出恶臭假单胞菌,但针对性抗感染治疗无效,考虑致病菌已改变或出现耐药,故选择碳青霉烯类联合莫西沙星(拜复乐)覆盖多耐药革兰阴性菌及常见各种致病菌抗感染。治疗无效后,加用覆盖MRSA的利奈唑胺(斯沃)进行抗感染治疗。因不能排除病毒感染,加用奥司他韦抗病毒治疗。此外,考虑肺间质炎症可能,不排除肺泡蛋白沉积症,外院激素治疗无效,且激素可使感染进一步加重或不易控制,故予激素逐渐减量。
3.本病例抗感染治疗无效可能有哪些原因?
患者近20天来发热伴咳嗽、咳黄痰,血常规检查示白细胞计数升高,炎症指标升高,BALF中以中性粒细胞为主,故仍考虑存在明确的感染因素。但多种抗感染规律治疗无效,其原因可能包括:①抗感染药物使用不当,未覆盖病原菌,或病原菌耐药;②特殊病原体感染,如结核分枝杆菌、真菌、肺孢子菌、病毒等;③非感染性肺疾病,如恶性肿瘤、肺栓塞、肺水肿等;④出现其他并发症,如肺脓肿、脓胸、感染中毒性休克等。
患者目前肺水肿基本排除,肺栓塞诊断依据不足,肺癌虽然不能排除,但也不能解释高热,相关检查均未提示存在肺脓肿、脓胸等并发症,故目前需考虑最可能的原因是特殊病原体感染,包括结核分枝杆菌、病毒(巨细胞病毒、EB病毒等)和其他真菌(包括肺孢子菌、隐球菌、诺卡菌、马尔尼菲青霉菌等)。这些病原体的临床表现及影像学检查均无特异性,需要病原学检测以确诊。
(一)临床信息
【实验室检查】
复查生化:总蛋白(total protein,TP)111.0mg/dl,血糖6.25mmol/l,乳酸脱氢酶(LDH)338U/L。
肿瘤标志物:CEA 96.98ng/ml。
【其他辅助检查】
胸部HRCT:双肺弥漫性病变伴广泛多发空洞形成(图8),考虑为间质性肺疾病变合并感染(霉菌等特殊感染)可能性大。
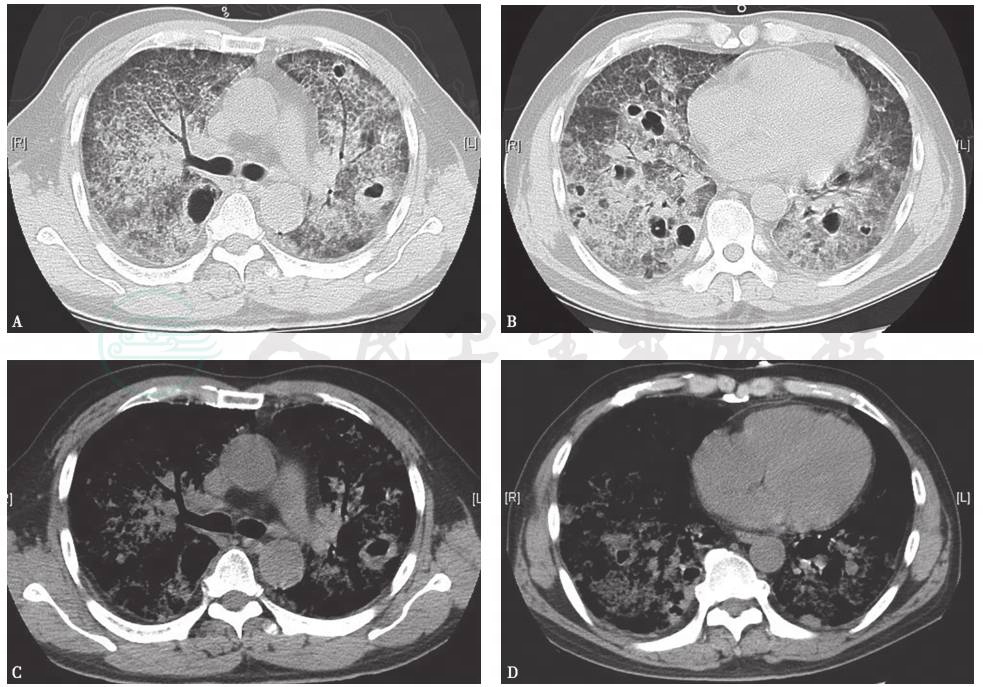
图8 复查胸部HRCT(2013-04-01)
胸部HRCT可见双肺弥漫病变较前加重,且出现双肺多发空洞样改变
电子气管镜检查:各支气管管腔通畅,未见腔内异常(图9)。
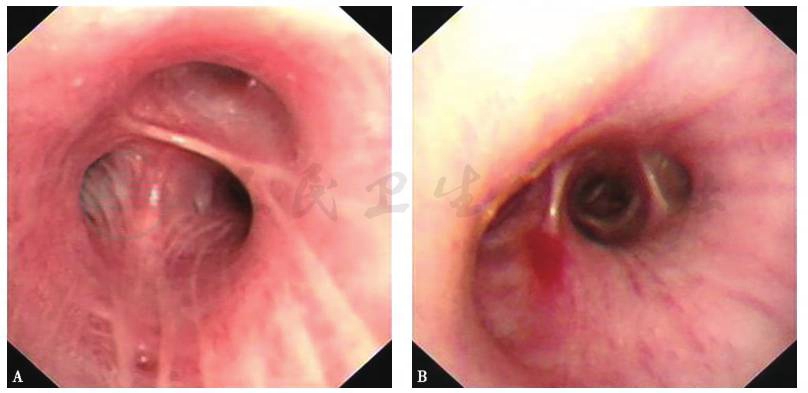
图9 支气管镜镜检查镜下所见
BALF呈乳白色浑浊状;细胞学分类为中性粒细胞43%,淋巴细胞25%,嗜酸性粒细胞4%,巨噬细胞28%;抗酸染色阴性,未见恶性细胞。支气管毛刷、BALF未见瘤细胞。BALF曲霉菌抗原阴性。BALF涂片背景见大量红染无定型物质和退变细胞,PAS染色见颗粒状、红染的阳性物质;少量吞噬细胞内可见疑似马尔尼菲青霉菌(图10)。
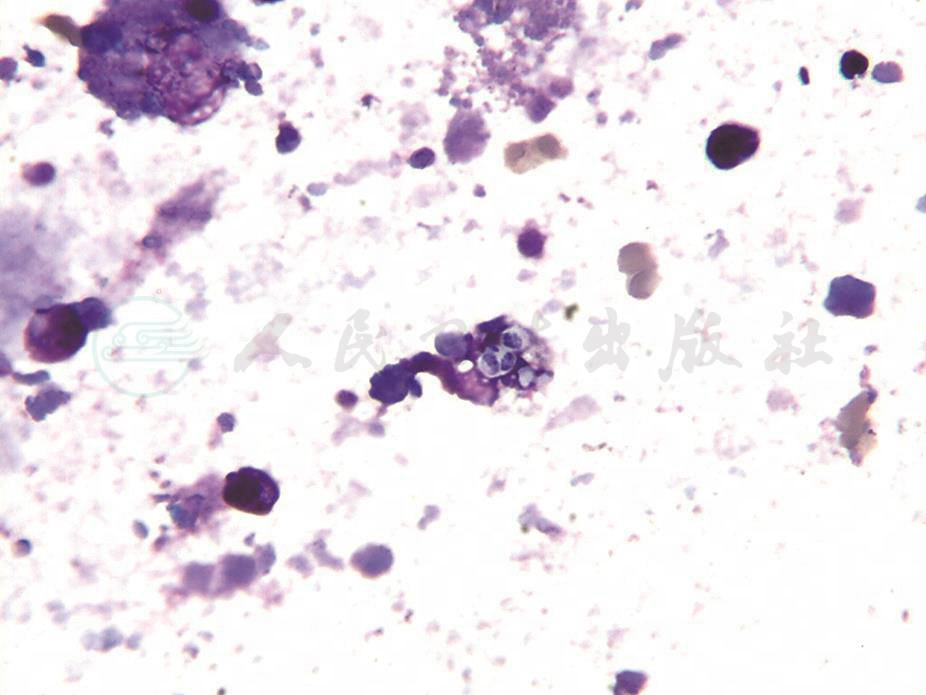
图10 BALF中吞噬细胞内见马尔尼菲青霉菌(HE染色,1000×)
经支气管肺活检:肺支气管黏膜炎症不明显,肺泡腔扩张,腔内有红色渗出液(PAS染色阳性) (图11),肺泡间隔纤维组织轻度增生,间质少量慢性炎症细胞浸润,符合肺蛋白沉着症表现。
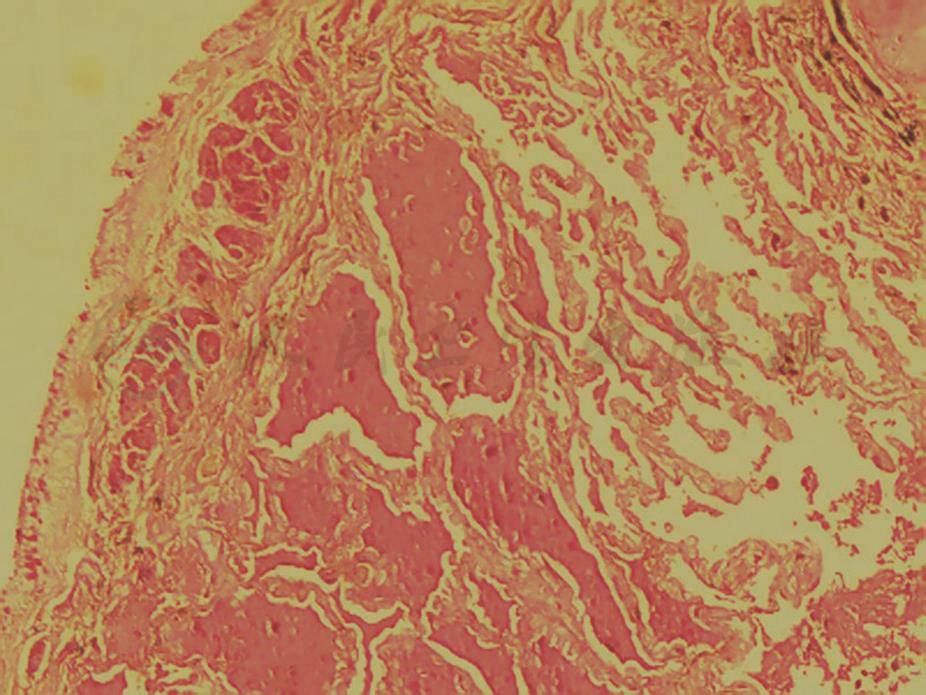
图11 右下叶基底段肺组织病理表现(PAS染色,100×)
血清曲霉菌抗原阴性,两次血培养检出马尔尼菲青霉菌。
骨髓涂片:组织细胞增多,有噬血现象及吞噬,疑似霉菌。
最后诊断:①侵袭性肺部真菌(马尔尼菲青霉菌)感染;②脓毒血症;③肺泡蛋白沉积症。
明确诊断后,予两性霉素B脂质体并逐渐加量至60mg/d[1mg/(kg·d)],联合伊曲康唑200mg (每天1次)静脉滴注,21天后改为口服伊曲康唑200mg(每天2次)抗真菌治疗4个月。患者体温逐渐下降,复查胸部CT较前明显好转(图12~图15)。到2013年8月为止,患者气促症状较前改善,复查胸部CT提示:双肺间质性病变较前明显好转,空洞样改变较前明显吸收。
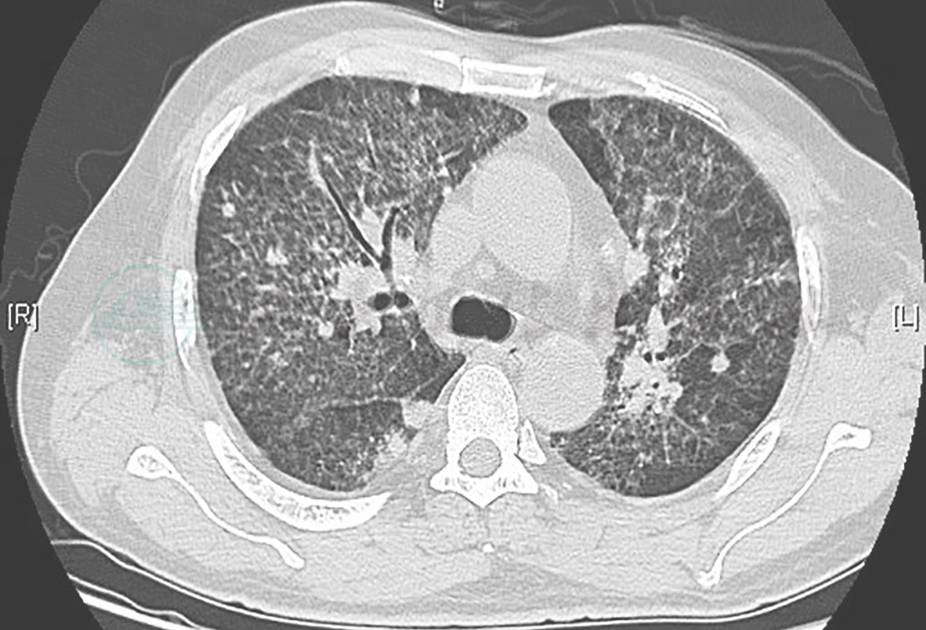
图12 治疗半个月后复查胸部CT表现
胸部CT示双肺弥漫病变较前吸收
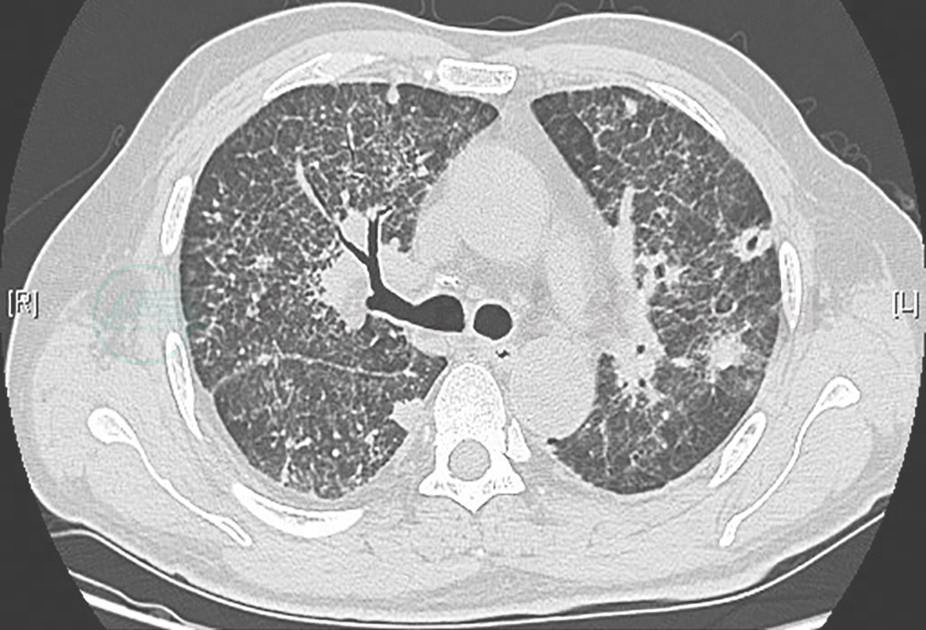
图13 治疗1个月后复查胸部CT表现
胸部CT示双肺病变继续吸收,空洞样改变有所吸收
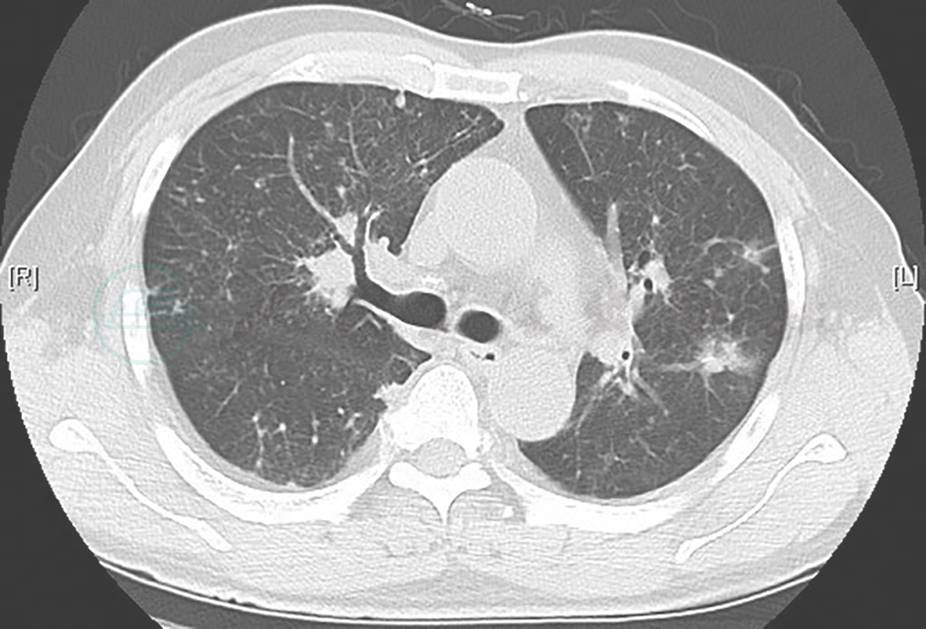
图14 治疗3个月后复查胸部CT表现
胸部CT示双肺病变基本吸收,空洞样改变遗留少许纤维条索和结节
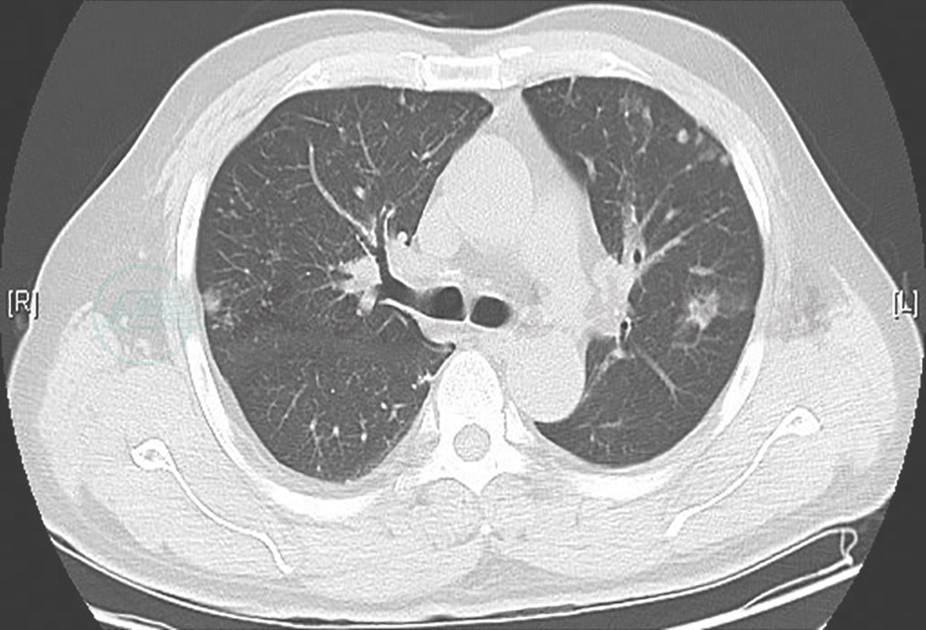
图15 治疗5个月后复查胸部CT表现
胸部CT示双肺病变及空洞基本吸收,遗留少许条索状纤维影
(二)临床思辨
综合一系列经验的、循证的临床证据,患者肺内病变的性质诊断为侵袭性肺部真菌(马尔尼菲青霉菌)感染,就此也可解释为何常规前期经验性抗感染治疗无效。
1.侵袭性肺部马尔尼菲青霉菌感染有何特征?
马尔尼菲青霉菌(penicillium marneffei,PM)感染呈一定地域相关性,主要发生在东南亚和中国华南地区。研究表明,这与竹鼠的地区分布有一定相关性。80%马尔尼菲青霉菌病患者有免疫缺陷,目前报道多见于获得性免疫缺陷综合征(AIDS)CD4+细胞计数低下患者。马尔尼菲青霉菌感染可累及多脏器,常见肺、皮肤和肝损害,骨关节受累少见。其临床表现缺乏特异性,如发热、厌食、体重减轻、贫血、淋巴结炎、肝脾大和面部、躯干、四肢皮肤传染性软疣样损伤、皮下多发结节及肺炎等。AIDS合并马尔尼菲青霉菌感染者常见的胸部影像学表现为肺内多发浸润性病灶或局限性肺实变及磨玻璃密度影、肺门或纵隔淋巴结增大、胸腔积液、肺间质病变(即网织纹理,小叶间隔增厚)、粟粒样病变及肺气囊。该菌感染较为少见,临床容易漏诊。
本例患者为中年男性,居住在马尔尼菲青霉菌感染流行地区,且有挖竹笋史,慢性病程,以活动后气促为首发症状,伴有发热、厌食、体重减轻,经广谱抗生素治疗无效。患者HIV抗体阴性,但因早期误诊为间质性肺疾病,应用激素治疗约3个月,累积使用激素剂量达3530mg,存在免疫功能低下状态,应考虑机会性感染可能。患者除了肺部双肺弥漫病变之外,未见皮肤、肝脾等其他脏器受累表现,病程进展后胸部影像学表现见双肺弥漫性病变伴多发空洞形成,经血培养、骨髓培养及支气管肺泡灌洗液培养检出马尔尼菲青霉菌,最终明确马尔尼菲青霉菌肺部侵袭并导致脓毒血症的诊断。
马尔尼菲青毒菌病是可以治愈的,两性霉素B、伊曲康唑是马尔尼菲青霉菌感染的首选药物,氟康唑可能有效,疗程可长达16~20周。本例患者通过两性霉素B脂质体联合伊曲康唑治疗并逐渐将激素减量,病情好转后予伊曲康唑口服液序贯治疗4个月。随访2年(至今),患者症状缓解,肺部病变基本吸收,未见复发。
2.马尔尼菲青霉菌感染与肺泡蛋白沉积症有什么关系?
肺泡蛋白沉积症(PAP)由Rosen于1958年首次报道,是一种组织学特征为肺泡腔内及终末呼吸性细支气管内堆积过量PAS染色阳性的磷脂蛋白样物质的弥漫性肺部疾病。其病因及发病机制尚未完全明了。一般来说,PAP可根据病因分为原发性、继发性和先天性3类。其临床症状主要为气短、咳嗽和咳痰。胸部X线片可见双肺弥漫性肺部浸润阴影。胸部 HRCT特征性改变为两肺斑片状阴影,致密影中可见支气管充气征,边缘清晰、锐利,病灶与周围正常肺组织形成鲜明的对照,呈现一种地图状改变;有时呈磨玻璃样改变,小叶间隙和间隔不规则增厚,可见多角形态的铺路石或碎石路样征象。病理学检查以肺泡内充满PAS染色阳性的蛋白样物质为特征。其典型的BALF呈乳白色或浓稠的浅黄色液体,放置后分层;光镜下可见大量形态不规则、大小不等的嗜酸颗粒状脂蛋白样物质;PAS染色阳性;电镜下可见较多嗜锇性层状体,并可见肺泡Ⅱ型细胞。经开胸或胸腔镜或支气管镜肺活检获取的病变肺组织,肉眼观察可见多发性淡黄色或灰白色坚实结节;光镜下主要表现为肺泡腔内充满微小颗粒状、PAS染色阳性的无细胞物质(在终末呼吸性细支气管管腔中也可以见到此物质,但肺间质中无),Ⅱ型肺泡细胞增生,肺泡巨噬细胞常呈泡沫状,除继发感染外很少有炎症细胞;电镜下可见肺泡Ⅱ型细胞增生、分泌增多,肺泡腔内有大量肺泡Ⅱ型细胞分泌的嗜锇性和絮状物质,肺间质变宽,成纤维细胞、胶原和弹力纤维增生,以及淋巴细胞浸润等改变。对于PAP,目前最主要的治疗措施是全肺灌洗或支气管肺泡灌洗、粒细胞-巨噬细胞集落刺激因子(GM-CSF)替代治疗。PAP在部分患者有自限性,可自行好转。
本例患者有粉尘接触史,咳嗽、气促,双肺弥漫间质性病变,地图状改变不典型,BALF呈乳白色,PAS染色阳性,结合肺组织活检病理,须考虑肺泡蛋白沉积症可能,其病因考虑继发于感染可能性大。经过积极抗真菌治疗后,患者双肺弥漫间质病变消失,考虑病程自限性与感染好转有关。
发热伴双肺弥漫性病变在临床上常呈急重病情,需要尽快判断病因以采取针对性治疗,挽救患者生命。该病症可见于感染性或非感染性疾病,亦可见于二者合并存在的情况。感染性因素常见于病毒、细菌、非典型病原体感染以及免疫功能低下引起的机会性感染等多种情况;非感染性因素常见于间质性肺炎,亦可见于肿瘤及其他间质性肺疾病。临床上可见间质性肺炎合并感染或原发感染引起肺间质性改变等情况。尽早明确诊断是进一步治疗的基础,而详尽的病史、可靠的检查资料及正确的诊断思路对于双肺弥漫病变的诊断尤为重要。
马尔尼菲青霉菌病在非HIV感染患者中少见,且其表现并无特异性,使得临床诊断十分棘手,而有效的治疗依赖于早期诊断。临床上,如果发现患者存在免疫功能相对低下,出现高热不退,常规抗感染治疗效果欠佳,应引起警惕,并积极进行病原检测。
(李鸿茹 陈愉生)
1.Cao CW,Liang L,Wang WJ,et al.Common reservoirs for Penicilliummarneffei infection in humans and rodents,China.Emerg Infect Dis,2011,17:209-214.
2.王莹,邓卓霖,马韵.马尔尼菲青霉病的临床诊断进展.中国真菌学杂志,2007,2:312-314.
3.Yousukh A,Jutavijittum P,Pisetpongsa P,et al.Clinicopathologic study of hepatic Penicilliummarneffei in Narther Thailand.Arch Pathol Lab Med,2004,128:191-194.
4.刘晋新,店小平,社松峰,等.艾滋病合并马尔尼菲青霉菌感染的胸部影像学表现.中华放射学杂志,2007,14(3):225-226.
5.侯德凤.艾滋病合并马尔尼菲青霉菌病感染率和实验室检查及药敏分析.华西医学,2010,25(5):919-921.
6.Trapnell BC,Whitsett JA,Nakata K.Pulmonary alveolar proteinosis.N Engl J Med,2003,349(26):2527-2539.













