作 者:吴小青(主治医师 无锡市人民医院消化内科)
指导者:占 强(主任医师 无锡市人民医院消化内科)
AIE的发病机制尚不明确。目前普遍认为,患者体内存在针对小肠上皮细胞的抗体,一般情况下处于免疫耐受状态,在偶然感染(如李斯特杆菌感染)的情况下,这种免疫耐受可能被打破,导致自身免疫紊乱。AIE可以累及全小肠,以近端小肠受累多见。小肠绒毛萎缩消失,皱襞减少、变平,表面出现裂隙、凹槽,可呈扇贝样和马赛克样。这些与乳糜泻内镜下小肠的表现完全一致,两者从形态上无法鉴别。组织上,两者均可以表现为小肠绒毛变平萎缩,可以出现隐窝脓肿。但乳糜泻患者的上皮内淋巴细胞(intraepithelial lymphocyte,IEL)较多,多数>40/100上皮细胞,AIE患者IEL相对较少。AIE患者小肠黏膜活检组织病理学改变主要有绒毛萎缩、隐窝脓肿及增生、隐窝上皮内凋亡小体和黏膜固有层的淋巴细胞性弥漫浸润、数量增多,可有隐窝脓肿及增生,IEL相对少等。AIE与克罗恩病(CD)、淋巴细胞性结肠炎、淋巴瘤的病理组织学鉴别要点主要是:AIE上皮淋巴细胞隐窝内多,表面上皮内少,而CD、淋巴细胞性结肠炎、淋巴瘤则淋巴细胞在上皮内多,隐窝内少;AIE患者黏膜隐窝内凋亡小体增多,而CD、淋巴细胞性结肠炎、淋巴瘤则凋亡小体稀少或无凋亡小体存在;AIE患者的小肠组织仅可见少量表达T细胞受体TCR-αβ的肠上皮内淋巴细胞(intestinal intraepithelial lymphocytes,iIEL)(<40个淋巴细胞/100上皮细胞),而CD患者小肠上皮组织中可见淋巴细胞的比例则远高于此。内镜下在小肠多点活检是诊断AIE的基石。AIE可伴随其他自身免疫性疾病,包括自身免疫性甲状腺疾病、自身免疫性关节炎、干燥综合征、重症肌无力、自身免疫性肝炎、原发硬化性胆管炎等。该患者证实为AIE合并原发硬化性胆管炎。关于治疗方面,由于AIE临床上少见,目前还没有多中心大样本的临床治疗数据。目前大多学者认为,皮质激素仍是治疗的首选。已有的文献报道中,大多认为AIE患者在激素治疗后症状获得迅速缓解。在症状得到控制后,激素剂量可逐渐减量。有部分患者对激素不敏感,或者长时间应用激素治疗后出现激素抵抗,可考虑免疫抑制治疗,应用硫唑嘌呤、6-巯基嘌呤、甲氨蝶呤、环孢素、他克莫司及西罗莫司者等均有报道。此外,这些免疫抑制剂也被用于AIE的维持治疗。近年来,有报道应用英夫利西单抗治疗重症AIE获得一定效果,可迅速缓解症状。AIE治疗难点在于如何预防复发,至少50%患者在用药后出现1次至数次反复。目前尚无内科之外的方法包括内镜、手术等治疗的报道。
1.患者基本情况
患者:女性,62岁。
入院时间:2017年5月21日。
主诉:反复腹泻半年,加重1个月。
现病史:患者半年前起出现反复腹泻,为黄色水样便,平均10余次/d,外院查胃镜、肠镜,无阳性发现(未见报告),抗感染、补液、禁食等治疗无效。1个月来,患者腹泻显著加重,平均15~20次/d,为无色水样便,含未消化食物残渣,无黏液、脓血,伴全身乏力、食欲减退,无腹痛、腹胀,无畏寒、发热,无恶心、呕吐,无里急后重。半年来,患者体重减轻约5kg。为进一步诊治,患者被收治入院。
既往史:高血压病史,近期未服药,血压控制在(120~130)/(70~80)mmHg。
个人史:否认肝炎、结核或其他传染病史,否认过敏史;否认饮酒史,否认滥用药物史;否认其他手术史,否认输血史。近1年无旅游及不洁饮食史。
家族史:否认糖尿病、慢性肾病等家族史,家族中无类似疾病患者。
2.入院辅助检查
我院急诊:血常规:WBC 13.22×109/L,NEUT% 66%,Hb 143g/L,PLT 365×109/L。血电解质:钾 1.97mmol/L。血气分析:酸碱度(37℃)7.24,二氧化碳分压(37℃)23.9mmHg(↓),氧分压(37℃)107.0mmHg(↑),碳酸氢根浓度 9.9mmol/L(↓),标准碳酸氢根浓度 12.7mmol/L(↓),实际剩余碱 -16mmol/L(↓),标准剩余碱 -16.1mmol/L(↓)。
3.初步诊断思维过程
(1)入院时病情总结
该患者为中老年女性,病史半年余,以反复大量水样泻为主要表现,曾在外院查胃肠镜,无阳性发现,入院时实验室检查提示低钾血症、代谢性酸中毒。
(2)入院时诊断思路
患者慢性腹泻,主要需考虑感染性、非感染性肠道疾病,主要为小肠吸收不良性疾病,同时因腹泻为大量水样泻,需考虑其他脏器疾病,如胰源性腹泻、血管活性肠肽(VIP)瘤、神经内分泌肿瘤等疾病,需完善小肠镜检查、胸腹部增强CT等检查。
(3)入院初步诊断
①腹泻待查;②高血压病。
4.后续检查
(1)实验室检查
血常规:WBC 12.90×109/L,NEUT% 76.9%,Hb 114g/L,PLT 284×109/L。尿常规正常。粪常规:隐血弱阳性。粪便细菌培养、轮状病毒、腺病毒抗原、真菌、霍乱弧菌均阴性。血钾 2.9mmol/L。血气分析pH 7.24。CRP、ESR、降钙素原、真菌-D-葡聚糖、类风湿组合、抗核抗体、抗ENA抗体谱、ANCA、致敏原组合、肿瘤标记物、肝肾功能、胃泌素、降钙素、梅毒、艾滋等均正常。T-SPOT阴性。甲状腺功能:促甲状腺素0.15mU/L(↓),游离三碘甲状腺原氨酸3.75pmol/L,游离甲状腺素11.39pmol/L。甲状腺相关抗体:微粒体抗体23.54%(↑),抗TSH受体抗体8.74U/L,抗甲状腺过氧化物酶抗体21.17IU/mL,甲状腺球蛋白9.28ng/mL,甲状腺球蛋白抗体33.46%(↑)。
(2)心电图
正常。
(3)头颅、胸部CT
正常。
(4)胃镜
镜下见慢性浅表性胃炎表现。胃镜病理学检查提示,胃窦轻度慢性浅表性炎;十二指肠球部绒毛变平,固有膜增宽,见浆细胞、淋巴细胞、中性粒细胞、嗜酸性粒细胞浸润,可见隐窝炎。
(5)全腹部增强CT
胆囊结石、肝脏、胰腺、脾脏等均未见明显异常,小肠多发节段性黏膜增厚、回盲部及直肠、乙状结肠黏膜增厚(图1)。

图1 全腹CT
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
(6)小肠镜
结直肠黏膜未见明显异常。小肠绒毛广泛萎缩,血管清晰,黏膜大致正常(图2)。

图2 小肠镜
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
小肠镜病理检查提示空回肠、回肠末端;小肠绒毛变平,固有膜增宽,见单核细胞为主的混合炎细胞浸润,浆细胞多见,夹杂淋巴细胞、嗜酸性粒细胞和中性粒细胞,隐窝内见凋亡细胞,杯状细胞减少(图3)。相关特殊抗体检查:ASCA IgG(+)、DGP IgA(±)、HLA-DQ2(+)。
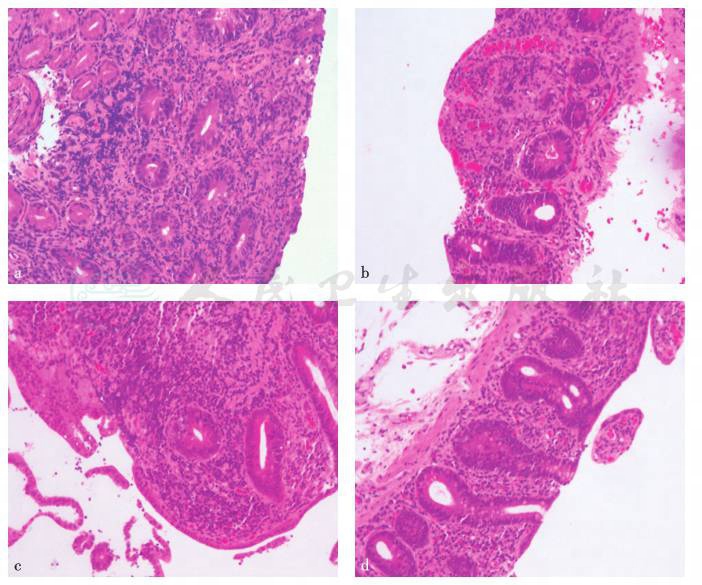
图3 病理学检查(HE染色)
a. 十二指肠病理,100×;b. 空回肠病理,50×;c. 空回肠病理,100×;d. 空回肠病理,50×
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
5.最终诊疗思维过程
(1)从病因上来讲,慢性腹泻主要见于以下疾病
1)肠源性疾病
如感染性肠道炎症、非感染性肠道炎症、小肠吸收不良等。
2)胃源性疾病
如晚期胃癌、促胃液素瘤等。
3)肝胆源性疾病
如肝硬化、肝癌、胆囊炎等。
4)胰源性疾病
如慢性胰腺炎、胰腺癌、胰腺囊性纤维化和胰腺广泛切除术后。
5)肿瘤性疾病
如结肠癌、小肠恶性淋巴瘤、弥散神经内分泌细胞(amine precursor uptake and decarboxylation,APUD)瘤、促胃液素瘤、类癌、VIP瘤。
6)药源性疾病
如各种泻药、胆碱能药物、洋地黄类、抗生素类、肝性脑病用药等。
7)功能性疾病
如肠易激综合征、神经症。
8)全身性疾病
如尿毒症、甲状腺功能亢进、恶性贫血、艾滋病、糖尿病等。
该病例经过全面检查,逐一排除,最终考虑为肠源性疾病。
(2)从发病机制来讲,慢性腹泻分为如下几类
1)分泌性腹泻
①禁食后腹泻仍不止;②肠液与血液渗透压相同;③粪质呈水样、量大、无脓血;④肠黏膜组织学基本正常。
2)渗出性腹泻
粪便常含有渗出液和血液。
3)渗透性腹泻
①禁食后腹泻减少或停止;②粪便渗透压超过血浆渗透压;③粪便含大量未经消化吸收食物。
4)动力性腹泻
①腹泻伴有肠鸣音亢进和腹痛;②粪便稀烂或水样,无渗出物。
该病例考虑为分泌性腹泻。
(3)特殊类型引起腹泻的疾病
1)自身免疫性肠炎
①成人慢性腹泻(持续时间>6 周);②吸收不良综合征;③特异性小肠病理表现:部分/完全绒毛萎缩,深部隐窝淋巴细胞增多,隐窝凋亡增多,上皮内淋巴细胞增多;④排除其他绒毛萎缩的原因(克罗恩病、口炎性腹泻,肠淋巴瘤);⑤抗肠上皮细胞自身抗体(antienterocyte,AE)和(或)抗杯状细胞抗体(antigoblet cell antibody,AG)阳性。其中①~④项是自身免疫性肠病(autoimmune enteropathy,AIE)确诊的必要诊断条件。AE或AG抗体是一个重要的诊断依据,但抗体缺失并不能排除AIE。
2)显微镜下肠炎
指一组以慢性水样腹泻,一般肠镜检查无异常发现,但结肠黏膜活检有病理组织学改变的临床疾病。临床上,显微镜下结肠炎可分为两种不同的组织学类型,一种为淋巴细胞性结肠炎,另一种为胶原性结肠炎,根据特征性病理表现可鉴别。
3)乳糜泻
诊断要点:①肠黏膜活检的组织学改变:隐窝增生,上皮内淋巴细胞增多,上皮层破坏;②基于麸质引起小肠病变的依据,如乳糜泻特异性抗体(抗转谷氨酰胺酶-2)阳性和(或)在无麸质饮食后临床和(或)组织学改善。
4)Whipple病
特点为小肠镜下可见小肠黏膜肿胀、苍白或散在黄色斑块及糜烂灶;光镜下可见黏膜固有层有PAS染色阳性的巨噬细胞浸润及淋巴管扩张。
5)其他
如炎性肠病、小肠淋巴瘤等疾病,均可通过临床表现、内镜及病理进行鉴别。
6.最终诊断
自身免疫性肠炎。
7.后续治疗方案
针对AIE的治疗目前尚缺乏共识。治疗方案首选激素诱导缓解,其他还包括营养支持、抗感染等治疗。激素诱导症状缓解之后,加用免疫抑制治疗。目前部分长期随诊的患者使用环孢素或巯嘌呤类维持。有研究报道,抑制T细胞激活的西罗莫司和吗替麦考酚酯对环孢素耐药的患者有效,而且英夫利西单抗也对该病长期维持治疗有效。该病的长期预后目前尚不明确,有待于进一步深入研究。
2017年6月8日患者开始应用甲泼尼龙40mg/d治疗,6月11日粪便即开始恢复正常,应用1周后改为激素口服治疗,但在激素减量过程中,病情反复,后加用硫唑嘌呤治疗。后激素逐渐减量至停用。
2018年10月 16日,患者门诊随访复查肝功能:TBIL 13.1μmol/L、ALT 509.6U/L、AST 704U/L、γ-GT 422U/L,ALP 256U/L。查腹部彩超:肝脏声像图考虑肝受损后改变。MRCP:胆囊炎,胰腺尾部饱满。病毒性肝炎相关指标正常。抗核抗体阳性(1∶60);自身免疫性肝炎指标:抗线粒体抗体(M2)阳性(+),其余正常。诊断:原发性胆汁性胆管炎。加用熊去氧胆酸治疗。
8.后续随访
随访复查至今,患者肝功能恢复正常。
该患者以大量水样泻为主要表现,但各项实验室指标、器械检查均无明显阳性提示,仅在小肠镜下表现为广泛绒毛萎缩,最终病理学检查确诊,属于特殊类型引起腹泻的自身免疫性疾病。对于AIE的治疗,目前还没有多中心大样本的临床治疗数据。AIE治疗难点在于如何预防复发,至少50%患者在用药后出现1次至数次反复,病情反复之后的治疗有时较为棘手。
[1]Murch S.Advances in the understanding and management of autoimmune enteropathy.Current Paediatries,2006,16(5):305-316.
[2]毛高平,张亚飞,李白容. 自身免疫性肠病. 世界华人消化杂志,2016,24:4040-4047.













