作 者:王善慈(住院医师 南方医科大学南方医院消化内科)
秘文婷(住院医师 南方医科大学南方医院消化内科)
指导者:刘思德(主任医师 南方医科大学南方医院消化内科)
1.真菌性肠炎
急性期一般禁止使用止泻药物。由于存在菌群失调,所以调节肠道微生态至关重要。益生菌可增加肠道黏蛋白的分泌,抑制细菌过度生长,刺激黏膜免疫,合成抗氧化物来稳定黏膜屏障。乳酸杆菌属对肠道屏障功能有保护作用,可降低肠道渗出性,对真菌性肠炎的治疗有益。隐球菌性肠炎以氟康唑联合双歧四联活菌片治疗效果较佳。必须控制广谱抗生素的应用。对于有慢性疾病、基础疾病者,应积极治疗原发病,加强营养,提高机体免疫力,慎用糖皮质激素和免疫抑制药物。保护免疫力功能低下患者的口腔和肠道黏膜,尽量避免大剂量长时间使用抗生素、激素和免疫抑制剂药物,特别是使用广谱抗生素或几种抗生素或抗生素加激素同时使用。
2.淋巴瘤
按细胞来源,原发性肠道淋巴瘤可分为B细胞型和T细胞型两类。其中B细胞型占大多数,其病理类型绝大部分为NHL,以弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)和黏膜相关性淋巴组织(mucosa-associated lymphoid tissue,MALT)较为常见。原发性肠道淋巴瘤内镜下表现呈多样性,大致可分为肿块型、溃疡型和息肉型3型。其中,肿块型最常见,多表现为肠腔内息肉样突出,单发、多发均可见,突起表面可伴糜烂、溃破,质地较息肉为硬,需注意与腺瘤相鉴别;溃疡型表现为弥漫性、多灶性、多形性,边缘堤状隆起,呈火山口样;息肉型病变主要在回肠末端及回盲部。对于该病,目前尚无统一的治疗方案,可根据病理分型、分期以及预后指标制订个体化治疗方案。以化疗为基础的联合治疗可取得良好疗效。手术作为主要的诊断及治疗手段,可减轻肿瘤负荷和化疗过程中并发症的发生,但单独手术并不能提高总生存(overall survival,OS)及无进展生存期(progression-free survival,PFS)。手术联合化疗是原发性肠道淋巴瘤治疗的最佳选择。影响肠道淋巴瘤预后的因素较多,包括:出现肠梗阻、肠穿孔以及消化道出血等并发症,提示预后不良;原发于回盲部的肠道淋巴瘤(primary intestinal lymphoma,PIL)预后较发生于大肠、小肠好;B细胞淋巴瘤预后优于T细胞淋巴瘤;CD56阳性者预后明显差于CD56阴性者等。
1.患者基本情况
患者:男性,22岁,汉族,未婚,学生。
入院时间:2018年7月31日。
主诉:反复腹痛8个月余,发热1个月余,加重10天。
现病史:患者8个月余前在国外旅游时,无明显诱因出现腹部隐痛,疼痛呈阵发性,持续数十秒后缓解,以脐周为甚,无恶心、呕吐,无反酸、嗳气,无畏寒、发热,无血便、黏液脓血便等不适,于国外医院就诊,予药物治疗(具体不详),症状明显缓解后出院回国。后患者仍反复出现腹痛,性质同前,发作频率无明显改变,遂于2018年4月至当地医院就诊。肠镜检查提示升结肠肿物;病理学检查示黏膜慢性炎症;腹部B超示脾大,脾内低密度结节,未除外脓肿形成。接诊医师考虑为克罗恩病、脾脓肿,予抗感染等对症治疗,患者症状稍有缓解。1个月余前,患者无明显诱因出现发热,峰值达39.0℃,无畏寒、咽痛等不适,自行服用药物后体温恢复正常。后患者仍反复发热,均自服退热药治疗。10天前,患者再发腹痛,疼痛程度较前加重,持续数分钟无明显缓解,无排便习惯改变等不适。患者现为进一步治疗来我院就诊,门诊以“腹痛查因”收入院。自发病以来,患者精神状态一般,体力情况较差,食欲较差、食量下降,睡眠情况一般,近半年体重下降约5kg,大便正常,小便正常。
既往史:既往无特殊,否认婴幼儿时期脐带炎史,否认肝炎、结核、传染病史,否认输血史。
个人史:否认滥用药物史;抽烟10年,每天约20根,嗜酒约5年,每天约啤酒2000mL,已戒烟、戒酒3个月。
家族史:否认家族性遗传病史、肿瘤史,家族中无类似疾病患者。
过敏史:无药物、食品等过敏史。
2.入院查体
生命体征:T 37.7℃,P 115次 /min,R 18次 /min,BP 104/88mmHg。
专科查体:腹平坦,无腹壁静脉曲张。腹部柔软,无压痛、反跳痛,腹部无包块。肝脏肋下未触及,肝区无压痛、叩击痛。脾脏肋下可触及,脾缘光滑,无触痛。Murphy征阴性,肾区无叩击痛,无移动性浊音。肠鸣音未见异常,约4次/min。
3.入院辅助检查
血常规:WBC 6.93×109/L,中性粒细胞(neutrophilic granulocyte,NEUT)百分数70.4%,Hb 110g/L,PLT 201×109/L。
血生化:CRP 96.72mg/L,血清降钙素原(procalcitonin,PCT)0.083ng/mL,ESR 52mm/第1h末。
肝功能、肾功能、电解质、术前八项(乙肝病毒表面抗原、乙肝病毒表面抗体、乙肝病毒e抗原、乙肝病毒e抗体、乙肝病毒核心抗体、丙肝病毒抗体、艾滋病病毒抗体、梅毒血清特异性抗体)、二便常规无异常。
血结核抗体、结核T-SPOT均(-),PPD 皮试(-),γ-干扰素释放试验(-)。
血巨细胞病毒、EB病毒、疟原虫均(-)。
粪便检查:隐血阴性,未见虫卵、脓细胞、细菌(包括艰难梭菌)等。
咽拭子:一般真菌、细菌检查,未见异常。
腹部B超:①脾大,脾内片状低回声区,请结合临床;②肝、胆、胰未见明显异常。
全腹增强CT+小肠CT造影(CT enterography,CTE):①部分小肠、回盲部、升结肠管壁增厚并异常强化,病变处于活动期,考虑为炎性肠病,克罗恩病可能性大;②脾脏小囊肿;③腹主动脉CTA未见明显异常(图1)。
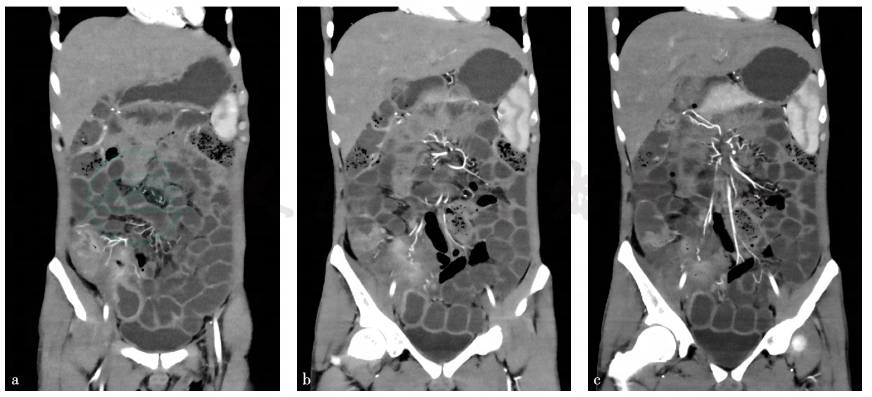
图1 全腹增强CT
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
肠镜:送达升结肠,升结肠见溃疡性病变,黏膜肿胀明显,未见瘘口及脓性分泌物流出,蠕动可,肠腔狭窄,结肠镜无法通过。升结肠至直肠见节段性充血水肿、糜烂及浅表溃疡。直肠距肛门14cm见一直径3cm肿物,表面充血水肿、糜烂及脓性分泌物附着(图2)。考虑为大肠溃疡(克罗恩病可能性大)。
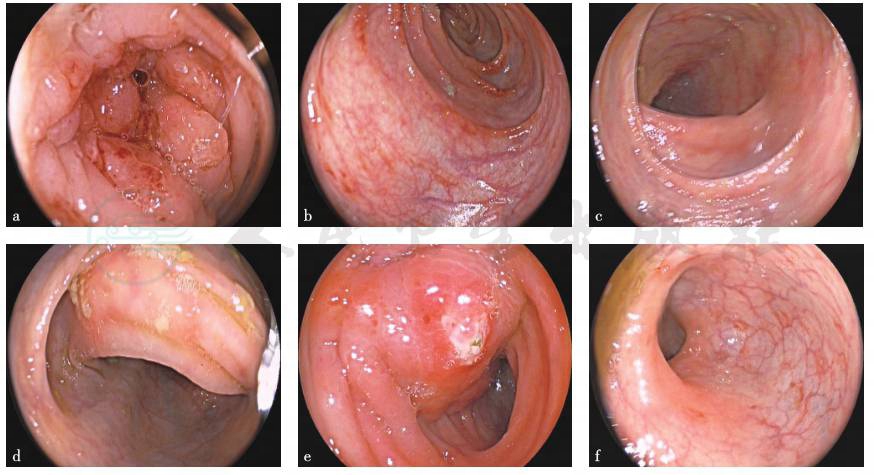
图2 肠镜检查所见
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
4.初步诊断思维过程
(1)入院病情总结
患者为青年男性,抽烟、嗜酒多年,病史8个月余,以反复腹痛为主要临床表现,起病前有国外旅游史。小肠CTE考虑炎性肠病,且病变处于活动期;肠腔狭窄,肠镜检查仅可送镜至升结肠,升结肠至直肠段散在充血糜烂、表浅溃疡灶,直肠见一肿物,表面充血水肿、糜烂伴脓性分泌物附着。
(2)入院诊断思路
患者因反复腹痛伴发热入院,应通过查体及相关化验排除常见急腹症,如胰腺炎、胆道系统疾病、消化道溃疡并穿孔等;考虑患者特殊的海外旅游史,应排除疟原虫、血吸虫感染等传染病感染情况;完善腹部超声、增强CT、小肠CTE、肠镜及血生化检验,提示轻度贫血并存在感染,内镜检查提示大肠多发溃疡;患者近期无排便习惯改变,伴有消瘦现象,体重下降约5kg,需排除消耗性疾病,如肠结核、淋巴瘤、假膜性肠炎等。进一步完善相关检验检查,除外上述疾病后可考虑诊断为克罗恩病。
(3)入院初步诊断
①克罗恩病?②轻度贫血。
5.入院初步诊疗方案及病情变化
(1)初步诊疗方案
予头孢哌酮钠他唑巴坦钠联合左氧氟沙星抗感染、英夫利西单抗靶向、硫唑嘌呤免疫抑制等治疗,并辅以泮托拉唑抑酸护胃、营养支持等对症处理。
(2)病情变化
1)腹痛加重,伴发热,体温波动于38.5~40.3℃。
2)查体:右下腹压痛(+),反跳痛(±),可疑板状腹、急腹症。
3)血常规:WBC 7.28×109/L,NEUT% 78.9%,Hb 95g/L,PLT 116×109/L。
4)血生化:CRP 76.79mg/L,PCT 2.950ng/mL,血清淀粉样蛋白(serum amyloid A protein,SAA)>200mg/L。
5)腹部超声:①下腹部见大量肠管扩张,张力较高,肠壁增厚;②升结肠节段性肠壁明显肿胀、增厚,肠壁血流较丰富。
6.后续检查
(1)腹腔镜下右半结肠切除术病理(2018年8月16日)
①(右半结肠)慢性炎伴溃疡、脓肿及肉芽肿形成,除外结核后考虑克罗恩病;②淋巴结反应性增生,伴局部坏死及急性炎症反应。
(2)自身抗体筛查
全部为阴性。
(3)外周血象
WBC 0.43×109/L,NEUT% 4.1%,Hb 54g/L,PLT 25×109/L。变化趋势见图3。

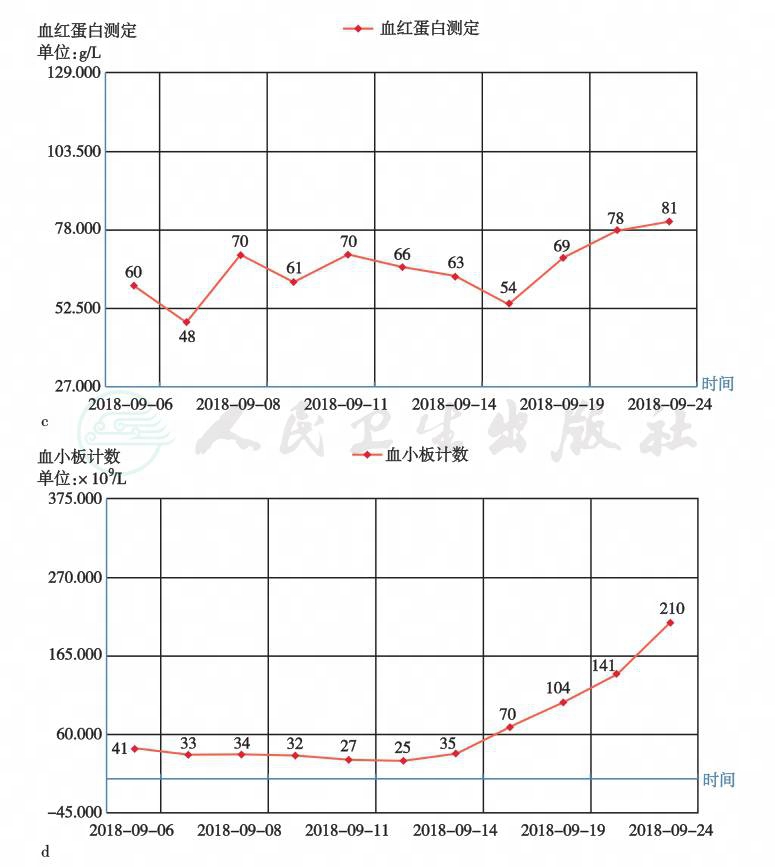
图3 外周血象变化趋势
(4)骨髓穿刺
①骨髓取材血稀(骨髓完全稀释);②幼淋占1%,可见吞噬网状细胞(图4);③外周血:白细胞数极度减低,淋巴细胞明显增高(需结合临床考虑)。
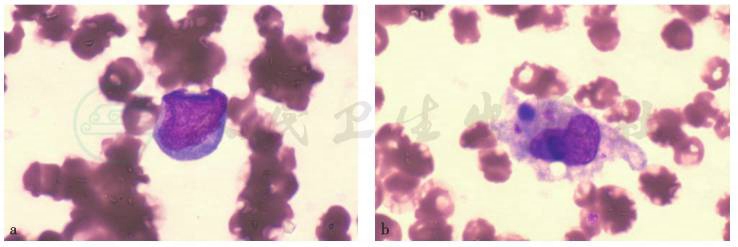
图4 骨髓穿刺活检(HE染色,400×)
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
(5)骨髓活检
骨髓增生较低下,但骨髓中不成熟造血前体细胞增加,需结合临床表现注意除外低增生性骨髓增生异常综合征,另外此次骨髓活检未见弥漫成片的异型淋巴细胞浸润。
(6)胸部CT
①左肺下叶背段及后基底段少许炎症;②双肺尖胸膜稍增厚;③心腔密度减低,提示贫血;④双侧腋窝淋巴结影,部分肿大;⑤脾大,獭尾肝。
(7)全腹CT
①右半结肠切除术后改变,吻合口未见明确异常;②腹腔及盆腔少量积液;③肠系膜内多发小淋巴结;④脾脏较前增大,原脾内低密度影本次扫描显示不清;⑤双肺下叶后基底段炎症;⑥心腔及大血管密度减低,提示贫血。
(8)超声引导下脾脏穿刺病理(图5)
(脾实质)脾内组织细胞浸润,考虑为感染性病变所致的反应性组织细胞增生。免疫组化:CD3(+)、CD5(+)、CD20(-)、CD68(+)、CD30(-)、ALK(-)、CD163(+)、Ki-67(+,约 25%)。特殊染色:AAS(-)、PAS(-)、GMS(-)、GRAM(-)。
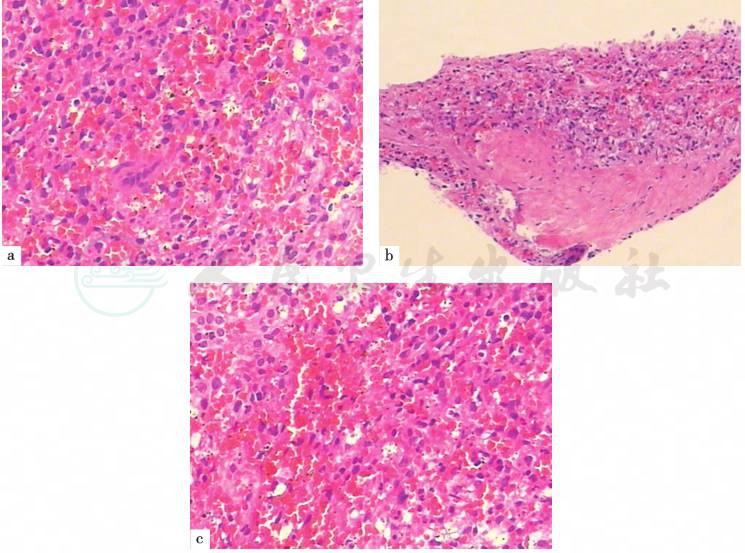
图5 脾脏病理(HE染色,100×)
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
(9)手术标本病理会诊
①(右半结肠)慢性炎伴溃疡、脓肿及肉芽肿形成,特殊染色发现少许真菌孢子,形态符合隐球菌,需结合临床表现诊断;②双侧切缘未见病变组织残留;③淋巴结反应性增生,伴局部坏死及急性炎反应。注:该病例经科内专家会诊,同意上述诊断。
(10)手术切口处超声
2018年9月21日检查示右下腹手术切口处窦道形成,右下腹肠壁肿胀,回声不均匀,肠系膜回声减低,肠间隙可见少量渗出。2018年9月25日复查示右下腹手术切口处窦道形成,范围较前次(2018年9月21日)检查缩小,建议动态观察。
7.最终诊疗思维过程
(1)诊断思路
隐球菌性肠炎作为真菌性肠炎的一种,其发生往往存在许多诱因,如应用广谱抗生素引起肠道菌群失调;或使用糖皮质激素、免疫抑制药物、肿瘤化疗等导致机体免疫功能受损;或存在某些基础疾病[如糖尿病、慢性肝病、获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS,也称艾滋病)等]或肠道营养不良和手术创伤等。对于有临床基础疾病及存在临床危险因素的患者,一旦出现腹泻,应引起高度重视,需警惕真菌性肠炎的发生,及时检查粪便,检查出隐球菌菌丝可确定诊断。单纯在便中发现真菌孢子尚不能确定该病诊断,需要结合临床,并了解肠道菌群状况,做到早诊断、早治疗。
隐球菌肠炎的临床表现缺乏特异性,排除其他疾病后方可明确诊断。该病例患者入院后反复出现发热,先后予头孢哌酮钠他唑巴坦钠、左氧氟沙星、美罗培南、甲硝唑、万古霉素、复方磺酸甲𫫇唑、多西环素等多种高级别抗生素抗感染治疗,效果不佳,仍反复发热,热峰波动无规律,B超提示手术切口部肿胀、渗出,伴窦道形成,肠镜下见直肠距肛门14cm处一直径3cm肿物,表面充血水肿、糜烂及脓性分泌物附着,考虑因抗生素使用引起肠道菌群失调,为真菌提供生存条件。且该病例曾因考虑克罗恩病予硫唑嘌呤免疫抑制辅助英夫利西靶向治疗,多重因素均构成真菌性肠炎的危险因素。
(2)鉴别诊断
1)肠结核
肠结核多继发于开放性肺结核,且病变主要涉及回盲部,有时累及邻近结肠,但不呈节段性分布;瘘管及肛门直肠周围病变少见;结核菌素试验阳性等有助于与克罗恩病鉴别。对有鉴别困难者,可以先行抗结核治疗观察疗效。有手术适应证者可行手术探查,病变肠段与肠系膜淋巴结病理组织学发现干酪样坏死性肉芽肿可获确诊。
2)淋巴瘤
淋巴瘤累及胃肠道时,表现常为腹痛、腹泻和腹部包块,症状可类似消化性溃疡、肠结核、炎性肠病,病变主要以小肠为多,其中半数以上位于回肠,表现为深大溃疡,超声内镜下为低回声。而克罗恩病超声内镜表现为高回声。淋巴瘤患者有时也有原发病的临床表现,如淋巴结肿大、发热等,可行淋巴结活检、骨髓活检、内镜下肠道病变组织免疫组化可鉴别。
3)炎性肠病
发病年龄以20~40岁最多见。腹泻常为早期症状,反复发作,经久不愈。排便每日3~4次,重者每日可达10余次,多伴里急后重。约半数患者有腹泻、便秘交替。受凉及饮食失调常为诱因。发作期粪便呈水样或糊状,多数为黏液血便或脓血便。重症患者常有肠外表现,如关节炎、虹膜炎、结节性红斑等。部分患者肝脾大。
钡灌肠X线检查:①肠管变细、结肠袋消失、肠倾短;②管壁边缘毛糙,呈锯齿状或毛刷样;③肠腔内有小龛影或龛状存钡区;④肠腔内有颗粒状充盈缺损,为假息肉。
肠镜检查:①肠黏膜充血、水肿,质地变脆,触之易出血;②就膜呈颗粒感,失去光泽、粗糙不平;③溃疡大多表浅、多发、大小形态不一,为连续性,呈珊瑚礁样,表面有白色渗出物,也可为血性;④假息肉或炎性息肉形状多样,有蒂或无蒂。
(3)最终诊断
①隐球菌肠炎;②三系减少,淋巴瘤或药物骨髓抑制可能。
(4)治疗方案
①予两性霉素B联合氟胞嘧啶治疗;②及时行切口清创,防止手术窦道引起再次感染;③辅以补充白蛋白、护肝、抑酸护胃、营养支持等对症处理。1月后再次复查骨髓穿刺及外周血涂片,确诊淋巴瘤或药物骨髓抑制。
1.真菌性肠炎
肠镜检查可提示病变黏膜肿胀,见发白的绒毛。活检显示轻微萎缩性肠黏膜,具有中性粒细胞和嗜酸性粒细胞固有层内的细胞浸润。多数患者最初有神经系统受累(脑膜炎),胃肠道受累很少发现,多数胃肠道症状继发于脑膜炎之后。症状性真菌性肠炎作为播散性隐球菌病的初步表现是不常见的,结直肠镜检查可作为一种很好的诊断方法。
2.淋巴瘤
原发性肠道淋巴瘤的发病率较低,好发年龄为40~60岁,男女比例为(1.5~3.4)∶1。几乎所有病例均为非霍奇金淋巴瘤,其中B细胞来源的淋巴瘤占大多数,T细胞来源的仅占10%左右。其中,T细胞来源的淋巴瘤在亚洲国家的发生率高于欧洲国家,尤其是单形性嗜上皮肠道T细胞淋巴瘤,几乎均发生在亚洲国家。该病的发病机制目前尚不明确。肠道弯曲杆菌感染、EB病毒感染、炎性肠病、克罗恩病等慢性炎症的刺激,免疫抑制因素、基因缺陷、环境污染等与原发性肠道淋巴瘤的发生有着密切的关系。原发性肠道淋巴瘤的好发部位以回盲部为主,但也有研究发现小肠的发病率高于回盲部、大肠及广泛侵犯,存在差异的原因可能是由于回盲部定义的不统一。腹痛是最常见的临床症状,还可表现为腹部肿块、贫血、肠梗阻、肠穿孔等。B细胞淋巴瘤的表现以腹部包块、黑便发生率高,更易形成肠梗阻、肠套叠;T细胞淋巴瘤更易出现肠穿孔、腹泻、腹痛。病理组织学检查是原发性肠道淋巴瘤诊断的金标准。研究发现,内镜下阳性率为46.2%~66.7%。与手术病理检查比较,内镜下获取组织标本已逐渐成为诊断原发性肠道淋巴瘤的首选。原发性肠道淋巴瘤很少出现节段性、多发溃疡,肠黏膜若出现此种改变,易被误诊为克罗恩病。超声内镜对原发性肠道淋巴瘤的诊断作用要优于普通结肠镜。其在超声内镜下主要表现为肠壁层次结构消失,肠壁增厚,弥漫性低回声,部分可突破浆膜层,需注意与克罗恩病相鉴别。
[1] Gazzoni AF,Severo CB,Barra MB,et al. Atypical micromorphology and uncommon location of cryptococcosis: a histopathologic study using special histochemical techniques (one case report). Mycopathologia,2009,167:197-202.
[2] Hajjeh RA,Conn LA,Stephens DS,et al. Cryptococcosis: population based multistate active surveillance and risk factors in human immunodeficiency virus-infected persons.Cryptococcal Active Surveillance Group. J Infect Dis,1999,179:449-454.
[3] Chalasani N,Wilcox CM,Hunter HT,et al. Endoscopic features of gastroduodenal cryptococcosis in AIDS. Gastrointest Endosc,1997,45:315-317.
[4] Nakamura S,Matsumoto T,Iida M,et al. Primary gastrointestinal lymphoma in Japan: a clinicopathologic analysis of 455 patients with special reference to its time trends. Cancer,2003,97(10):2462-2473.
[5] Kim SJ,Choi CW,Mun YC,et al. Multicenter retrospective analysis of 581 patients with primary intestinal non-Hodgkin lymphoma from the Consortium for Improving Survival of Lymphoma(CISL). BMC Cancer,2011,11:321.
[6] Kim DH,Lee D,Kim JW,et al. Endoscopic and clinical analysis of primary T-cell lymphoma of the gastrointestinal tract according to pathological subtype. J Gastroenterol Hepatol,2014,29(5):934-943.
[7] Tse E,Gill H,Loong F,et al. Type Ⅱ enteropathy-associated T-cell lymphoma: a multicenter analysis from the Asia Lymphoma Study Group. Am J Hematol,2012,87(7):663-668.
[8] Hu LM,Takata K,Miyata-Takata T,et al. Clinicopathological analysis of 12 patients with Epstein-Barr virus-positive primary intestinal T/natural killer-cell lymphoma(EBV+ ITNKL).Histopathology,2017,70(7):1052-1063.
[9] Lecuit M,Abachin E,Martin A,et al. Immunoproliferative small intestinal disease associated with Campylobacter jejuni. N Engl J Med,2004,350(3):239-248.
[10] Grulich AE,Vajdic CM,Cozen W. Altered immunity as a risk factor for non-Hodgkin lymphoma. Cancer Epidemiol Biomarkers Prev,2007,16(3):405-408.
[11] Tang TC,Kuo MC,Chang H,et al. Primary colonic lymphoma: an analysis of 74 cases with localized large-cell lymphoma. Eur J Haematol,2011,87(1):28-36.
[12] Howell JM,Auer-Grzesiak I,Zhang J,et al. Increasing incidence rates, distribution and histological characteristics of primary gastrointestinal non-Hodgkin lymphoma in a North American population. Can J Gastroenterol,2012,26:452-456.













