女性,39岁,个体。患者因“发现肺部阴影26年,活动后胸闷、气短1个月余,加重伴咳嗽10天”于2015年6月9日入院。患者于1989年查体时查胸片示双肺阴影(具体不详),平素易疲劳,曾临床诊断为“肺结核?”,自诉未予治疗。2015年5月初无明显诱因出现胸闷、气短,伴有喘息,活动后症状明显,无胸痛及呼吸困难。5月底无明显诱因出现咳嗽,伴轻度咳痰,无发热、盗汗。6月4日在某三级医院行肺功能示:小气道功能受损,肺弥散功能中度减低,支气管舒张试验阴性。6月5日在我院行肺部CT示:双肺弥漫性间质性病变,肺泡微结石症?为进一步检查及治疗门诊收入院。患者父母为近亲结婚,均体健,患者父母曾孕3个男孩,均夭折。1姐患间质性肺疾病,与患者肺部影像表现类似,曾于2002年在某三级医院行肺穿刺活检,诊断为“肺泡微结石症?”,其余3个姐姐肺部无异常病变,家族中无传染病。查体:神志清,精神欠佳,双下肺呼吸音粗,未闻及明显干湿性啰音;心率88次/分,律不齐;腹平软,无压痛、反跳痛;双下肢无水肿。病程中无关节肿痛、僵硬,无雷诺现象,无光过敏及反复口腔溃疡发作。
1.双肺弥漫性间质病变待查:肺泡微结石症(pulmonary alveolar microlithiasis,PAM)?肺泡蛋白沉积症(pulmonary alveolar proteinosis,PAP)?特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)?2.心律失常。
入院后查CA15-330.11U/ml↑,IgM测定245.0mg/dl↑,血管紧张素转化酶49.28U↑,肌酸激酶同工酶25.7U/L↑。血气分析:pH 7.416 PO2 93.4mmHg PCO2 41.8mmHg。骨密度示:桡骨、尺骨骨质减少。血常规、凝血功能、血沉、体液免疫、细胞免疫、降钙素原、结核三项、T-SPOT、呼吸道病原九项、免疫蛋白G亚型、抗核抗体等结缔组织相关检查均未见明显异常。于2015年6月17日行电子气管镜检查+肺泡灌洗检查,气管镜下未见明显异常,于右肺中叶给予温生理盐水100ml肺泡灌洗,回收51ml分别送检灌洗液细胞计数和分类以及细菌、真菌涂片和培养,灌洗液检查结果回示:细胞总数0.9×106、巨噬细胞(macrophage,AM)78%↓、淋巴细胞(lymphocyte,Lym)19%↑、中性粒细胞(neutrophil,Neu)3%↑、嗜酸性粒细胞(eosinophil,Eos)0%,涂片:革兰阳性球菌少量↑、革兰阳性杆菌少量↑、灌洗液培养未见异常,灌洗液病理示:(支气管灌洗液)涂片可查见一些巨噬细胞,未见癌细胞。于6月25日行CT引导下经皮肺穿刺活检,病理结果回示:(左上肺穿刺物)符合肺泡微结石病病理特点。给予对症处理后,患者病情稳定,出院后继续给予雾化吸入乙酰半胱氨酸抗氧化、抗纤维化治疗,目前密切随访中。
1.家族性肺泡微结石症;2. 心律失常:室性期前收缩;3. 左心室心肌致密化不全可能性大;4. 桡骨、尺骨骨质减少。
肺泡微结石症(pulmonary alveolar microlithiasis,PAM)是一种以肺泡内广泛磷酸钙盐沉积、微小结节形成为特征的罕见疾病,具有家族发病倾向。该病发生无地区差异以及年龄差异,但男性发病率高于女性,家族发病的报道中男女比率大致相等[1],而本研究家系中,父母为近亲结婚,家族患病情况如图1
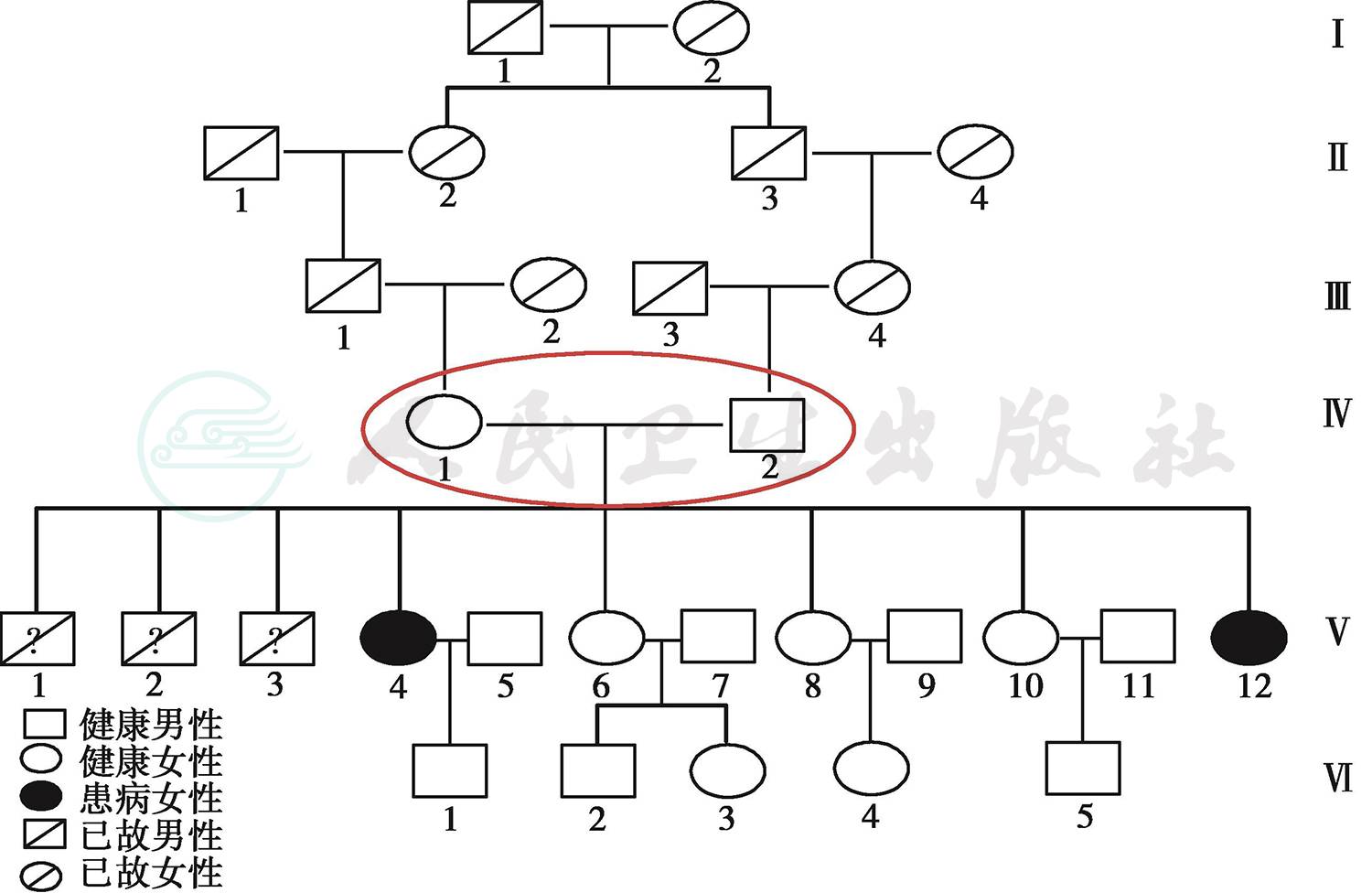
图1 本研究家族患病情况
(1)发病特点
PAM起病隐匿,症状很轻甚至于无症状,缺乏特征性,较为常见的症状有:咳嗽、气促、胸闷、胸痛。病程进展缓慢,本病临床进程多变,非遗传因素是临床表现不一致的主要原因[2]。
(2)病因学相关研究
研究结果证实肺泡微结石症是由编码磷酸钠协同转运蛋白SLC34A2基因突变导致的常染色体隐性遗传病[3],该基因特异性表达于肺泡Ⅱ型上皮细胞。目前对于该病的发生机制有三种学说[4,5]:①肺泡表面先天代谢障碍,肺泡Ⅱ型上皮细胞产生的表面活性物质主要成分是二棕榈酰卵磷脂,可降低肺泡表面张力,其通常可被巨噬细胞和肺泡Ⅱ型上皮细胞降解,当SLC3A2基因发生突变,其编码的SLC34蛋白不能正常清除转运降解过程中产生的磷,磷酸钙盐在肺内沉积形成PAM;②肺泡内异常的炎症反应、刺激和感染,致炎症难以吸收,其后炎症过程引起肺泡渗出,后液体吸收,钙化形成,或肺泡内黏多糖使局部钙盐沉着;③钙盐代谢的系统性疾病在肺脏的表现。目前第一种学说较为被学术界接受。
(3)影像表现
PAM的影像学特点是[6~8]:早期胸片可见双肺有呈弥漫性散在分布的小颗粒样结节影,聚集于双侧中下肺叶及心包周围;胸部CT示对称性分布的细小粟粒状影,片状磨玻璃影及肺间质纤维化改变,双肺透亮度下降、胸膜增厚、胸膜及心包钙化等。细小粟粒状阴影随病变发展的程度不同而数目多少不等。早期易误诊,晚期纵隔窗可见“暴风雪”及“火焰征”样改变(图2)。
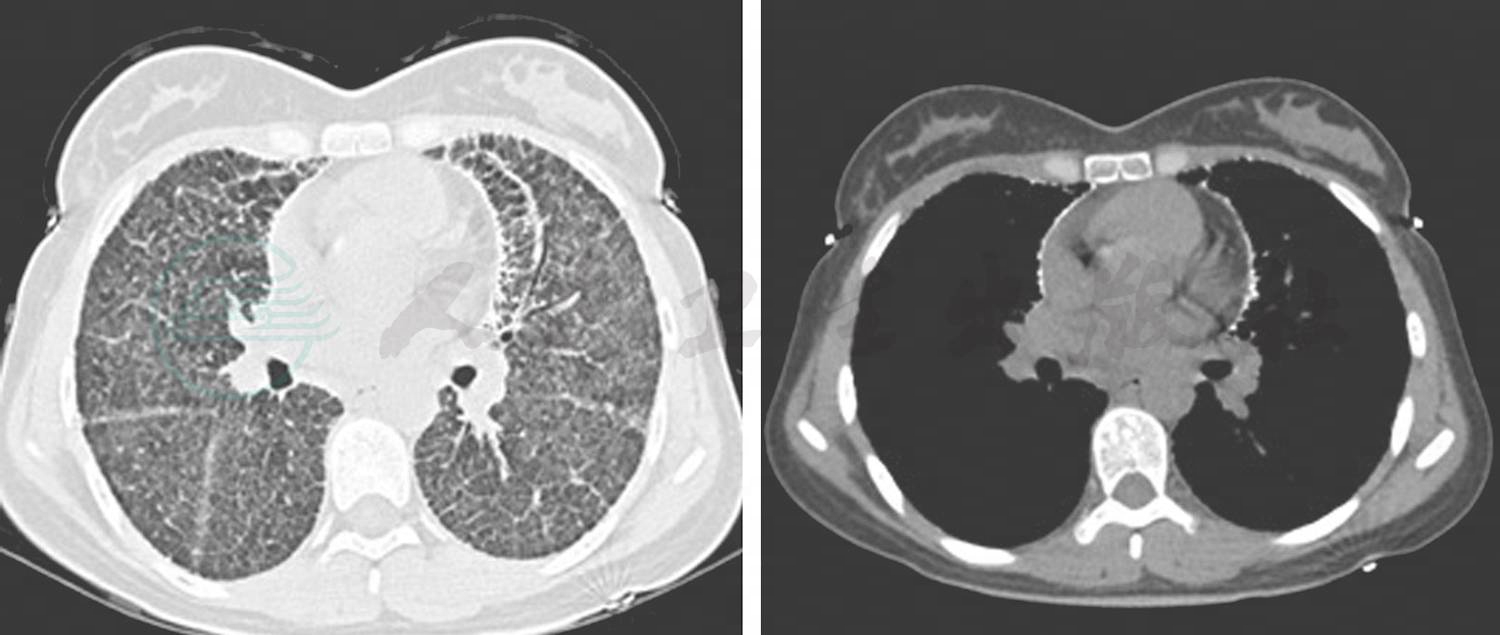
图2 本研究患者肺部CT表现
目前认为胸部影像学检查是早期发现PAM的有效手段,尽管影像表现较有特征性,但仍需要与粟粒性结核、硅沉着病等类似影像表现的疾病相鉴别。
随着影像学的技术进展,利用不同的影像学检查方法和总结PAM患者病程中的影像学变化特点已经能够对肺泡微结石症患者的疾病变化进行影像学分期。临床上对于PAM影像学分期不统一,综合相关文献[2,7,9],我们认为根据影像演变主要分为以下四期:①钙化前期:由于微结石形成的数量少且钙化程度轻微,影像学变化不典型,病情隐匿,在罹患PAM的无症状的儿童中偶可见到此期的影像改变[10]。②砂砾期:以弥散的直径小于1mm钙化微结节为特点,这些微结节轮廓清晰,大小均一、分布均匀。尽管微结石在肺间质和下肺更为集中,总体仍然呈砂纸样外观,此期心脏和膈肌轮廓清晰可见。这一期的影像表现主要在儿童和青春期的PAM患者中出现。③病变进展期:此期肺部微结节的大小和数量进一步增加,部分结节融合、大小不一,肺纹理增粗、紊乱,可见致密条索影,胸膜、心包膜增厚,心影、横膈影不清晰,此期影像学表现多见于年轻患者。④呼吸衰竭期:微结节的数量和大小进一步增加,肺间质和浆膜钙化加剧,肺影、心界模糊,部分病例可出现肺气肿、肺大疱、气胸等肺部并发症,这类影像学表现主要见于老年病患及终末期患者。
(4)鉴别诊断
目前认为胸部影像学检查是早期发现PAM的有效手段,尽管影像表现较有特征性,但仍需要与肺泡蛋白沉积症、粟粒性结核、硅沉着病等类似影像表现的疾病相鉴别。PAM通常需与以下疾病相鉴别,要点如下:
1)肺泡蛋白沉积症
常隐袭起病,常见的症状为慢性咳嗽、咳痰、活动后呼吸困难。影像特点是弥散分布于双肺的小叶中心性结节,结节的周围有“Y”字形或线状高密度影与其相连,表现为“树芽症”,后期可有小支气管扩张、肺透亮度增加、肺间质改变。
2)粟粒性肺结核
急性粟粒性肺结核结节“三均匀”(大小、密度及分布)弥散于两侧肺野,亚急性粟粒性肺结核结节分布以中上肺野分布为主。在病史的询问过程中要特别注意有无结核感染的中毒症状,可行结合临床症状、结核三项及T-SPOT试验以便鉴别。
3)硅沉着病
患者的病史中一般都有粉尘接触史。硅沉着病病人肺部影像结节大小不等,夹杂纤维网状结构,多可见间隔线。病变分布与支气管走行方向一致,Ⅱ期以上硅沉着病,两上肺常出现融合性矽结节。
4)肺含铁血黄素沉着症
本病多见于儿童,本病特征为肺毛细血管反复出血,含铁血黄素沉着于肺组织引起反应。早期胸片显示两肺广泛的大小数毫米斑点状阴影,以肺门及两中下肺野较多,但无胸膜下聚积现象,阴影可吸收。另外,结合血象缺铁性贫血及胃液内检出含铁血黄素细胞,可做出正确诊断。
根据患者较具特征性的影像表现以及与影像表现不对应的临床症状,结合家族史,无粉尘接触史即可作出临床诊断。高分辨率CT(high resolution CT,HRCT)对PAM的诊断和鉴别诊断具有决定性的作用,但病理确诊仍需要通过支气管镜活检术、肺泡灌洗术、胸腔镜检查、经皮肺穿刺术、痰检、外科手术肺活检获得结石依据[8]。
(5)病理特点
肉眼观察肺组织切面有砂砾感,质地稍硬;镜下见肺泡腔内可见同心层状钙化小体。早期肺泡腔内可见少许吞噬细胞,肺泡间隔及间质未见明显增生,有灶状淋巴细胞浸润,肺泡壁相对正常;晚期肺泡间隔增宽,纤维组织增生,较多炎细胞浸润,肺泡壁毛细血管床显著减少(图3)。
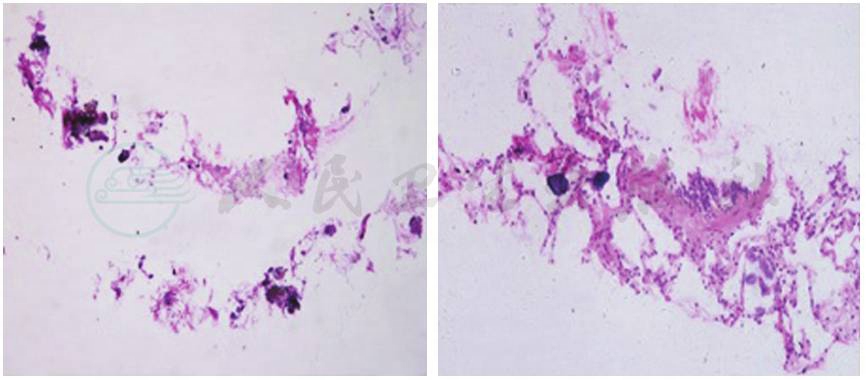
图3 本研究病例病理切片
(6)治疗
截至目前,还未发现切实有效的治疗方法来阻止PAM的病情进展,肺泡内结石的沉积与肺间质的炎症缓慢进展,最终导致肺纤维化、呼吸循环功能衰竭[4]。糖皮质激素以及支气管肺泡灌洗术被证实对PAM的治疗无效[11]。羟乙磷酸钠有抑制骨化作用,被认为是抑制微结石形成具有潜在疗效的药物,但是由于病例数太少,缺乏可靠的循证医学证据,临床效果不肯定,且长期使用导致副作用如佝偻病、骨折等[12,13]。目前针对PAM的治疗主要是止咳、祛痰、抗感染等对症支持治疗,改善患者症状。国外有对PAM病例进行双肺移植的报道,通过对移植病例的随访与观察认为双肺移植对于存在呼吸衰竭而不合并右心衰的PAM患者,能够有效地提高预期寿命和生存质量[14,15]。由于移植供体的稀少以及移植后排斥反应的存在,目前PAM患者的肺移植仅见个案报道,且预后不理想。目前PAM的致病基因已经明确,为PAM的“基因治疗”提供了可能性。
肺泡微结石症发病率低,临床症状缺乏特异性,其主要病理特点是肺泡内磷酸钙盐沉积,影像检查是早期发现和诊断PAM的主要手段,病理检查发现肺泡中磷酸钙盐结晶的存在是诊断的金标准。目前的治疗以对症支持缓解症状为主,条件许可的情况下可以考虑肺移植治疗。PAM的致病基因已经明确,为该病的“精准治疗”带来希望。
(肖 坤 杨晓丹 闫 鹏 解立新)
1.Castellana G,Carone D,Castellana M.Microlithiasis of seminal vesicles and severe oligoasthenospermia in pulmonary alveolar microlithiasis (PAM):report of an unusual sporadic case.International journal of fertility &sterility,2015,9(1):137-140.
2.Castellana G,Castellana G,Gentile M,et al.Pulmonary alveolar microlithiasis:review of the 1022 cases reported worldwide.European respiratory review:an official journal of the European Respiratory Society,2015,24(138):607-620.
3.Stokman L,Nossent E J,Grunberg K,et al.A case of pulmonary alveolar microlithiasis associated with a homozygous 195 kb deletion encompassing the entire SLC34A2 gene.Clinical case reports,2016,4(4):412-415.
4.Ferreira Francisco FA,Pereira e Silva JL,Hochhegger B,et al.Pulmonary alveolar microlithiasis.State-of-the-art review.Respiratory medicine,2013,107(1):1-9.
5.Al-Sardar H,Al-Habbo DJ,Al-Hayali RM.Pulmonary alveolar microlithiasis:report of two brothers with the same illness and review of literature.BMJ case reports,2014:3.
6.Santos MK.Diagnosis of pulmonary alveolar microlithiasis.Radiologia brasileira,2015,48(5):IX-X.
7.Francisco FA,Rodrigues RS,Barreto MM,et al.Can chest high-resolution computed tomography findings diagnose pulmonary alveolar microlithiasis? Radiologia brasileira,2015,48(4):205-210.
8.Abdalla G,Marchiori E,Zanetti G,et al.Pulmonary alveolar microlithiasis:a case report with emphasis on imaging findings.Case reports in medicine,2010,2010:819242.
9.Rea G,Sperandeo M,Sorrentino N,et al.Chest ultrasound findings in pulmonary alveolar microlithiasis.Journal of medical ultrasonics (2001),2015,42(4):591-594.
10.Kabir M L,Mollah A H,Mostafa G,et al.Pulmonary alveolar microlithiasis (PAM) in a child.Mymensingh medical journal,2013,22(4):836-839.
11.Tachibana T,Hagiwara K,Johkoh T.Pulmonary alveolar microlithiasis:review and management.Current opinion in pulmonary medicine,2009,15(5):486-490.
12.Ozcelik U,Yalcin E,Ariyurek M,et al.Long-term results of disodium etidronate treatment in pulmonary alveolar microlithiasis.Pediatric pulmonology,2010,45(5):514-517.
13.Ozcelik U,Gulsun M,Gocmen A,et al.Treatment and follow-up of pulmonary alveolar microlithiasis with disodium editronate:radiological demonstration.Pediatric radiology,2002,32(5):380-383.
14.Gucyetmez B,Ogan A,Cimet Ayyildiz A,et al.Lung transplantation in an intensive care patient with pulmonary alveolar microlithiasis - a case report.F1000Research,2014,3:118.
15.Borrelli R,Fossi A,Volterrani L,et al.Right single-lung transplantation for pulmonary alveolar microlithiasis.European journal of cardio-thoracic surgery:official journal of the European Association for Cardio-thoracic Surgery,2014,45(2):e40.













