女性,23岁。
全身水肿1个月,发热1天。
患者1个月前无诱因逐渐出现全身水肿,伴尿少。自服“中药”3天后,症状无好转;当地医院查尿常规:蛋白(+++),RBC 和 WBC 均阳性;ALB 27.2g/L,SCr 113.3μmol/L;血常规示三系减少;予甲泼尼龙40mg/d及对症治疗,症状好转。1天前发热,伴咽痛,水肿加重,尿量减少,当地予头孢类抗生素及降温等对症治疗;至我院急诊查血常规:WBC 18.9×109/L,PLT 110×109/L,Hb 105g/L;SCr 242μmol/L。 患者发病来神清,无皮疹、关节痛、光过敏、口腔溃疡,无口干、眼干。
无特殊。
BP 110/70mmHg,HR 82次/分。全身未见皮疹,浅表淋巴结未触及肿大。颜面、眼睑及双下肢水肿。心肺腹查体未见明显异常。
血常规:WBC 16.82×109/L,Hb 65g/L,PLT 63×109/L,Ret升高;外周血破碎 RBC 1%。尿检:PRO(+++),定量3.59g/d;RBC 多数/HP,正常形态为主;WBC 1~5/HP,多形核 55%。尿培养(-)。 生化:ALT、AST 正常,ALB 28.4g/L,SCr 358μmol/L,非结合胆红素 24μmol/L↑,LDH 297IU/L↑;凝血:D-二聚体 7.84mg/L↑,FDP 160mg/L↑,余未见异常。免疫学检查:C3 0.42g/L↓,C40.07g/L↓。 ANA(+),抗 ds-DNA 抗体(+),抗 SSA(+),余 ENA 谱(-);ACL(-)。Coombs试验(-)。PAIgG(-)。骨髓穿刺正常。双肾B超基本正常。UCG正常。乙肝五项及丙肝抗体均(-)。
系统性红斑狼疮 狼疮性肾炎 急性肾损伤
贫血、血小板减少原因待查 系统性红斑狼疮?血栓性微血管病?
患者青年女性,急性病程,多系统受累。①肾脏:表现为蛋白尿、非变形血尿、无菌性白细胞尿;在“上感”诱因下,出现急性肾损伤。②血液系统:表现为三系减少,激素治疗后三系均有上升;入院后完善骨穿等检查,无其他病因证据;提示可能存在自身免疫性疾病。
检查发现患者 ANA(+),抗 ds-DNA抗体(+);结合肾脏及血液系统表现,符合 ACR 1997年SLE诊断标准,系统性红斑狼疮(SLE)及狼疮肾炎(LN)诊断明确。但是该患者有两点比较特殊:①尿中RBC非变形,目前无泌尿外科疾病证据,当肾小球疾病较为严重例如新月体形成,或者血管病变时可出现非变形RBC;②患者外周血网织红细胞升高、外周血可见破碎RBC,血LDH、D-二聚体及FDP增高,提示微血管病性溶血及血栓形成。肾穿刺活检对于明确LN病理分型、判断病情活动及是否存在其他合并症具有重要价值。
患者于入院第4天行肾穿刺活检。免疫荧光:IgG(++),C3(++),颗粒样毛细血管壁、系膜区沉积(图1)。
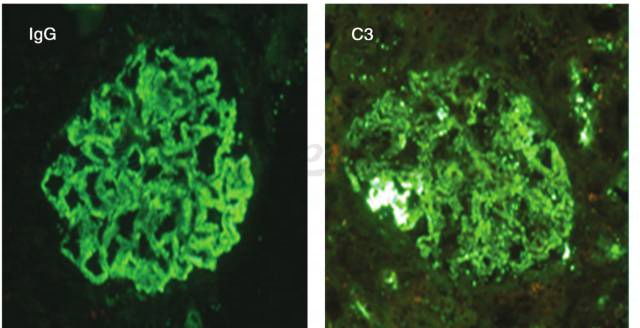
图1 狼疮性肾炎合并血栓性微血管病肾损害:IgG和C3沿肾小球毛细血管壁及系膜区颗粒状沉积(荧光×400)
光镜可见34个肾小球,肾小球系膜细胞和内皮细胞弥漫增生,白细胞浸润,基底膜增厚,部分缺血性皱缩,系膜区、上皮下、内皮下嗜复红蛋白沉积,局灶节段性微血栓及白金耳形成,部分缺血性皱缩;肾小管上皮细胞空泡及颗粒变性,局状及片状萎缩,肾间质灶状及片状淋巴和单核细胞浸润;小动脉管壁增厚,内膜肿胀伴血栓形成(图2);符合毛细血管内增生性狼疮肾炎伴基底膜增厚[Ⅳ-G(A)+V]伴血栓性微血管病(TMA)。
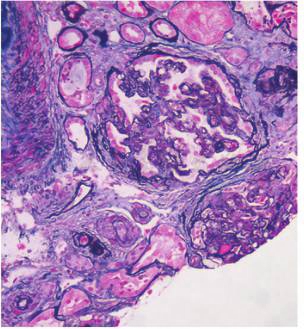
图2 狼疮性肾炎合并血栓性微血管病肾损害:肾小球内皮细胞弥漫性增生,缺血性皱缩,小动脉内膜水肿,内皮细胞肿胀(PASM×200)
电镜:肾小球系膜细胞和内皮细胞弥漫增生伴中性白细胞浸润,基底膜内疏松层增厚,上皮下、基底膜内、内皮下及系膜区均可见电子致密物沉积,上皮足突广泛融合;符合光镜诊断(图3)。
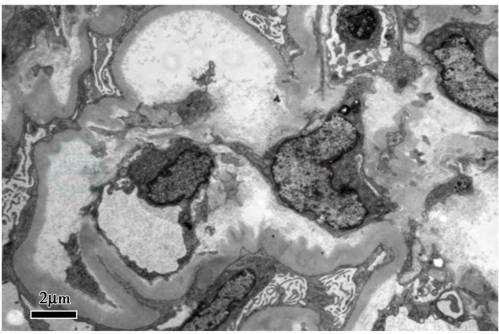
图3 狼疮性肾炎合并血栓性微血管病肾损害:肾小球基底膜内疏松层增厚,内皮下电子致密物沉积(电镜×6 000)
入院后SCr升至447μmol/L,予透析和甲泼尼龙40mg/d。肾穿刺明确病理诊断后,推测该患者的TMA系AKI的主要原因,但患者因经济原因拒绝血浆置换。鉴于其TMA可能与SLE的自身免疫机制相关,故予甲泼尼龙500mg/d连续3天,SCr和尿量渐正常,1周后加用静脉环磷酰胺0.4g;出院时Hb 89g/L,PLT正常,LDH转为正常。门诊规律激素减量及每月静脉滴注环磷酰胺,尿蛋白及血尿渐转阴,肾功能及血常规维持正常。
系统性红斑狼疮 狼疮性肾炎 毛细血管内增生性狼疮肾炎伴基底膜增厚[Ⅳ-G(A)+V]伴血栓性微血管病(TMA) 急性肾损伤→肾功能正常
SLE是我国最常见的自身免疫性疾病,肾脏受累时最常见病变为各种病理类型的肾小球肾炎。但是SLE的肾损害也可累及肾小管、肾间质及肾微血管;肾微血管病变主要分为5型:动脉和小动脉硬化、血管免疫复合物沉积、非炎症性坏死性血管病变、坏死性血管炎及TMA。本病例是一例LN合并TMA肾损害的典型范例。
LN中TMA发生率较低,目前尚无确切数字。LN中出现TMA,大多数学者认为TMA是继发于SLE,因为大多数相关病例报道均提示SLE诊断在前而TMA发生在后。
TMA是一组急性临床病理综合征。TMA包括溶血尿毒综合征和血栓性血小板减少性紫癜,其他还有恶性高血压、硬皮病肾危象、SLE、妊娠相关肾病等。TMA主要特征是微血管病性溶血性贫血、血小板减少及微血管内血栓形成。肾脏受累时多引起急性肾损伤,突出的病理表现有小动脉内皮增生、内皮下间隙增宽和管腔严重狭窄,管腔内可见血栓,受累血管供应的肾小球呈缺血改变;典型的肾小球病变为大量内皮细胞增生、肿胀,可见微血栓形成。不同病因引起的TMA发病机制不同,继发于SLE的TMA发病机制可能与相关的自身抗体(如抗ADAmT-13抗体)及补体过度激活有关。
活动性LN与TMA在临床上不易鉴别,但单纯活动性LN很少出现非免疫性溶血。另外,即使病理明确诊断为LN+TMA,也要考虑是否伴发以下情况:抗磷脂抗体综合征、硬皮病或恶性高血压等。
LN合并TMA的治疗首选血浆置换,同时强调激素及免疫抑制剂的规律治疗。虽然本例患者由于经济原因未行血浆置换,而使用了激素冲击并予正规活动性LN的诱导缓解治疗方案,取得了较好的结果,但长期疗效尚需关注。
1.当SLE患者出现微血管病性溶血性贫血,需警惕TMA。
2.LN合并TMA者应积极进行血浆疗法,同时进行免疫抑制治疗。
(于 峰 陈 旻)
1.Majithia V,Harisdangkul V.Thrombotic thrombocytopenic purpura in systemic lupus erythematosus:A frequent and severe consequence of active disease.Rheumatology (Oxford),2006,45(9):1170-1171.
2.Moake JL.Thrombotic microangiopathy.N Engl J Med,2002,347(8):589-600.
3.Tsai HM,Lian EC.Antibodies to von Willebrand factor-cleaving protease in acute thrombotic thrombocytopenic purpura.N Engl J Med,1998,339(22):1585-1594.
4.Allford SL,Hunt BJ,Rose P,et al.Guidelines on the diagnosis and management of the thrombotic microangiopathic haemolytic anemia.Br J Haematol,2003,120(4):556-573.
5.Wu LH,Yu F,Tan Y,et al.Inclusion of renal vascular lesions in the 2003 ISN/RPS system for classifying lupus nephritis improves renal outcome predictions.Kidney Int,2013,83(4):715-723.
6.Song D,Wu LH,Wang FM,et al.The Spectrum of Renal Thrombotic Microangiopathy in Lupus Nephritis.Arthritis Res Ther,2013,15(1):R12.
7.Li QY,Yu F,Zhou FD,et al.Plasmapheresis is Associated with Better Renal Outcomes in Lupus Nephritis patients with Thrombotic Microangiopathy:A Case Series Study.Medicine,2016,95(18):e3595.













