患者男性,29岁。主因“发热伴咳嗽20余天”入院。2017年5月11日无明显诱因出现发热伴咳嗽,咳少量白痰。体温37.7℃,16:00左右体温开始升高至第2天清晨有所降低,体温变化超过1℃。遂至上海市某三级医院就诊,予莫西沙星+头孢吡肟抗感染治疗,无效后改为莫西沙星+万古霉素+亚胺培南西司他丁/美罗培南抗感染治疗,加用地塞米松抗炎,患者体温渐恢复正常,但是停药后再次出现高热。2017年5月26日外院胸部CT示:右肺下叶炎症,右侧胸腔积液。胸腔积液细胞学检查未见肿瘤细胞,ADA升高(具体不详)。出院后,继续口服莫西沙星、头孢地尼等,体温渐正常,停药后再次出现高热,发热症状未见改善。为进一步诊治,收入我科。
入院查体
T 38.7℃,P 80次/min,R 20次/min,BP 117/61mmHg。 步入病房,精神尚可。巩膜黄染,全身浅表淋巴结无肿大。右下肺呼吸音粗糙,余双肺呼吸音清晰,未闻及干、湿性啰音,未闻及胸膜摩擦音。心率80次/min,律齐,各瓣膜听诊区未闻及病理性杂音。肝肋下未触及,脾肋下两指可触及,肝肾区无叩击痛,移动性浊音阴性。左下肢水肿。生理反射存在,病理反射未引出。
既往史及个人史
2016年3月确诊“NK/T细胞淋巴瘤Ⅱ期”。于2016年4月1日行DICE方案化疗(地塞米松、异环磷酰胺、顺铂和依托泊泔)2周期及放疗21次。之后未再行放化疗及淋巴瘤相关治疗。否认吸烟饮酒史,否认高血压、糖尿病史,否认食物药物过敏史。
初步诊断
1.肺部阴影待查
2.NK/T细胞淋巴瘤放化疗后
问题1:患者肺部阴影是感染吗?
综合分析患者病情有以下特点:①青年男性,以发热伴咳嗽急性起病;②胸部CT报告右下肺阴影;③外院反复抗感染治理无法退热;似乎对糖皮质激素治疗有效;④确诊“NK/T细胞淋巴瘤Ⅱ期”,淋巴瘤放化疗后观察1年余。年轻男性发热、咳嗽伴肺部阴影,首先应考虑社区获得性肺炎,但是外院按照社区获得性肺炎抗感染治疗无显效,提示患者可能为特殊病原感染或者原有NK/T细胞淋巴瘤复发所致肺浸润。为明确诊断,我们完善了以下检查:
辅助检查(2017-06-14)
血常规:白细胞:0.72×109/L↓,红细胞:4.05×1012/L↓,血红蛋白:117g/L↓,血细胞比容:35.4%↓,中性粒细胞及淋巴细胞:数量少,难以分类,血小板:35×109/L↓。
肝、肾功能、电解质:丙氨酸转氨酶:584U/L↑,天冬氨酸转氨酶:383U/L↑,总胆红素:99.3μmol/L↑,结合胆红素:85.2μmol/L↑,总胆汁酸:407μmol/L↑,碱性磷酸酶:528U/L↑,γ-谷氨酰转移酶:305U/L↑,总蛋白:52g/L↓,白蛋白:31g/L↓,球蛋白:21g/L,白球比例:1.48,前白蛋白:80mg/L↓,钾:4.4mmol/L,钠:134mmol/L↓,氯化物:102mmol/L,二氧化碳结合力:17.7mmol/L↓,血钙:2.03mmol/L↓,无机磷:1.28mmol/L,血镁:0.84mmol/L,尿素:6mmol/L,肌酐:53μmol/L,尿酸:0.206mmol/L。
血脂全套:胆固醇:2.16mmol/L↓,甘油三酯:3.2mmol/L↑,高密度脂蛋白胆固醇:0.27mmol/L↓,低密度脂蛋白胆固醇:0.68mmol/L↓。
血沉:2mm/h,C 反应蛋白:29.5mg/L↑。RF、抗“O”正常。
降钙素原:0.51ng/ml。
T-SPOT:抗原 A(ESAT-6)孔:0,抗原 B(CFP-10)孔:0。
G试验(血浆 1-3-B-D葡聚糖):<10pg/ml。
血清铁蛋白:1 500μg/L。
胸部增强CT示:肺部阴影,右侧胸腔积液(图1)。
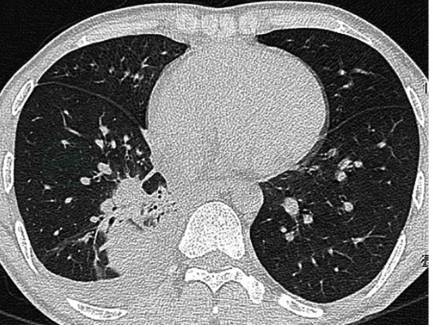
图1 胸部CT扫描:右下叶内侧基底段结节影和实变影;右侧少量胸腔积液
引自:主编:.呼吸与危重症医学疑难与危重病例精选.第1版.ISBN:978-7-117-30147-3
入院后立即予以美罗培南、万古霉素联合抗感染治疗,患者病情无改善,仍有高热。综合分析上述检查结果:①血常规示三系显著下降,血清铁蛋白显著升高,无PCT升高,无其他病原学证据,提示三系减低继发于恶性病变可能性大;②肝功能检查提示转氨酶和胆红素显著升高,总蛋白和白蛋白显著下降,提示可能为恶性病变肝转移或恶病质的表现;③结合患者淋巴瘤病史,考虑患者淋巴瘤复发,合并骨髓浸润和肝脏浸润。为明确诊断需行骨髓穿刺活检和肺穿刺活检,但是患者目前血小板、白细胞明显减少,有出血和感染风险,暂不予胸腔穿刺及气管镜检查。经过充分与患者及家属沟通后行骨髓穿刺活检。
骨髓流式细胞学检查提示:4.4%异常NK细胞,其中较小NK淋巴细胞占3%,大NK淋巴细胞约占1.4%。
T、B、NK细胞分类:CD3+T细胞:60%,CD4+T细胞:22%↓,CD8+T细胞:29%,CD4+/CD8+:0.76↓,CD19+B 细胞:9%,NK细胞:29%↑,T+B+NK 细胞:98%。
骨髓穿刺活检结果提示患者NK/T细胞淋巴瘤复发;肺部实变影临床考虑为肺继发性淋巴瘤;肝功能异常临床考虑淋巴瘤所致肝损害。
问题2:患者三系下降和凝血功能异常的原因是什么?
患者入院后给予连续血常规监测提示三系持续下降(表1),给予升白细胞、升血小板和血小板输注治疗,患者改善不明显。
表1 血常规监测
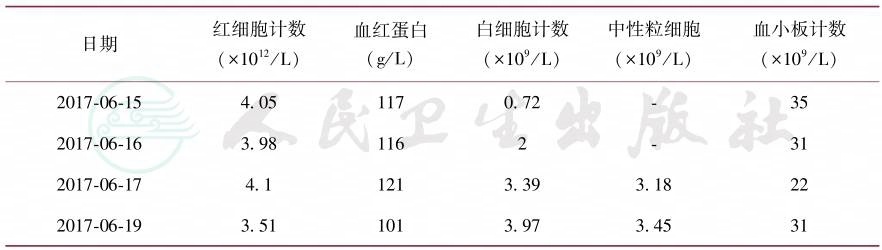
日期 红细胞计数 (×1012/L) 血红蛋白 (g/L) 白细胞计数 (×109/L) 中性粒细胞 (×109/L) 血小板计数 (×109/L) |
2017-06-15 4.05 117 0.72 - 35 2017-06-16 3.98 116 2 - 31 2017-06-17 4.1 121 3.39 3.18 22 2017-06-19 3.51 101 3.97 3.45 31 |
引自:主编:.呼吸与危重症医学疑难与危重病例精选.第1版.ISBN:978-7-117-30147-3
患者三系减低必然影响凝血功能,凝血功能监测提示患者纤维蛋白原持续下降,最低至0.8g/L;D-二聚体持续升高,提示患者纤溶系统显著激活(表2)。
表2 凝血功能监测
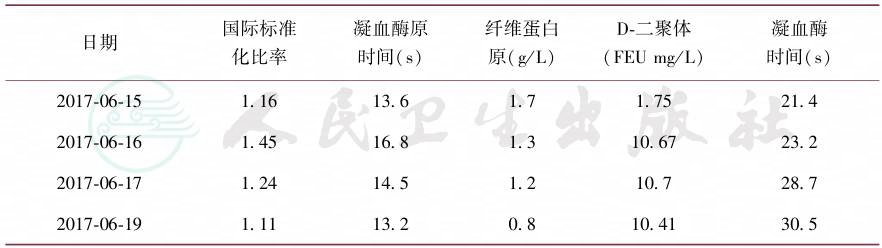
日期 国际标准 化比率 凝血酶原 时间(s) 纤维蛋白 原(g/L) D-二聚体 (FEU mg/L) 凝血酶 时间(s) |
2017-06-15 1.16 13.6 1.7 1.75 21.4 2017-06-16 1.45 16.8 1.3 10.67 23.2 2017-06-17 1.24 14.5 1.2 10.7 28.7 2017-06-19 1.11 13.2 0.8 10.41 30.5 |
引自:主编:.呼吸与危重症医学疑难与危重病例精选.第1版.ISBN:978-7-117-30147-3
综合以上检查结果,患者临床表现有高热、肝脾肿大、3系血细胞减少、高甘油三酯血症和低纤维蛋白原血症的特点;骨髓穿刺活检结果提示NK/T细胞淋巴瘤复发;考虑患者在淋巴瘤病情复发进展的基础上并发继发性噬血细胞综合征。
问题3:什么是噬血细胞综合征?如何诊断?
噬血细胞综合征(HPS)又称嗜血细胞性淋巴组织细胞增多症(HLH),是一组因遗传性或获得性免疫缺陷导致的以过度炎症反应为特征的疾病,于1975年由Chandra首先报道,临床以发热、肝脾肿大、全血细胞减少、凝血障碍以及组织细胞吞噬形态完整的红细胞、白细胞和血小板为主要表现的临床症候群。
根据2004年国际组织细胞协会修订的诊断标准,满足以下2条之一即可建立噬血细胞综合征诊断:
1.分子生物学诊断符合HPS,包括编码穿孔素的基因突变、UNC13D基因突变、STXI1及RARB27a基因突变等。
2.符合HPS的临床诊断标准(以下8项中的5项)
(1)发热:持续≥7天,体温≥38.5℃;
(2)脾肿大:肋缘下≥3cm;
(3)血细胞减少,累及三系中的至少两系:血红蛋白<90g/L,血小板<100×109/L,中性粒细胞<1.0×109/L;
(4)甘油三酯≥3.0mmol/L和/或纤维蛋白原<1.5g/L;
(5)骨髓、肝、脾、淋巴结中的噬血现象;
(6)NK细胞活性减低或缺乏;
(7)铁蛋白≥500mg/L;
(8)sCD25≥2 400U/ml。
该患者符合第2条的1~4项和6~7项,结合NK/T细胞淋巴瘤复发,可临床诊断为继发性噬血细胞综合征。
1.NK/T细胞淋巴瘤(骨髓、肝脏浸润)
2.继发性噬血细胞综合征
3.淋巴瘤肺浸润
患者转入血液科继续治疗随访。
1.继发性HPS的常见病因
HPS分为两大类:一类为原发性或家族性疾病,又称家族性血细胞吞噬性网状细胞增生症,为较罕见的综合征,发生于0~2岁的婴幼儿,为常染色体隐性遗传,预后差,5年存活率只有17%。另一类为继发性疾病,潜在的疾病或原因包括感染(病毒、细菌、真菌、支原体、立克次体、寄生虫)、血液肿瘤(尤其是淋巴瘤)、非血液肿瘤(转移性肿瘤、胃癌和恶性畸胎瘤等)、免疫反应性疾病(系统性红斑狼疮、类风湿关节炎、脂膜炎、结节病和溃疡性结肠炎等)、免疫缺陷状态(免疫抑制剂和/或细胞毒药物治疗后、脾切除后和成人呼吸窘迫综合征等),其中以淋巴瘤为继发性HPS的常见原因。
2.HPS的治疗
包括对症支持治疗、消除诱因、抑制炎症反应和组织细胞增殖以及造血干细胞移植。HPS的支持治疗可参照全身炎症反应综合征和多器官功能衰竭患者的治疗标准。此外,HPS患者自发性出血风险很高。对于急性出血病人可输注血小板、新鲜冰冻血浆或Ⅶ因子。继发于感染的HPS合并中性粒细胞缺乏时可采用GCSF治疗;继发于全身性自身免疫性疾病的HPS多使用甲泼尼龙冲击治疗;出现中枢神经系统受累时,首选地塞米松,它比泼尼松和甲泼尼龙更易穿透血-脑脊液屏障。环孢素是一个比较常用的免疫抑制药物,在自身免疫性疾病中可使存活率达到76%。成人复发或重症HPS推荐使用依托泊苷。HPS死亡率可高达41%,与原发病相关。恶性肿瘤尤其是NK或T细胞淋巴瘤伴发的HPS预后差,病毒感染或免疫系统疾病继发的HPS预后好。HPS治愈后一般较少复发。
(周霞 张有志 李圣青)
[1]HENTER J I,HORNE A,ARICÓ M,et al.HLH-2004:Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J].Pediatric Blood Cancer,2007,48(2):124-131.
[2]赵明哲,赵维莅,沈志祥.成人嗜血细胞综合征19例临床分析[J].上海交通大学学报(医学版),2010,30(10):1300-1302.













