患者女性,49岁,职员。主因“间断发热3个月,双侧胸痛1个月余”入院。患者于2017年6月无明显诱因下出现间断发热,体温38~39℃,最高达40℃,呈周期性,周期为10天左右,伴咳嗽,少量白色黏液痰,难以咳出,伴畏寒、肌肉酸痛、全身乏力,无头晕、头痛、胸痛、胸闷、心悸、鼻塞流涕、恶心呕吐等,自服感冒药或大汗后可自行退热。2017年7月27日于当地医院就诊,胸部CT平扫示:双肺多发小空泡影伴少许炎性改变(图1A、B)。血常规:白细胞:13×109/L,中性粒细胞:9.2×109/L。予以“莫西沙星、热毒宁”等治疗,仍有间断发热。2017年8月11日出现双侧胸部多处阵痛,均因用力诱发,如咳嗽、喘息、翻身运动等,持续几秒钟即可缓解,无胸闷心悸、无腹痛及肩背部放射痛。外院行胸部CT平扫加增强示:左肺下叶近胸膜处占位,双肺多发结节(图1C、D)。肺穿刺活检示:肺组织慢性炎症伴炎性渗出及坏死。先后予“美洛西林舒巴坦、依替米星、氟康唑、利奈唑胺”等治疗,间断高热,胸痛较前无明显变化。2017年9月20日于我院复查胸部薄层CT示:双肺多发结节影、斑片状高密度影和空洞影(图1E、F)。现为进一步诊治收住入院。患病以来精神好,胃纳可,睡眠好,大小便正常,无明显体重下降。
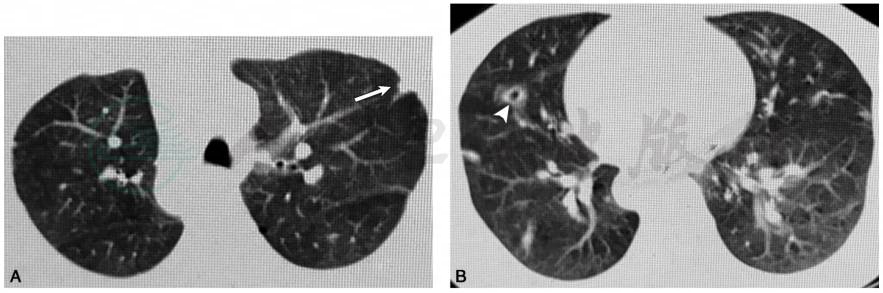
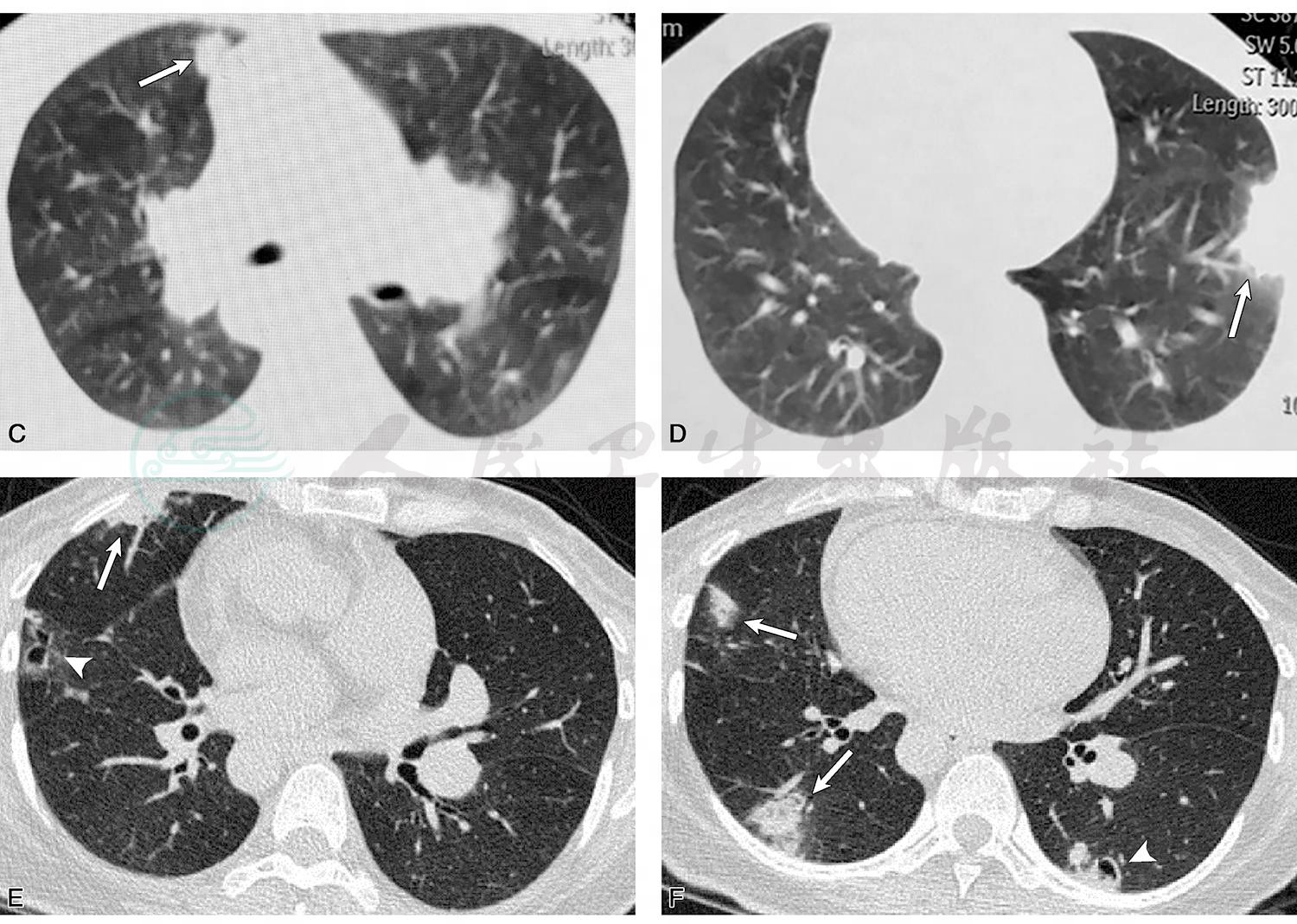
图1 胸部CT平扫(2017-07-27)示左肺上叶尖后段胸膜下楔形实变影(白箭,A),右肺中叶外侧段实变伴空洞影(白箭头,B);外院抗感染治疗后复查胸部CT平扫(2017-08-14)示肺部病灶较前进展,右肺中叶内侧段(C)和左肺下页外侧基底段(D)胸膜下楔形实变影;外院抗感染升级治疗后再次于我院复查胸部薄层CT(2017-09-20)示右肺中叶胸膜下楔形实变影(白箭)和空洞影(白箭头,E);F.右肺中叶外侧段和下叶后基底段胸膜下实变影(白箭),左肺下叶后基底段结节影和空洞影(白箭头),总体病灶特点表现为多发,游走和空洞化,抗感染治疗下病灶持续进展
入院查体
T 37℃,P 79 次/min,R 19 次/min,BP 160/100mmHg,MEWS 评分:1 分,身高:160cm,体重:52kg。神志清楚,发育正常,营养好,步入病房。全身皮肤、黏膜未见异常,全身浅表淋巴结无肿大。头颅无畸形,眼睑正常,睑结膜未见异常,巩膜无黄染。双侧瞳孔等大等圆,对光反射灵敏。耳郭无畸形,外耳道无异常分泌物,无乳突压痛。外鼻无畸形,左侧鼻通气不良,鼻中隔无偏曲,鼻翼无扇动,两侧鼻旁窦区无压痛。口唇无发绀。双腮腺区无肿大。颈软,无抵抗,颈静脉无怒张。气管居中,甲状腺无肿大。胸廓对称无畸形,胸骨无压痛,双肺呼吸音清晰,未闻及干、湿性啰音。心率79次/min,律齐,各瓣膜听诊区均可闻及3/6级全期吹风样杂音。腹平软,全腹无压痛及反跳痛,肝脾肋下未触及,肝肾区无叩击痛。脊柱、四肢无畸形。关节无红肿,无杵状指(趾),双下肢无水肿。四肢肌力正常,肌张力正常,生理反射正常,病理反射未引出。
既往史及个人史
有先天性心脏病,室间隔缺损,双向分流,肺动脉狭窄史;先天性全内脏镜像转位史;高血压病史,未规律用药;甲状腺结节史;否认糖尿病史。手术史:1995年行剖宫产术,术顺,诞1健康女婴;2003年行异位妊娠相关手术,具体不详;2005年行肺动脉狭窄球囊扩张术,中途终止手术。否认传染病史;否认外伤史;否认食物、药物过敏史;否认中毒输血史;否认吸烟、酗酒史。已绝经,否认家族遗传性疾病史。
辅助检查
肺穿刺活检(外院,2017-08):肺组织慢性炎症伴炎性渗出及坏死。
初步诊断
1.发热伴肺部阴影待查
2.先天性心脏病:室间隔缺损,双向分流,肺动脉狭窄
3.先天性全内脏镜像转位
4.高血压病
5.甲状腺结节
问题1:患者抗感治疗无效的原因?
患者病情特点总结:①以高热伴肺部阴影起病,病程中出现剧烈胸痛。②胸部CT示双肺多发结节影、实变影和空洞影,多在胸膜下分布,有一定的游走性。③外院肺穿刺病理示:肺组织慢性炎症伴炎性渗出及坏死。④外院曾先后予以多种广谱抗生素联合治疗,症状均无改善。综合分析患者抗感染无效的原因如下:①特殊病原感染,既往所用抗生素未覆盖病原。②非感染性疾病:患者胸部CT特征提示自身免疫性疾病、肺梗死和血管炎等。为明确诊断,入院后给予以下检查:
辅助检查
血常规:白细胞:7.29×109/L,血红蛋白:94g/L↓,中性粒细胞:64.5%,淋巴细胞:24.1%,单核细胞:10.8%↑,嗜酸性粒细胞:0.3%↓,血小板计数:362×109/L↑。
尿常规、粪常规、肝肾功能、电解质、血糖:均正常。
血沉:65mm/h↑;降钙素原:0.11ng/ml↑;CRP:27.5mg/L↑。
血培养:阴性。
心脏超声:先天性心脏病;右位心;矫正性大血管转位;肺动脉瓣或瓣下狭窄,峰值压差76mmHg;流入道部大室间隔缺损,双向分流;轻度三尖瓣反流;冠状动脉起源肺动脉可能;未见心脏赘生物附着。
根据以上检查结果,白细胞正常范围,降钙素原和CRP增高均在3倍以内,暂不考虑细菌感染。为明确是否存在结核、真菌或其他特殊、少见病原感染,进一步行以下检查:
G试验(真菌D-葡聚糖检测):230.1pg/ml↑,乳胶凝集试验:阴性。
T-SPOT:A 孔:19,B 孔:16。
电子支气管镜:气管、左右主支气管、各叶、段及亚段支气管管腔通畅,黏膜光滑、未见出血、新生物。
支气管灌洗液常规:颜色:无色,透明度:微浑浊,红细胞:55×106/L,有核细胞:110×106/L,中性粒细胞:55%,淋巴细胞:35%,间皮细胞:10%。
支气管灌洗液细菌、真菌、抗酸杆菌涂片和培养:均阴性。
支气管灌洗液mNGS病原检测:阴性。
结合上述检查结果,排除患者感染性疾病可能。
问题2:患者为哪一种非感染性疾病呢?
结合患者病史特点,非感染性疾病应考虑累及肺血管的一大类疾病,包括:肺栓塞、肺梗死、结缔组织疾病肺受累和肺血管炎等。继续完善以下检查:
辅助检查
免疫固定电泳:IgE:<45.84ng/ml,IgG:10.3g/L,IgA:1.31g/L,IgM:0.78g/L,单克隆免疫球蛋白:未发现。
补体 C3:1.43g/L,补体 C4:0.37g/L,抗“O”:<51.90IU/ml。
免疫标志物:抗核抗体:阳性+,滴度:1∶100,核型:细胞质,均质,dsDNA 定量:1IU/ml,ENA 抗体:阴性,抗中性粒细胞胞浆抗体(ANCA):PR3:<2RU/ml,MPO:<2RU/ml,cANCA:阴性,pANCA:阴性,CCP 抗体:0.4RU/ml,类风湿因子:<10.40IU/ml,抗心磷脂抗体:3.2RU/ml。
肺动脉CTA:未见明显栓塞征象。
双肺通气-灌注显像:未见明显栓塞征象。
骨髓活检:骨髓活检示大片骨小梁融合,见5~6个髓腔,造血细胞占40%左右,巨核细胞可见,各系造血细胞未见明显异常。
肺穿刺病理:轻度慢性炎症伴纤维组织增生。免疫组化结果:CK(上皮+),VIM(间质+),CgA(-),Syn(-),TTF-1(上皮+),WT-1(-),LCA(淋巴细胞+),P63(-),Napsin A(+),P40(-)。 特殊染色:银染(-),特染 PAS(-),抗酸(-)。
鼻窦CT平扫示(本院,图2):蝶窦炎症,左侧鼻甲肥厚。
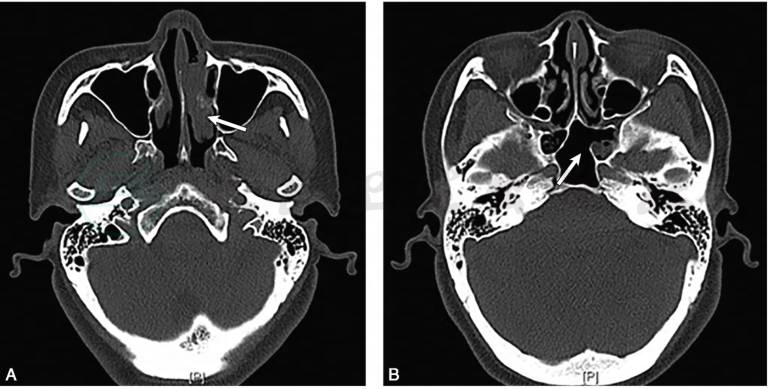
图2 鼻窦CT平扫
A.左鼻甲肥厚(白箭);B.蝶窦炎症(白箭)
引自:主编:.呼吸与危重症医学疑难与危重病例精选.第1版.ISBN:978-7-117-30147-3
综合分析以上检查结果,可基本除外肺栓塞、肺梗死和结缔组织疾病等。由于患者肺动脉CTA无大动脉受累,无嗜酸粒细胞升高和哮喘,无咯血和肾功能损害;依据鼻窦和肺受累表现,BALF以中性粒细胞为主,病理曾报告坏死性炎症,应重点考虑肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA)的诊断。GPA是一种坏死性肉芽肿性血管炎,病理以血管壁的炎症为特征,主要侵犯上、下呼吸道和肾脏。临床常表现为鼻和鼻旁窦炎、肺部病变和进行性肾功能衰竭;还可累及关节、眼、皮肤,亦可侵及眼、心脏、神经系统及耳等。
根据1990年美国风湿病学会制定的GPA诊断标准:①鼻或口腔炎症:痛性或无痛性口腔溃疡,脓性或血性鼻腔分泌物;②胸片异常:结节、固定浸润灶或空洞;③尿沉渣异常:镜下血尿(RBC>5个/高倍视野)或红细胞管型;④病理为肉芽肿性炎:动脉壁或动脉周围,或血管外区有中性粒细胞浸润。符合以上4条中2条或2条以上时即可诊断。该患者具备上下呼吸道的损害,病理报告坏死性炎症,因此GPA诊断明确,由于肾脏未受累,且ANCA阴性,故诊断为ANCA阴性局限性GPA。
问题3:如何选择治疗方案?
GPA的治疗可分为3期:即诱导缓解期、维持缓解期以及控制复发期。糖皮质激素加环磷酰胺联合治疗有显著疗效,特别是肾脏受累以及具有严重呼吸系统疾病的患者,应作为首选治疗方案。具体治疗方案应根据系统性血管炎累及脏器的数目、肾脏受累程度和有无弥漫性肺泡出血而定。单用糖皮质激素只能缓解呼吸道症状,不能阻止肾脏病变的进展。目前针对局限性肉芽肿性多血管炎尚无特别的治疗方案推荐。我们根据自己的临床经验并综合国内外多个病例报道,制定了个体化的治疗方案。
1.局限性肉芽肿性多血管炎,ANCA阴性
2.先天性心脏病,室间隔缺损,双向分流,肺动脉狭窄
3.先天性全内脏镜像转位
4.高血压病
5.甲状腺结节
1.醋酸泼尼松片,25mg/d,晨服;
2.艾司奥美拉唑镁肠溶片,20mg/d,口服;
3.碳酸钙D3片,2片/d,口服。
患者激素治疗1周后体温下降至正常范围,胸痛、咳嗽明显好转出院。院外继续口服激素治疗。2017年11月16日复查胸部CT平扫:病灶较前明显吸收(图3A、B),予以激素逐渐减量维持。2018年2月1日复查胸部CT平扫:病灶进一步吸收好转,病情维持稳定(图3C、D)。
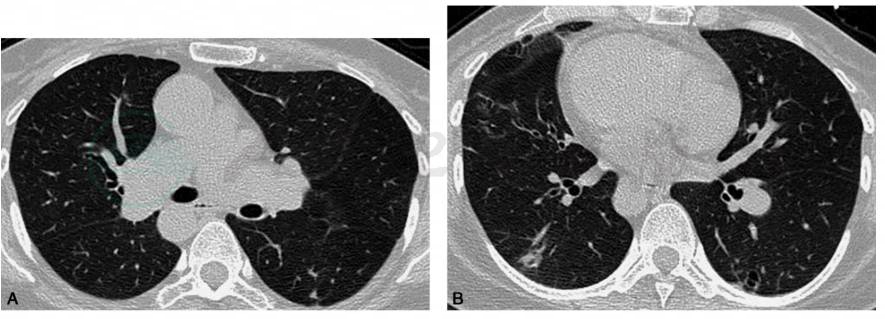
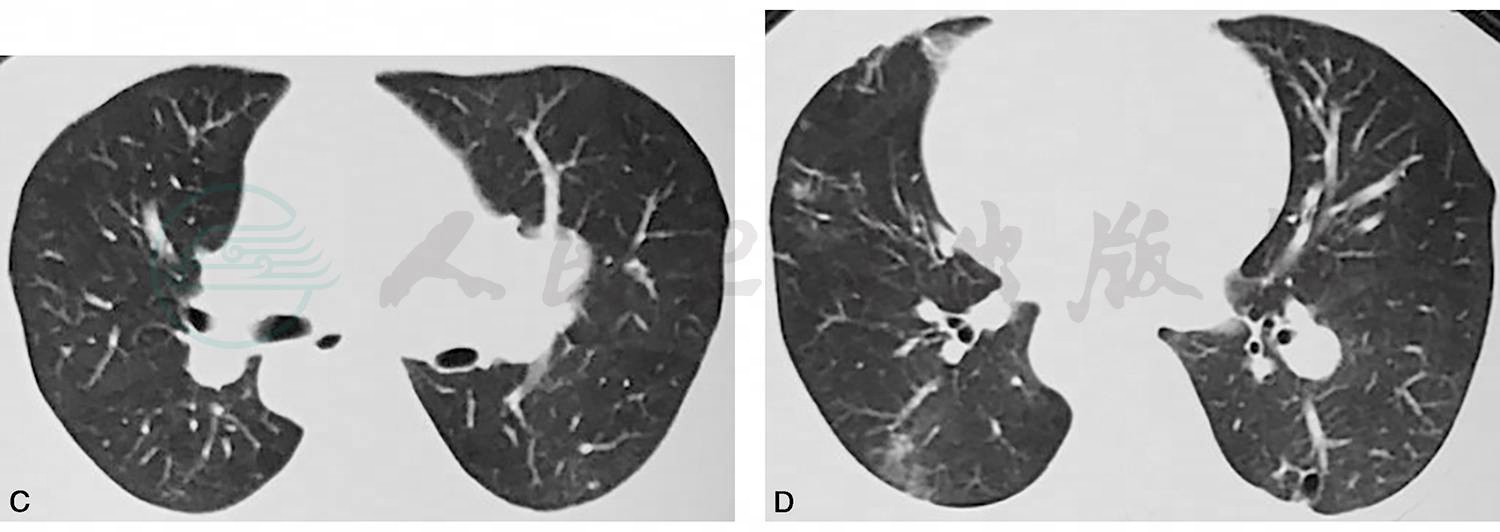
图3 口服醋酸泼尼松,25mg/d,1个月后复查胸部CT平扫示肺部病灶大部分吸收、消散(A、B);口服激素3个月后复查胸部CT平扫示肺部病灶基本维持稳定(C、D)
1.肺部阴影伴发热的鉴别诊断
肺部阴影伴发热是临床常见的就诊原因,对于此类患者应进行详细的病史采集、体格检查和感染相关指标检查。首先考虑常见的肺部感染性疾病;在除外感染性疾病后可根据影像学特点进行非感染性疾病的鉴别诊断。如为气腔/肺实质受累为主,需考虑炎症性肺癌、机化性肺炎、嗜酸性粒细胞性肺炎、过敏性肺炎等;如为肺血管病变为主,需考虑肺栓塞、ANCA相关血管炎、结缔组织疾病肺受累等;如为肺间质病变为主,需考虑间质性肺病等疾病。
2.GPA的临床特点
GPA原名韦格纳肉芽肿,2012年由Chapel Hill共识会议(Chapel Hill Consensus Conference,CHCC)更名为GPA。GPA是一种伴坏死的肉芽肿性血管炎,病因未明,易累及上下呼吸道,坏死性血管炎主要累及小血管和中等程度的血管(如毛细血管、小动脉、小静脉、动脉、静脉)。肾脏常常受累,坏死性的肾小球肾炎常见,并非一定存在。c-ANCA是GPA的标志性抗体,但不是GPA诊断所必须的。GPA的肺部影像学最常见的异常是双肺多发结节影,边界清晰,约50%伴无液平空洞。亦可见斑片样磨玻璃影,反晕征或致密实变影伴支气管充气征。糖皮质激素和环磷酰胺是治疗GPA的基本用药。单用糖皮质激素仅适用于局限性肉芽肿性多血管炎,具体治疗方案需根据个体情况制定。
3.GPA的病理特征
GPA的三个主要组织病理学特征:①炎症结节中的中、小动脉,毛细血管和小静脉的炎症。②区域性坏死,血管炎区域有中性粒细胞浸润和微脓肿形成。③坏死性和非坏死性肉芽肿性炎症。GPA的组织病理诊断较难,活检主要显示非特异性炎症或坏死,显示血管炎的病理不足20%。若肺脏有累及,通过支气管镜肺活检病理诊断率不足10%,有时需要外科肺活检诊断(胸腔镜或者开胸)。
(董樑 李圣青)
[1]发热伴肺部阴影鉴别诊断共识专家组.发热伴肺部阴影鉴别诊断专家共识[J].中华结核和呼吸杂志,2016,39(3):169-176.
[2]李圣青.肺血管病及疑难病例解析[J].北京:人民卫生出版社,2017:418-425.
[3]HOMMA S,SUZUKI A,SATO K.Pulmonary involvement in ANCA-associated vasculitis from the view of the pulmonologist[J].Clin Exp Nephrol,2013,17(5):667-671.













