一、病史简介
(一)一般资料
女性,50岁,湖南娄底人,2017年2月18日第一次入住我院肾内科。
(二)主诉
精神异常、发现肌酐增高8月,左上肢肿胀5月。
(三)现病史
患者工作时与人争吵后出现精神行为异常,表现为“被害妄想”,头颅CT、磁共振检查未见异常。患者就诊于某医院精神科,口服药物治疗(具体用药不详)后症状稍有缓解。此后精神症状反复出现,于2016年8月15日就诊于当地医院,检查发现尿蛋白(++)、血肌酐1 200μmol/L,诊断“慢性肾炎综合征,CKD5期”,予以血液透析治疗后精神症状明显缓解。为建立长期血管通路,患者于2016年9月12日行左前臂动静脉内瘘成形术。术后出现左上肢肿胀,考虑因术后充血水肿导致,未予特殊处理,嘱患者出院观察。出院后患者未进行血透治疗,血肌酐维持在100~200μmol/L。患者左上肢肿胀逐渐加重,遂于2017年1月23日再次入住当地医院并行内瘘结扎术,术后左上肢肿胀仍未缓解。为求进一步诊治,患者于2017年2月18日第一次入住我院肾内科。
(四)既往史
体健,无高血压、糖尿病史;否认肝炎、结核病史及其密切接触史。
(五)个人史
无特殊,无毒物接触史。
(六)月经史及婚育史
 48,21岁结婚,生育1子1女,顺产,无流产史。配偶及儿女体健。
48,21岁结婚,生育1子1女,顺产,无流产史。配偶及儿女体健。
(七)家族史
无特殊。
二、入院检查
(一)体格检查
1.体温36.6℃,心率 90次/min,呼吸 20次/min,BP 155/105mmHg(双侧上、下肢血压无明显差异)。
2.慢性病容,胸壁可见静脉显露,左侧明显。
3.双肺未闻及明显湿啰音,心界无扩大。
4.腹软,无压痛反跳痛、腹部移动性浊音阴性。
5.双下肢轻度对称凹陷性浮肿。
6.左上肢浮肿明显(左上臂围33cm,右上臂围23cm)(图1)。
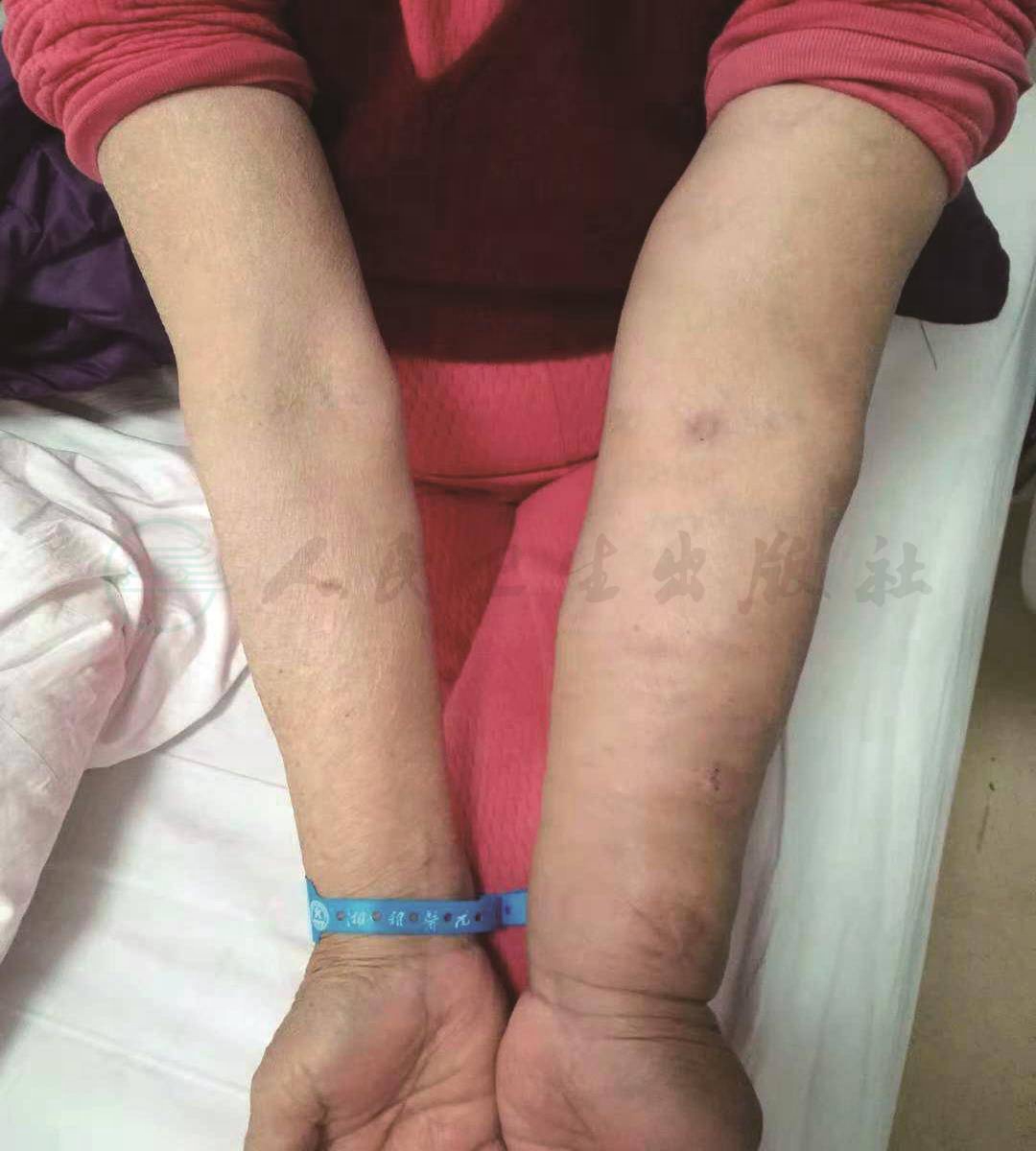
图1 患者左上肢浮肿
(二)辅助检查
1.实验室检查
(1)血常规
Hb 102g/L,PLT 206×109/L,WBC 8.2×109/L。
(2)尿沉渣分析+蛋白定性
镜检RBC 0~2个/HP,尿蛋白(+),0.56g/24h。
(3)肝功能
TP 65.5g/L,ALB 32.1g/L,GLO 33.4g/L,A/G 1.0,余正常。
(4)肾功能
BUN 11.51mmol/L,Cr 186μmol/L,UA 473.9μmol/L。
(5)血糖、血脂
大致正常。
(6)免疫全套
C4 123mg/L,C3 754mg/L,IgG 16g/L,IgA 809mg/L。
(7)狼疮全套
ANA(1:80 颗粒型)、抗双链 DNA(-)。
(8)ANA全套
抗nRNP/Sm抗体弱阳性、抗Sm抗体弱阳性。
(9)血管炎三项+ANCA
阴性。
(10)血、尿免疫固定电泳
阴性。
(11)凝血常规
血浆纤维蛋白原降解产物11.2mg/L,D-二聚体1.26mg/L,余正常。
2.影像学检查
(1)胸片
心影增大,双肺纹理增粗。
(2)腹部彩超
左肾91mm×41mm,右肾94mm×35mm,双肾实质病变A级,血流分布正常。
(3)心脏彩超
左房、左室大;二尖瓣及肺动脉瓣轻度反流;三尖瓣中度反流;左心功能减退(射血分数48%);少量心包积液。
(4)血管彩超
①左侧颈内静脉血栓形成;②左侧锁骨下静脉血栓形成;③左侧头静脉血栓形成。
三、入院诊断
(一)慢性肾功能不全CKD3期
肾性贫血
(二)肿胀手综合征
(三)高血压病2级极高危
高血压心脏病
(四)手术后状态(左侧动静脉内瘘结扎术后)
四、治疗和转归
通过血管通路多学科联合会诊,考虑患者系静脉血栓导致内瘘术后肿胀手,尽管左上肢肿胀病程有5个月,但是肿胀程度在进行性加重,超声也提示有新发血栓形成,有溶栓的指征。予以尿激酶溶栓、低分子肝素抗凝及弹力绷带加压等处理,患者左上肢肿胀明显缓解。出院后嘱患者予以华法林抗凝治疗2.5mg,每日1次起,根据INR水平调整剂量,INR水平控制在2~3之间,疗程3个月。
一、病史介绍
患者因腹胀4个月,于2017年8月15日、2017年9月22日、2017年11月12日多次入住我院肾内科。
患者入院前在外院检查发现大量腹水,多次行腹腔穿刺引流,病因不明确,腹水顽固性增长。
二、入院检查
(一)体格检查
1.体温36.8℃,心率 91次/min,呼吸20次 /min,血压 96/62mmHg(双侧上、下肢血压无明显差异)。
2.双侧颈静脉充盈,双下肺呼吸音低,双上肺可闻及散在湿啰音。
3.腹膨隆,腹壁张力大,脐外突,胸、腹壁静脉显露,腹部张力大,移动性浊音阳性。
4.双下肢皮温低,四肢无明显浮肿。
(二)辅助检查
1.实验室检查
(1)血常规:Hb 98g/L,PLT 90×109/L,WBC 8.2×109/L。
(2)肝功能:ALB 30.2g/L,余正常。
(3)肾功能:BUN 10.21mmol/L,Cr 164μmol/L,UA 414.8μmol/L。
(4)免疫全套:C4 110mg/L,C3 499mg/L。
(5)风湿全套+狼疮全套+ANA全套+自身免疫性肝炎全套:ANA 1:80(颗粒型)。
(6)血管炎三项+ANCA:阴性。
(7)凝血常规:血浆纤维蛋白原降解产物9.2mg/L,D-二聚体1.51mg/L,余正常。
(8)腹水常规:微混,比重1.022,李凡它试验弱阳性,细胞总数880×106/L,WBC 50×106/L,多核细胞10%,单核细胞90%。
(9)腹水生化:TP 34.4g/L,ALB 15g/L,GLO 18.9g/L,LDH 108IU/L,ADA 5.1IU/L。
(10)抗心磷脂抗体:弱阳性。
(11)β2糖蛋白 1(β2GP1)IgG:阴性。
(12)狼疮抗凝物:初筛(LA1)91.8s,确诊(LA2)37.4s。
(13)Ham’s试验阴性、Coomb’s试验阴性。
(14)蛋白C、蛋白S、抗凝血酶Ⅲ水平正常。
2.影像学检查
腹部彩超:
(2018年2月)左肾85mm×41mm,右肾83mm×35mm,双肾实质病变B级,血流分布减少。
(2017年8月)左肾91mm×41mm,右肾94mm×35mm,双肾实质病变A级,血流分布正常。
三、临床分析和进一步检查
(一)腹水查因
根据腹水的SAAG分类,患者SAAG≥11g/L(15g/L),高梯度腹水提示存在门静脉高压,可见肝实质病变:肝硬化、酒精性肝炎、暴发性肝衰竭、肝癌(原发或转移)、妊娠脂肪肝等;或肝血管病变:Budd-Chiari综合征、肝小静脉闭锁症、门静脉血栓形成等;或心源性腹水。根据患者既往没有饮酒、肝病病史,肝功能正常、超声未见肝硬化及占位等情况,可排除肝实质病变。为进一步排除心源性腹水及肝血管病变导致的腹水,我们进一步完善了心脏彩超和下腔静脉CTV、CTA(图2)。
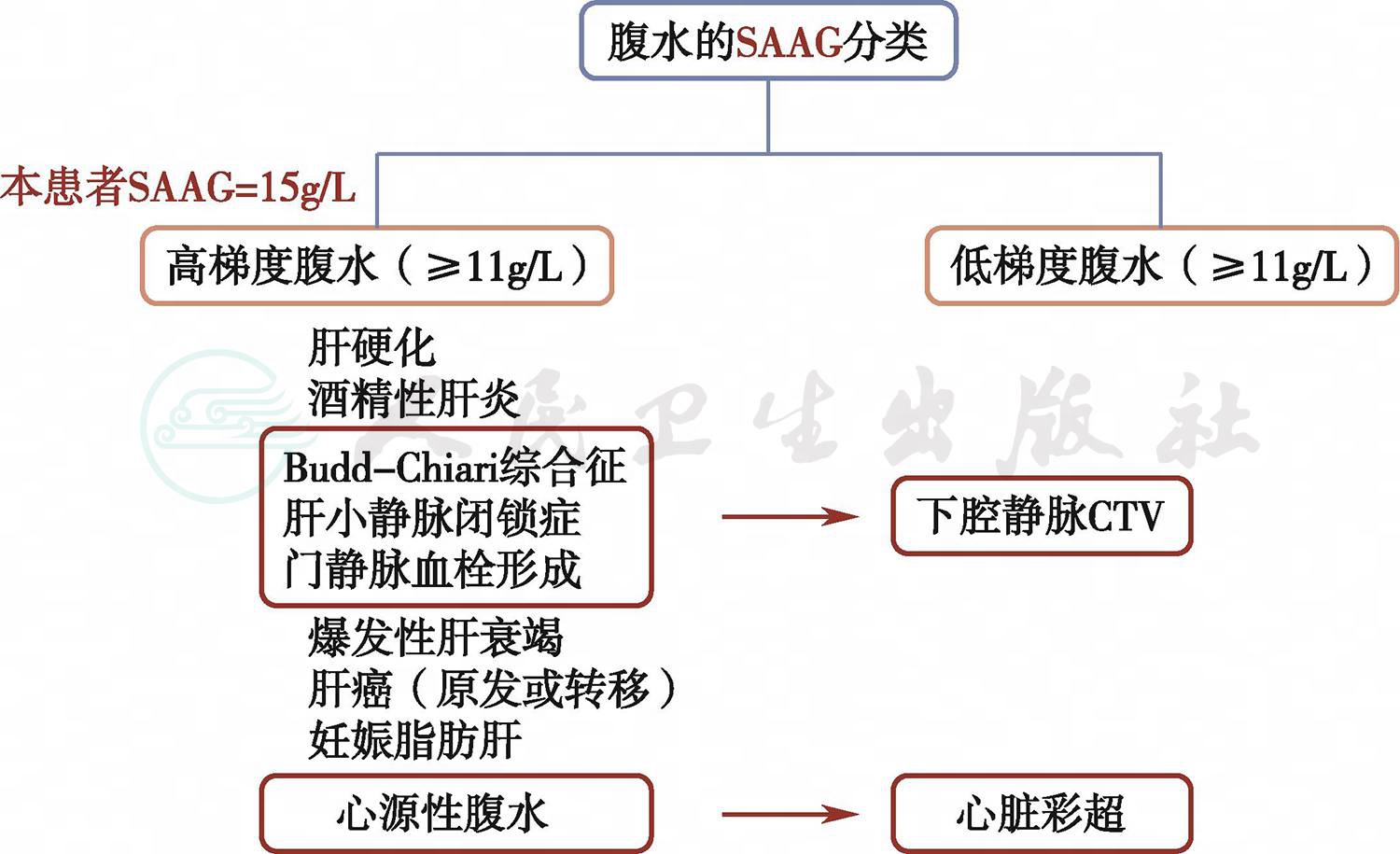
图2 腹水查因诊断思路
1.心脏彩超(表1)
2017年2月3日:左房、左室大,左心功能减退。
2017年8月30日:左房、左室、右房大,肺动脉高压,下腔静脉增宽。
2017年9月25日:全心大,肺动脉高压,下腔静脉增宽。
表1 心脏彩超结果
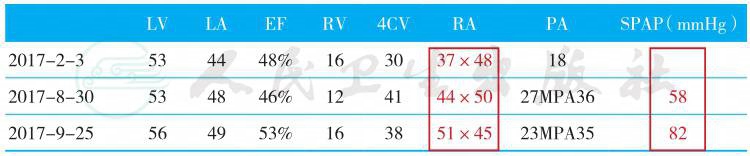
LV LA EF RV 4CV RA PA SPAP(mmHg) |
2017-2-3 53 44 48% 16 30 37×48 18 |
2017-8-30 53 48 46% 12 41 44×50 27MPA36 58 |
2017-9-25 56 49 53% 16 38 51×45 23MPA35 82 |
2.下腔静脉CTV
下腔静脉、肝静脉、门静脉显影均未见明显异常。
3.腹主动脉CTA
(1)腹主动脉L1水平以下,双侧髂总动脉管腔未见充盈(图3),管腔缩小,血栓形成?
(2)右肾动脉较细,左肾动脉未见显影(图3)。

图3 腹主动脉CTA
(红色箭头示双侧髂总动脉管腔未见充盈,蓝色箭头示右肾动脉较细,左肾动脉未见显影)
(二)肺动脉高压查因
患者心脏彩超提示进行性肺动脉高压,肺动脉高压常见以下情况(图4)。
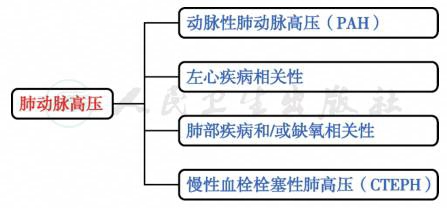
图4 肺动脉高压诊断思路
1.动脉性肺动脉高压
患者没有引起动脉性肺动脉高压的相关基础疾病,如系统性红斑狼疮、HIV感染及先心病等。
2.左心疾病相关性肺动脉高压
患者射血分数仅有轻中度下降,有无进行性加重的趋势,且患者无先心病等病史,无瓣膜病变的依据。左心疾病导致的肺动脉高压依据不充分。
3.肺部疾病和/或缺氧相关性肺动脉高压
患者无慢性阻塞性肺疾病、间质性肺病、睡眠呼吸障碍、肺泡低通气综合征及肺发育异常等病史,也无长期居住在高原的个人史,不支持肺部疾病和或缺氧导致的肺动脉高压。
4.慢性血栓栓塞性肺高压
考虑患者存在多处动、静脉血栓,不排除可能存在慢性血栓栓塞性肺高压,为进一步明确诊断,我们完善了肺动脉CTA。肺动脉CTA示多处肺动脉充盈缺损(图5),提示肺动脉栓塞。

图5 肺动脉CTA(红色箭头示多处肺动脉充盈缺损)
(三)血栓查因诊断思路(图6)
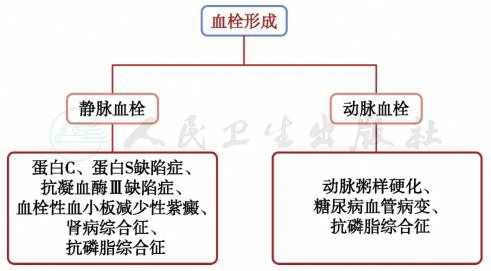
图6 血栓形成诊断思路
1.患者蛋白C、蛋白S、抗凝血酶Ⅲ水平正常,不支持蛋白C、蛋白S、抗凝血酶Ⅲ缺陷症。
2.TTP
支持点:患者起病时有一过性精神障碍,出现了肾脏损害。
不支持点:患者无血管内溶血的依据、仅有轻度贫血及血小板下降,在未接受血浆置换和免疫抑制剂治疗的情况下,病情没有急剧恶化。
3.患者无肾病综合征、糖尿病病史,不支持肾病综合征及糖尿病血管病变。
4.患者无高血脂病史,颈动脉等多处大动脉未见斑块形成,不支持动脉粥样硬化诊断。
5.APS 一组由aPL介导的,以动静脉血栓形成为特征的非器官特异的自身免疫性疾病,又称休氏综合征,男女比例1∶9。主要临床表现为血管栓塞(反复、动脉、静脉),自发性、难治性流产(90%由APS引起),血小板减少。其他临床表现包括相关肾病(肾动脉血栓、狭窄、肾性高血压、肾静脉血栓)及神经精神症状(偏头痛、舞蹈病、癫痫、吉兰巴雷综合征)。根据2006年修订的札幌APS分类诊断标准,确诊APS至少要满足一项临床诊断标准(血栓形成或病理性妊娠)和一项实验室诊断标准的aPL阳性反应,实验室的标准为至少发生两次抗磷脂抗体aPL阳性反应(a.血浆LA阳性;b.中→高滴度IgG/M类ACL;c.IgG/M类抗β2GP1),时间间隔不少于12周[1-2]。回顾患者的病例特点:50岁女性,起病隐匿,病变累及多系统,多处动、静脉血栓形成,伴PLT下降。APS诊断的实验室指标:抗心磷脂抗体弱阳性、狼疮抗凝物初筛(LA1)91.8s,确诊(LA2)37.4 (LA1/LA2=2.5)。临床诊断支持APS。但是鉴于APS诊断标准,需要两次以上阳性的实验室的标准,间隔≥12周,我们动态观察aPL的结果(表2)。
表2 抗磷脂抗体结果

注:间隔≥12周,且≥2次检出。
日期 ACA lgA ACA lgM ACA lgG β2GP1 LA1 初筛 LA1/LA2 比值 LA2 确诊 |
8.15 - - 弱阳性 6.09(≤20) 91.8s 37.4s 2.5 9.25 - - 弱阳性 4.11(≤20) 90.9s 38.7s 2.3 11.20 - - 弱阳性 6.11(≤20) 103.0s 54.9s 1.9 |
四、诊治过程和随访
在动态观察抗磷脂抗体的同时,给予患者低分子肝素、华法林抗凝治疗;甲强龙30mg,口服,每日1次,抑制免疫;波生坦控制肺动脉高压等治疗。患者病情继续加重,最终因多器官功能衰竭去世。
五、最后诊断及诊断依据
(一)最后诊断
恶性APS
(二)诊断依据
50岁女性,起病隐匿,病变累及多系统,多处动、静脉血栓形成,伴血小板下降。APS诊断的实验室指标:抗心磷脂抗体弱阳性、狼疮抗凝物阳性(检测间隔≥12周,≥2次)。APS常继发于其他自身免疫性疾病如系统性红斑狼疮、类风湿关节炎等,我们多次完善相关检查,未发现以上继发因素的诊断依据。患者广泛血栓形成、多器官功能衰竭甚至死亡、起病隐匿,符合恶性APS诊断。
[1]DELPAPA N,VASO N. Management of antiphospholipid syndrome. Ther Adv Musculoskelet Dis,2010,2(4):221-227.
[2]SCIASCIA S,AMIGO MC,ROCCATELLO D,et al. Diagnosing antiphospholipid syndrome:‘extracriteria’ manifestations and technical advances. Nat Rev Rheumatol,2017 Sep,13(9):548-560.
[3]CERVERA R,RODRÍGUEZ-PINTÓ I. Catastrophic antiphospholipid syndrome: task force report summary. Lupus,2014,23(12): 1283-1285.
[4] ABREU MM,DANOWSKI A,WAHL DG,et al. The relevance of “non-criteria”clinical manifestations of antiphospholipid syndrome: 14th international congress on antiphospholipid antibodies technical task force report on antiphospholipid syndrome clinical features. Autoimmun Rev,2015,14(5): 401-414.













