进展期近端胃癌根治术是否需要联合脾脏切除的争议由来已久。主要聚焦于两点:其一,从满足根治要求的角度而言,有无预防性切脾的必要性;其二,脾脏在肿瘤免疫中的功能以及脾脏切除对患者抗肿瘤免疫功能的影响。就现有相关文献而论,真正符合循证医学要求的前瞻性随机对照研究尚不多见。
1. 病史
患者上腹部胀痛不适1年,当地医院行胃镜检查,提示贲门胃底占位,就诊于笔者单位,胃镜检查提示贲门及胃底小弯侧和后壁肿物,活检为腺癌,为进一步诊治收入院。查体:未见明确阳性体征。实验室检查:肝肾功能未见异常,血CEA、CA19-9、CA72-4均处正常范围。
2. 影像学检查
(1) Bus:
正常。
(2) 上消化道气钡双重对比造影(图22-1):
胃癌侵及贲门及胃小弯上段。
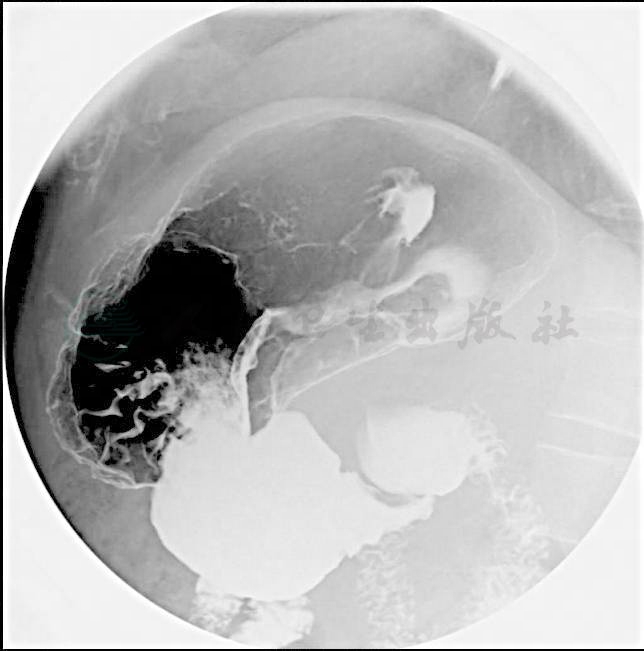
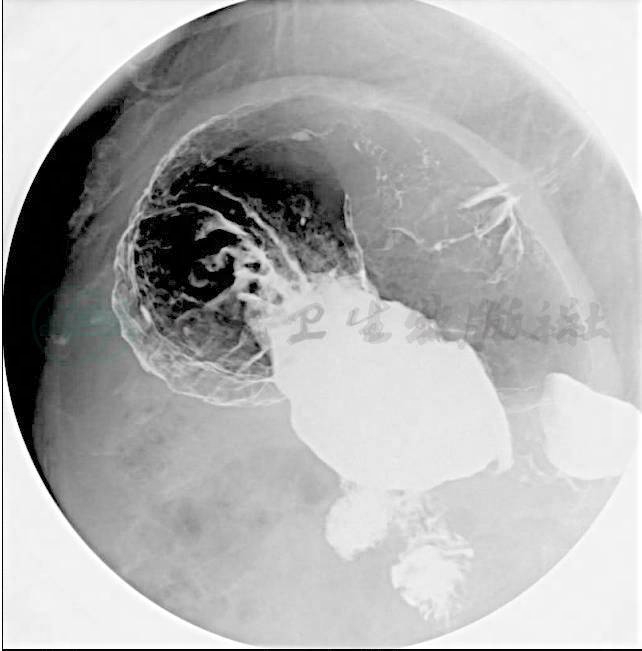
图1 上消化道气钡双重对比造影
(3) 腹部CT(图2):
贲门及胃体病变,考虑为癌,胃左淋巴结转移。
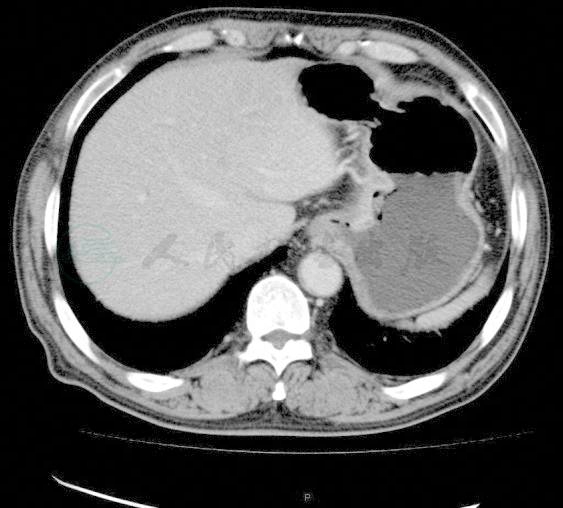
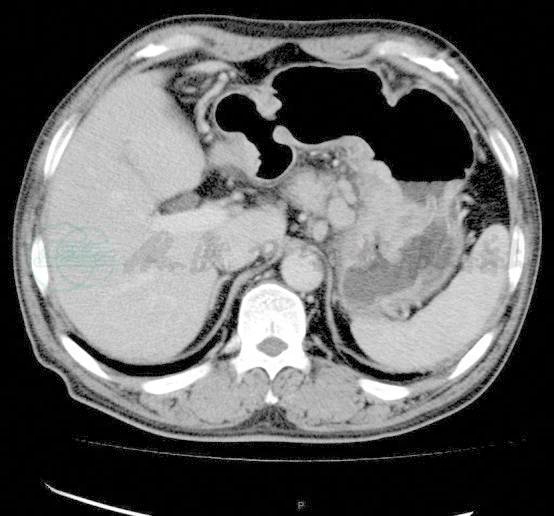
图2 腹部CT
3. 内镜检查
贲门及胃底小弯和后壁距门齿44~50cm处肿物生长,肿物表面糜烂溃疡,活检病理为腺癌。
操作细节(图3~图5)
(1)探查结果:探查腹腔无腹水,网膜、腹膜及盆腔未见转移播散结节,肝脏无转移结节。肿瘤位于胃底小弯侧胃后壁,未累及贲门,直径约3cm,局部胃壁僵硬,肿瘤后壁累及浆膜层。
(2)手术方式:根据术中所见,肿瘤位于胃上部1/3,且胃底贲门部癌灶大小未超过一个分区,决定行近端胃大部切除术+D2淋巴结清扫术。
(3)游离胰尾和脾脏,轻轻牵拉横结肠,显露横结肠系膜,沿胰腺下缘向左切开后腹膜,术者左手插入胰体后面,向上牵拉胰体尾部,向胰腺体尾侧行钝性分离胰腺背侧到Toldt融合筋膜层,把胰腺体尾部从后腹膜Toldt筋膜上游离,沿此间隙向脾脏下极方向剥离切断脾结肠韧带。左手轻轻分离托起脾脏后面,切开脾脏外侧后腹膜到脾脏上极,胰腺体尾部和脾脏后面放入大纱布垫,使脾门部变浅易于清扫。注意正确的解剖层次,Toldt筋膜浅层有毛细血管网,拉伤后易渗血,妨碍手术操作,游离脾脏后面时勿损伤左侧肾上腺和血管。
(4)脾门淋巴结清扫,结扎切断脾脏下极前面的小动静脉,勿损伤脾脏被膜,脾门部最下方开始由脾下极向脾上极方向腹膜内注入生理盐水,使脂肪组织和脾门部动静脉分离,在脾上、下极动脉分界处平行切开脾胃韧带前叶,左手示指伸入脾门处,切开脾胃韧带前叶,从脾下极开始用解剖剪刀仔细清扫脾门部脂肪组织和淋巴结,显露脾动、静脉分支。结扎切断1~3胃网膜左动脉分支根部,因胃网膜左动脉分支类型较多,注意勿损伤脾动脉上、下干或下极支。向上切开脾胃韧带前叶上半,清扫胃短动脉周围脂肪组织和淋巴结,切断胃短动脉,把胃大弯和大网膜轻轻向上牵拉,沿脾动脉干向近侧清扫,切断和胰腺相连的大网膜,清扫胰尾部周围脂肪组织,仅残留胰腺实质,注意对胰尾周围脂肪组织的中小血管进行止血。胰尾最下端有时存在脾下极动脉和胰尾动脉、结扎切断胰尾动脉,保留脾下极动脉。显露胰腺并沿胰腺上缘脾动脉干清扫,把No10、No11组淋巴结整块切除。
术后图示:
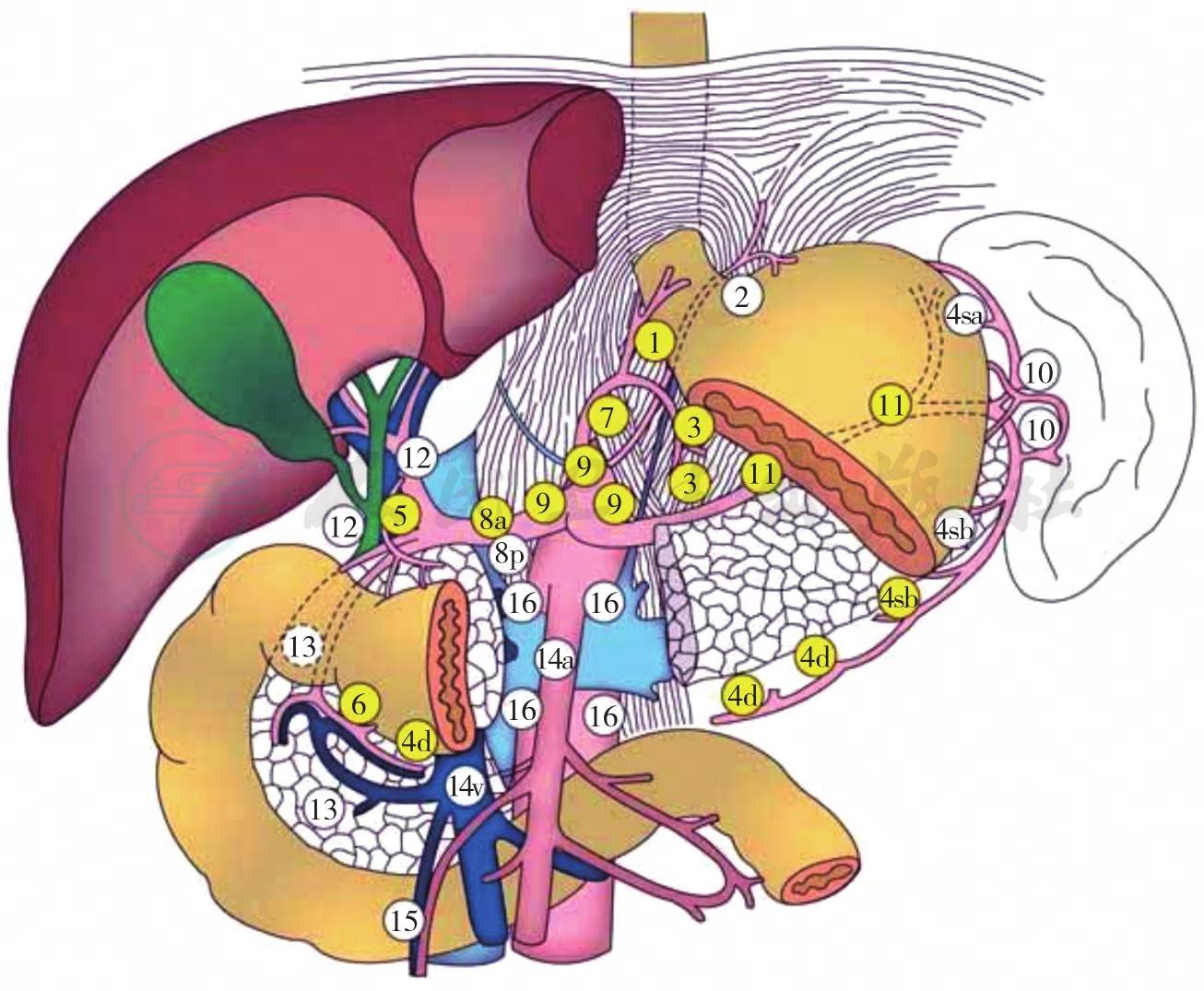
图3 胃癌区域淋巴结分站分组

图4 显露脾门,探查No.10、No.11组淋巴结
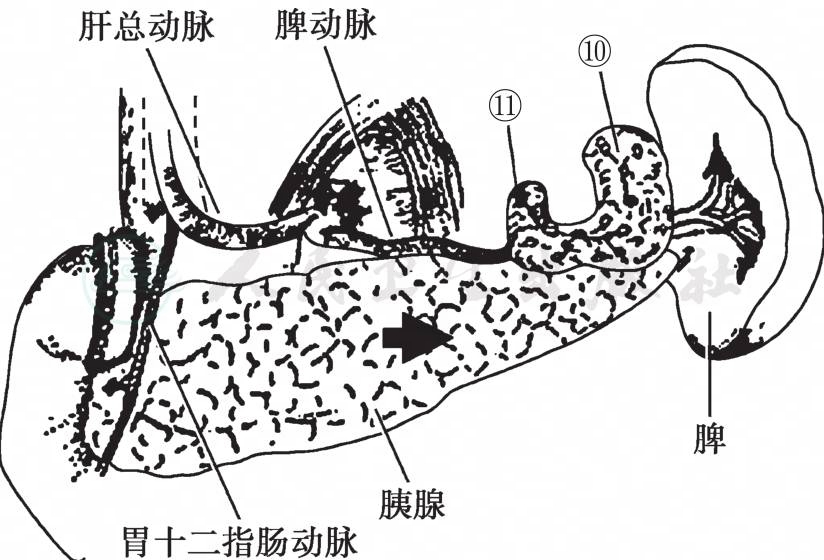
图5 第10、11组淋巴结清扫(保留脾脏)
术后病理及疗效观察:
(1)大体病理(图6)
(2)镜下病理:胃底小弯侧局限溃疡型低分化腺癌,伴神经内分泌分化,肿瘤浸透肌层达浆膜下脂肪,未累及食管下段,未累及大网膜。淋巴结转移性癌(4/43)。
其中No1:0/2,No2:0/5,No3:3/15,No4:1/6,No5:0/2,No7+9:0/2,No8a+12a:0/6, No10+11:0/5。
(3)随访:患者术后恢复良好,术后1个月后予以辅助化疗,方案为5-Fu +替吉奥,共化疗10周期。定期随访至今已10个月,无肿瘤复发迹象。

图6 大体病理













