【疾病概述】
Peutz-Jeghers综合征又称家族性黏膜皮肤色素沉着胃肠道息肉病,简称黑斑息肉综合征。
1896年Hutchinson首先报道了1对孪生女孩的上唇有黑色素斑点,1919年其同事Weber报道了两姊妹中的1个在20岁时死于肠套叠。1921年Peutz报道了一家三代人中曾有7人患小肠息肉病,口唇和颊黏膜有黑色素斑点。描述了本病的家族遗传性。1949年Jeghers会同Mckusick和Katz等收集了世界文献22例,并报道了自己的10例,强调了本病的家族遗传性及皮肤、黏膜色素斑的特点,引起了广泛注意。1954年Bruwer等首次使用Peutz-Jeghers综合征(Peutz-Jeghers’ssyndrome,PJS)这一名称。
该综合征具有三大特征:①特定部位皮肤及黏膜的色素沉着,以口腔及口唇黏膜最多见,其次为手掌、足底,超过1/3的病例有颜面部色素沉着。②多发性胃肠道息肉,息肉可以发生在胃至直肠的任何部位,而以空肠和回肠最为多见,其次为十二指肠,有约1/3的病例累及结肠和直肠,约1/4的病例累及胃。多发性息肉累及部位依次为小肠、胃及十二指肠、结肠,部分累及全消化道。③遗传性,Peutz-Jeghers综合征是一种常染色体显性遗传病,有很高的外显率,男性和女性均可携带因子,家族中数人发病者并不少见,约有30%~50%的患者有阳性家族史。
皮肤黏膜的黑斑常自幼小时即可被发现,但胃肠道息肉常随着年龄增长逐渐增大才会引起临床症状,故就诊时患者年龄稍大,有文献报道首次就诊患者多为儿童或青少年,皮肤黏膜黑斑分布于唇周和双侧手指或足趾,会影响美容外观,但其不会引起临床症状。胃肠道息肉可发生于胃到直肠的任何部位,息肉引起的临床胃肠道症状常包括胃肠道出血、腹痛、肠套叠和不完全性肠梗阻等。此外,胃肠道息肉常呈多部位、多灶发生,大小不一,在组织病理上以错构瘤性息肉为主,可合并增生性息肉和腺瘤性息肉,后者可发生恶变。息肉恶变率与息肉的大小有关,直径超过3cm的息肉恶变率约15%。临床治疗的目的主要针对胃肠道息肉及其引起的症状,故对于出现临床症状的患者要采取相应的处理措施,包括内镜下较大息肉的摘除或切除术、多发息肉的肠段手术切除等。随着人们对该病进一步的研究发现,不仅PJS患者消化道息肉癌变的风险较高,而且常常伴发生殖系统和其他器官的良性或恶性肿瘤。最近的研究认为,定位于19p13.3区域。PJS是由于19号染色体短臂STK11基因突变而形成的,其结果导致氨基酸的改变和终止信号的提前出现,STK11基因的翻译和转录发生异常,使丝氨酸/苏氨酸蛋白激酶失活。近来的一些研究认为,并不是所有的PJS患者都有STK11基因突变,LKB1/STK11基因的胚系突变可在60%家族性和50%散发性PJS患者中检测出,说明PJS患者STK11基因突变位点和形式的多样性,不仅与遗传背景有关,也可能与患者生存环境有关。
PJS多有家族性遗传病史、典型的皮肤黏膜色素斑、多发的消化道息肉以及慢性消化道出血、不规则腹痛、反复出现的肠梗阻及肠套叠等为特点,结合患者的临床表现特点,辅以X线钡餐及胃肠内镜检查,有助于确诊。但也有部分病例仅出现黑色素斑而无胃肠道病史。
【病例介绍】
病史
男性患者,21岁。以腹痛、腹胀1个月余,加重1天为主诉入院,1个月前无明显诱因出现腹部胀痛,并逐渐加重,以脐周为主,呈阵发性,可自行缓解。不伴发热,近一天呕吐胃内容物2次,吐后腹胀痛有所缓解,无呕血及黑便,进食差,体重1个月内下降约4kg。患者有PJS家族遗传史(父亲患有PJS)。既往史:7年前因肠息肉发生肠套叠行肠部分切除手术。
体格检查
T 36.4℃,P 81次/min,BP 109/75mmHg,R 18次/min。口唇及其周围,口腔黏膜、手足掌及指趾末端的掌面散在性明显色素沉着,为黑斑或黑褐色斑(图1)。
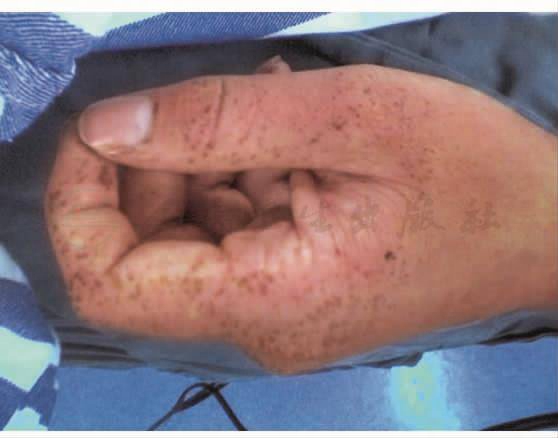
图1 手可见明显色素沉着
腹平坦,上腹正中可见手术纵行疤痕,左上腹有压痛,无反跳痛及肌紧张,肝、脾肋下未触及,Murphy征阴性,移动性浊音阴性,肠鸣音约3次/min。
辅助检查
立位腹平片:膈下未见游离气体影。左中腹部可见多个呈阶梯状排列的短气液平面,肠管略扩张,可见空肠环形皱襞,结肠内可见少量气体(图2)。诊断:符合小肠不全梗阻改变。
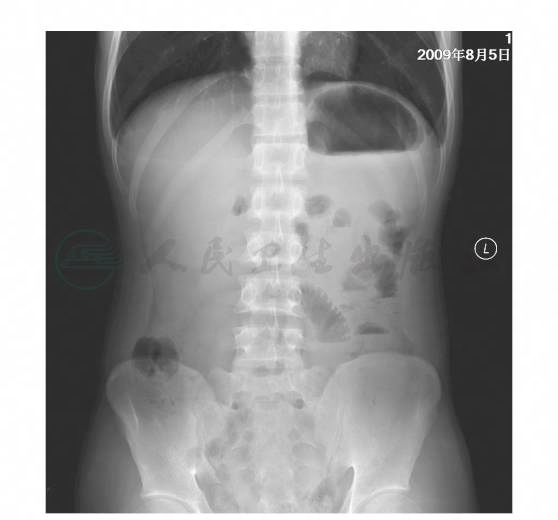
图2 立位腹平片示多个呈阶梯状排列的短气液平面,肠管略扩张
入院诊断
1.小肠不全梗阻
2.色素沉着息肉综合征(Peutz-Jeghers综合征)
1.收入病房后予禁食水、抗感染、补液、保肝、抑酸、心电监护等对症治疗。密切观察病情。同时完善全腹增强CT、电子纤维结肠镜以进一步明确诊断。完善心电图、心脏彩超、肺功能及其他常规生化检查,以进一步评估患者心肺功能状态、营养状态。全腹增强CT:上腹部空肠肠管扩张,右中下腹靠近回盲部局部可见一软组织密度团块影,内见少量脂肪影,肠壁明显增厚,并见少量水样密度影包绕。结肠肠腔内可见较多肠气影。增强:右中下腹局部肠管管壁增厚、强化,并见管腔内见血管强化影(图3~图7)。

图3 腹部增强CT示局部肠管管壁增厚、强化,并见管腔内见血管影(一)
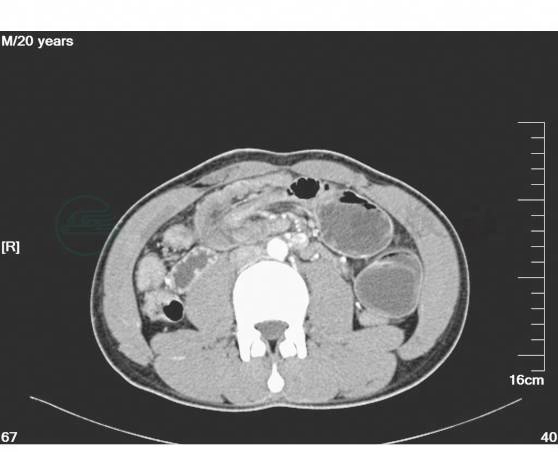
图4 腹部增强CT示局部肠管管壁增厚、强化,并见管腔内见血管影(二)

图5 腹部增强CT示局部肠管管壁增厚、强化,并见管腔内见血管影(三)
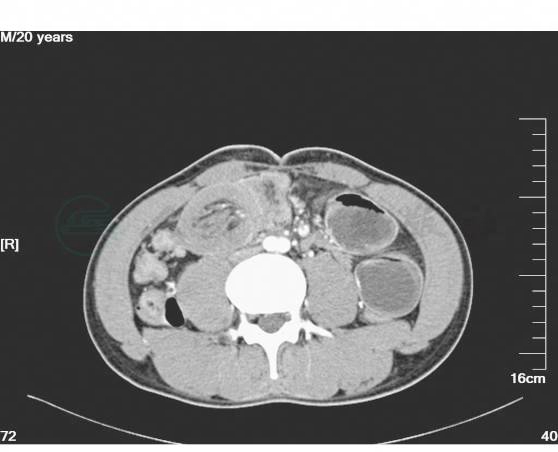
图6 腹部增强CT示局部肠管管壁增厚、强化,并见管腔内见血管影(四)
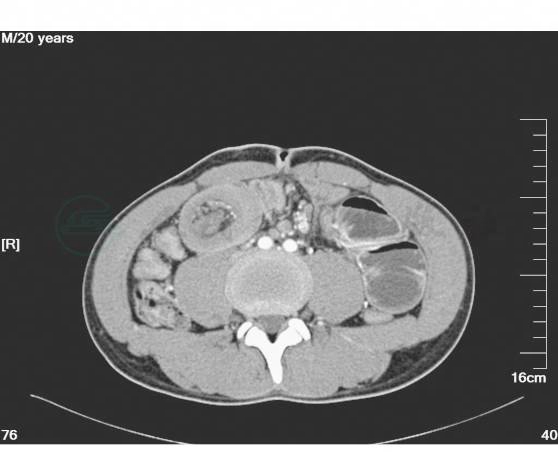
图7 腹部增强CT示局部肠管管壁增厚、强化,并见管腔内见血管影(五)
诊断:符合小肠梗阻改变,考虑肠套叠可能大,空肠回肠型?伴局部肠壁缺血水肿。电子纤维结肠镜:进镜抵达回肠末端,距肛门5cm见一带蒂息肉,大小约0.3cm×0.5cm,距肛门30cm见一带蒂息肉,大小约1.5cm×1.0cm,表面充血,分别取活检组织。其余大肠黏膜光滑,色泽正常,血管纹理清晰(图8~图11)。
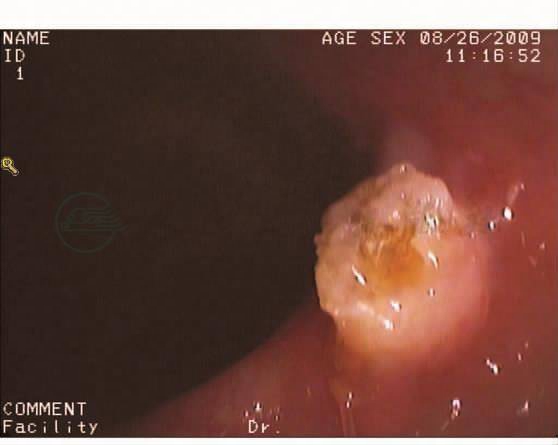
图8 肠镜示距肛门5cm见一带蒂息肉,大小约0.3cm×0.5cm

图9 距肛门30cm见一带蒂息肉,大小约1.5cm×1.0cm(一)
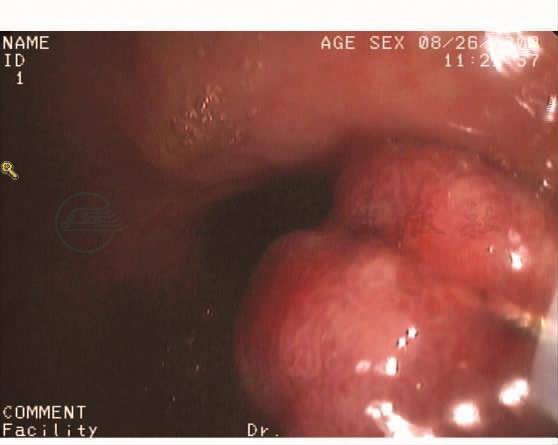
图10 距肛门30cm见一带蒂息肉,大小约1.5cm×1.0cm(二)
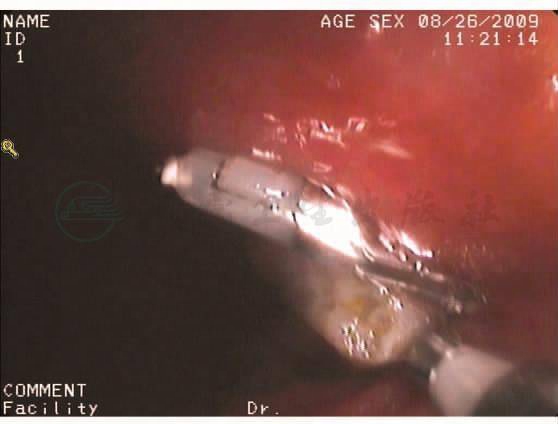
图11 肠镜下取活检
诊断:结肠多发息肉。病理回报为增生性息肉(图12)。

图12 病理诊断为增生性息肉
2.完善血常规、血型、尿常规,肝、肾功、血糖、离子、肝炎病毒、HIV等化验。化验结果回报:白细胞12.2×109/L,中性粒细胞百分比80.5%,血红蛋白110g/L,白蛋白33.8g/L,总蛋白56.6g/L,总胆红素13.5μmol/L,非结合胆红素9.4μmol/L,谷丙转氨酶(ALT)35.0U/L,谷草转氨酶(AST):45.0U/L,血、尿淀粉酶,血清离子等未见异常。
3.术前准备:备血,备皮,留置胃肠减压,留置导尿。
4.严密观察腹部体征和生命体征,同时给予抗生素、抑酸药、营养补液,准备急诊手术。手术简要经过:全麻成功,病人仰卧。消毒术区皮肤,铺无菌手术巾。取右侧经腹直肌原切口20cm,切除原右上腹切口瘢痕,入腹探查:原切口下方肠管与腹部粘连严重,小心分离与腹壁粘连的肠管,距Treitz韧带80cm处小肠肠管发生套叠,近端肠管套入远端,套叠部分长约45cm,近端肠管肿胀,远端空虚,套叠两端肠管可及管腔内质软肿物,约3cm×2cm,将套叠的肠管松解,套叠的肠管明显充血肿胀,无变黑坏死,但因该段肠管内有较大息肉,如不予切除,术后肠套叠复发可能性极大,遂将该段肠管切除,行小肠端端吻合,吻合后探查吻合口通畅,血运良好。距Treitz韧带60cm、距回盲部35cm小肠肠管管腔内可及质软肿物,约2.5cm×1.5cm,给予局部切开肠壁,内为息肉,将息肉切除,肠壁全层加浆肌层缝合。探查结肠未发现异常。确切止血,盐水冲洗腹腔,盆腔置引流管一枚。清点纱布器械无误,逐层缝合关腹,术终。术中失血约200ml,未输血。术中诊断:Peutz-Jeghers综合征,空肠套叠,肠不全梗阻。
5.术后给予抗感染、抑酸、营养治疗,术后3天排气,一周后试进流食,无腹痛、腹胀,排气、排便正常,12天切口拆线,痊愈出院。













